调强放射治疗条件下根治性宫颈癌的长期生存报道
陈默 黄荣 蒋军
广东省佛山市第一人民医院胸腹放疗科(广东佛山528000)
2018年,全世界范围内有新发宫颈癌共569 847例,有311 365 例患者死于该疾病[1]。根治性同步放化疗是局部晚期宫颈癌的主要治疗方法,与单纯根治性放疗比较可降低30%~50%的疾病相关死亡风险[2-6]。GOG120 报道了每周顺铂化疗同步放疗对比5-氟尿嘧啶(5-Fu)联合顺铂及羟基脲的化疗方案同步放疗,结果显示每周同步顺铂治疗方案等效且用药更为便捷[5]。基于上述背景,以顺铂为基础的同步放疗成为局部晚期宫颈癌患者的标准治疗方法。调强放射治疗(intensity-modulated radiotherapy,IMRT)是近些年发展起来的精准放射治疗技术。与既往常规放疗(2D-RT)或三维适形放疗(3D-CRT)治疗相比较,IMRT 在给予肿瘤目标治疗剂量的同时可降低血液系统、胃肠道及泌尿生殖系统相关毒性反应的发生[7-10]。尽管IMRT 在宫颈癌的治疗应用愈来愈广泛[11],但目前国内仍缺乏采用IMRT 根治性治疗宫颈癌的长期生存结果的报道。因此,本研究回顾分析了在我中心接受根治性调强放疗的97 例宫颈癌患者的临床资料,报道如下。
1 资料与方法
1.1 一般资料本研究得到佛山市第一人民医院伦理委员会的批准。选取2012年7月至2015年12月于佛山市第一人民医院接受根治性放疗的宫颈癌患者共97 例。纳入标准:(1)病理确诊为宫颈癌(鳞癌、腺癌或腺鳞癌),临床病例信息及随访资料完整者;(2)初诊患者,接受以根治为目的的调强放射治疗或放化疗及高剂量率妇科后装治疗;(3)治疗前完善胸片/胸部CT,全腹部MRI 明确盆腔及腹膜后淋巴结转移情况,排除其他部位远处转移。
1.2 治疗
1.2.1 全组患者均接受IMRT根据临床体检及影像学检查结果勾画原发肿瘤靶体积(gross target volume,GTV),包括宫颈原发肿瘤(GTVp)及转移淋巴结(GTVn)(短径≥1 cm)。单纯盆腔放疗组治疗的临床肿瘤靶体积(clinical target volume,CTV)范围包括:全子宫、宫颈、宫旁组织、阴道的上1/2(阴道下1/2受累的患者靶区则包括全阴道)、骶前、闭孔、盆腔淋巴结引流区(髂内、髂外及髂总淋巴结引流区),对于临床分期ⅢA 期(肿瘤侵犯下1/3 阴道)和腹股沟淋巴结阳性的患者,治疗范围则包括双侧腹股沟淋巴结引流区,治疗上界达L4-L5 之间。对于临床诊断髂总淋巴结转移或腹膜后淋巴结转移的患者放疗范围包括腹膜后淋巴结引流区。CTV(腹膜后淋巴结引流区)前界为腹主动脉及下腔静脉前缘,后界为椎体前缘,左侧界为左侧腰大肌,右侧界为下腔静脉右缘,下界与盆腔淋巴结引流区相连续,上界至左肾静脉水平(图1)。在有淋巴结转移情况下,CTV 需在上述范围基础上于淋巴结周围外扩5 mm 左右,上界至淋巴结上方1.5~2.0 cm。计划肿瘤靶体积(planning target volume,PTV)为CTV 周围外放7 mm,头脚方向外放10 mm。其中PTV-CTV 放疗的剂量为DT 45~50.4 Gy,PTV-GTVn 的放疗剂量为DT 56.0~60.0 Gy,分割剂量均为1.8~2.0 Gy/Fr,周一至周五连续治疗。
剂量限制:PTV 剂量V95≥95%且V110<20%。危及器官包括膀胱、小肠、直肠、肾脏、脊髓和股骨头。剂量限制如下:膀胱V45<35%,直肠V45<60%,肾脏V18<20%,股骨头V30<15%,盆腔V40<30%,脊髓D1cc ≤40 Gy。
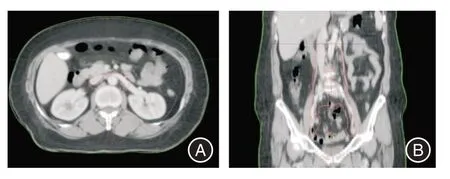
图1 腹膜后淋巴结引流区勾画示意图Fig.1 Images of external-beam radiotherapy detailing clinical target volume of irradiation fields to the para
1.2.2 后装治疗根据治疗期间肿瘤的消退情况择期行高剂量率妇科后装治疗,采用二维后装技术,DT 30 Gy/5 Fr 或28 Gy/4 Fr,每周一次。后装治疗的中位时间为盆腔外照射开始后33 d。A 点最终的处方剂量达EQD2 80~90 Gy。
1.2.3 同步化疗全组患者共采用以铂类为基础的两种化疗方案,包括:(1)单药铂类:单药顺铂30 mg/m2或奈达铂30 mg/m2,每周方案,共4 ~6 周期。(2)双药方案:紫杉醇40~50 mg/m2+ 顺铂20 mg/m2或卡铂AUC2,每周方案,共4 ~6 周期。患者采用的具体化疗方案及治疗剂量遵循我院宫颈癌诊疗常规。
1.3 随访全部治疗结束后2年内,每隔3 个月随访1 次。3 ~5年内,每隔6 个月随访一次。5年后,每隔1年随访一次。主要的预后指标包括总生存率(overall survival,OS)、无病生存率(disease-free survival,DFS)、无远处转移生存率(distant metastasis-free survival,DMFS)和无局部复发生存率(local recurrence-free survival,LRFS)。OS 定义为治疗开始至任何原因导致的患者死亡或末次随访,DFS定义为自治疗开始之日起至患者出现任何部位的治疗失败的时间或末次随访,DMFS、LRFS 的定义依此类推。次要的研究终点包括急性毒性反应和晚期毒性反应评价。急性胃肠道毒性和血液毒性反应评价及慢性毒性反应评价标准依据RTOG 的放疗评价标准分级。
1.4 统计学方法使用SPSS 22.0 统计软件,用Kaplan-Meier 法计算生存率,用Log-rank 法进行单因素分析。根据单因素分析结果及常见临床危险因素将年龄、病理类型、淋巴结转移情况、FIGO 分期和肿瘤大小纳入Cox 比例风险回归模型进行多因素分析,检验水准为α=0.05。
2 结果
2.1 临床资料特征全组患者中位年龄55 岁,年龄范围26~75 岁。根据2009 FIGO 分期,其中ⅠB期患者7 例(7.2%),Ⅱ期患者58 例(59.8%),Ⅲ期患者27 例(27.7%),ⅣA 期患者5 例(5.2%)。其中42 例患者(43.3%)合并有淋巴结转移,其中7 例腹膜后淋巴结转移及1 例髂总淋巴结转移患者接受了腹膜后淋巴结引流区域放疗。接受单纯放疗的患者共10 例(10.3%),余下患者接受铂类为基础的单药或双药同步化疗。见表1。

表1 全组病例临床特征Tab.1 Demographic and clinicopathological characteristics of patients with cervical cancer
2.2 治疗失败情况和生存情况全组患者中位随访期为65 个月,范围2.2~86.7 个月。5年的OS、DFS、DMFS 和LRFS 分别为76.0%、65.7%、75.5%和81.4%。见图2。
全组共34 例(35.1%)患者出现疾病进展,其中11 例(11.3%)为单纯局部复发,16 例(16.5%)患者为单纯远处转移,共7 例患者同时出现远处转移及局部复发。在18 例局部区域复发的患者当中,有6 例为单纯腹膜后淋巴结复发(放射野外),1 例腹股沟淋巴结复发(放射野内)。23 例出现远处转移的患者当中,有5 例为单纯非区域淋巴结转移。见表2。最常见的脏器转移为肺转移(10 例),其他的转移部位包括骨转移(5 例)、肝转移(4 例)、肾上腺转移(1 例),见表2。

表2 全组患者治疗失败情况Tab.2 Failure patents for patients with cervical cancer例(%)
2.3 危险因素分析单因素分析中,年龄(≥65 岁vs. <65 岁,P= 0.045)、病理类型(鳞状细胞癌vs.腺癌/腺鳞癌,P= 0.004)为OS 的危险因素。相对于腺癌/腺鳞癌,鳞癌的病理类型具有更好的DFS(P= 0.092)和DMFS(P= 0.073),但LRFS 在鳞癌与腺癌/腺鳞癌组差异无统计学意义(P=0.532)。将年龄、病理类型、淋巴结转移情况、FIGO 分期、肿瘤大小纳入Cox 多因素分析。结果显示,仅病理类型(鳞癌vs. 腺癌/腺鳞癌,P= 0.011)为OS 的独立危险因素。见表3。
2.4 毒性反应放射治疗期间,每周对患者的急性毒性反应进行评估。共17 例(17.5%)患者出现3 级及以上不良反应,主要为血液毒性。其中1 例为4 度骨髓抑制,1 例患者在放射治疗结束后2 周因肠道梗阻所致脓毒血症死亡。共36 例(37.1%)患者出现晚期毒性反应,主要为1 ~2级放射性直肠炎,其中4 例患者出现MRI 提示的放射性膀胱炎。
3 讨论

图2 全组患者生存率Fig.2 Survival curves for the entire cohort of 97 patients with cervical cancer

表3 全组患者的多因素分析Tab.3 Multivariate analysis of prognostic factors in 97 patients with cervical cancer
随着放射治疗技术的发展和我国经济水平的提高,IMRT 愈来愈广泛的应用于宫颈癌的根治性治疗。IMRT 在给予肿瘤组织高剂量放疗的同时,可以最大限度的保护周围正常组织器官,与常规放疗相比,可以减少宫颈癌患者胃肠道毒性反应和血液系统毒性反应的发生[7-8]。有研究显示IMRT 技术的应用可能提高患者的生存,但差异无统计学意义[12]。由于宫颈解剖结构的特殊性,IMRT的高度适形性可能会造成肿瘤靶区的漏照[13]。LIN 等[14]荟萃分析结果提示,IMRT 与既往的常规放疗(2D-RT)或三维适形放疗(3D-CRT)相比较,生存结果相似且显著减少了胃肠道和泌尿生殖系统相关的毒性反应。然而,该结果仍待大型随机临床研究的验证。因此,对于IMRT 在宫颈癌中的治疗应用仍存在争议。
本研究回顾性分析了IMRT 治疗条件下根治性宫颈癌的长期生存及毒性反应结果。全组5年的OS、DFS、DMFS 和LRFS 分别为76.0%、65.7%、75.5%和81.4%,与既往研究类似。DU 等[15]报道了57 例IMRT 治疗条件下ⅡB-ⅢB 期宫颈癌根治性放疗结果,其5年的OS 和DFS 分别为71.2%和64.9%。LIN 等[16]回顾性分析比较了331 例容积调强放疗(VMAT)和67 例IMRT 放疗的生存结果,两组3年的OS 分别为80.5%和76.2%,3年的LRFS 分别为88.7%和83.1%。
CHEN 等[17]报道了IMRT 治疗局部晚期宫颈癌的毒性反应情况。共26.6%发生3 ~4 级急性胃肠道或血液系统毒性反应,共10.9%发生3 ~4 级晚期胃肠道或血液系统毒性反应。在LIN 等[16]的研究中,IMRT 治疗相关的3 ~4 级急性血液毒性发生率为4.5%,3 ~4 级晚期毒性反应发生率为11.9%。本研究中,3 级以上急性毒性反应的发生率为17.5%,3 ~4 级晚期毒性反应发生率为4.1%。尽管关于毒性反应发生率的报道不一,但总体上均较既往2D-RT 或3D-CRT 低。
近年来,随着宫颈细胞学筛查的推广,宫颈鳞癌的发病率逐步下降,而宫颈腺癌的发病率较前相对有所上升[18]。病理类型是否为独立危险因素,目前报道不一。ROSE 等[19]认为在同样接受根治性放化疗的前提下,腺癌/腺鳞癌的病理类型并不影响宫颈癌患者的生存。KATANYOO 等[20]研究认为宫颈腺癌与鳞癌相比虽然对治疗的反应率略低,且需要更长的时间达到完全缓解,但病理类型并非生存的独立危险因素。YOKOI 等[21]报道225例局部晚期(ⅡB-ⅣA 期)宫颈癌的治疗结果,其中鳞癌患者225 例,腺癌/腺鳞癌患者24 例,结果显示,腺癌/腺鳞癌是OS和DFS的独立危险因素。在本研究中,腺癌/腺鳞癌病理类型是总生存的独立危险因素(鳞癌vs.腺癌/腺鳞癌,P= 0.011)。因此,非鳞癌病理类型,特别是腺癌在宫颈癌中的预后意义还需要进一步验证。
目前,国内关于宫颈癌IMRT 治疗条件下5年长期生存报道仍较少。本研究中,治疗失败原因依次为远处转移、局部区域复发和腹膜后淋巴结复发,长期生存率与国际报道相似,治疗相关的毒性反应可接受。为IMRT 在宫颈癌中的根治性治疗进一步应用提供了依据。

