不同运动强度和训练时间对紫红笛鲷幼鱼血清生理生化指标的影响
范 雯,刘 永,魏小岚,肖雅元,韦芳三,周德新,唐文乔,李纯厚,3
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院南海水产研究所,农业农村部南海渔业资源开发利用重点实验室,广东省渔业生态环境重点实验室,广州 510300;3.南方海洋科学与工程广东省实验室,广州 511458;4.广州大学生命科学学院,广州 510006)
紫红笛鲷(Lutjanus argentimaculatus)属于鲈形目(Perciformes),笛鲷科(Lutjanidae),笛鲷属,是一种暖水性浅海中下层大型鱼类,分布于东南亚和中东海域印度洋、太平洋中部和西部[1]。在我国主要分布在南海诸岛及海南、广东和台湾等省的近岸珊瑚礁、岩礁及沙泥底质浅海水域。紫红笛鲷作为我国最有经济价值和发展前景的物种之一,由于渔业环境遭受破坏和过度捕捞导致其资源量骤减,目前南方近海已难捕到其野生亲鱼[2]。要从根本上恢复紫红笛鲷资源,除了改善海洋生态环境和降低捕捞强度之外,人工增殖放流是一种有效、快捷的方式。然而增殖放流多使用人工繁育的鱼苗,人工孵育鱼苗在自然海域的成活能力较野生种群低,因此,如何提高放流物种的存活率和野外适应性,是目前研究的重点和难点问题。
鱼类具有逆流游泳的运动习性,研究显示运动能够通过促进动物的心肺功能提高机体代谢水平进而提高鱼体的抵抗力[3],通过游泳运动训练可以提高鱼类释放到野外环境中的成活率并促进鱼类生长[4]。虞顺年等[5]对黑棘鲷(Sparus macrocephalus)进行2周的运动训练发现,适当强度(2.0体长·s-1)的运动训练,有利于增强鱼的免疫力和抗氧化能力,提高抵抗力。魏小岚等[6]将斜带石斑鱼(Epinephelus coioides)在不同的水流下进行8周的训练实验,结果发现适当的水流速度(1.0体长·s-1)刺激不仅能够使鱼体生长地更快,而且能够提高鱼体免疫和抗氧化能力。鱼类运动训练展开于20世纪60年代,关于鱼类的运动训练研究在国外多集中于鲑鳟鱼类[4,7],尤 以 大 西 洋 鲑(Salmo salar)[8-9]和 虹 鳟(Oncorhynchusmykiss)[10-12]为主,在国内鱼类运动训练研究以中华倒刺鲃(Spinibarbus sinensis)等鲤科 鱼 类[13-15]和 尼 罗 罗 非 鱼(Oreochromis niloticus)[16]为主,关于笛鲷科鱼类报道较少。因此,本研究以笛鲷科紫红笛鲷幼鱼作为研究对象,通过不同运动强度和运动时间的训练交互作用,研究鱼体的生长率、存活率、生理生化等与野外存活相关的指标,以期为提高增殖放流物种的存活率和优化渔业资源增殖放流效果提供可靠的科学依据。
1 材料与方法
1.1 实验材料
紫红笛鲷鱼苗购自深圳市龙岐庄实业发展有限公司,挑选同一批培育出的规格均匀的鱼苗,实验开始前于户外鱼塘暂养一周以排除应激死亡。养殖水温为(26.0±0.5)℃,pH 8.3±0.1,溶解氧量(8.0±0.2)mg·L-1,光照周期为12L∶12D。每天投喂人工饲料2次(海水鱼配合饲料,广东越群海洋生物研究开发有限公司),每次投喂量为鱼体鲜重的3%,投喂时间是9∶00和17∶00,饲料营养成分:粗蛋白≥45%、粗脂肪≥6%、粗纤维≤5%、粗灰分≤18%、钙≥2.5%、总磷≥1.2%、水分≤12%、赖氨酸≥2.2%,投喂1 h(可以完全吃完饵料)。
1.2 实验装置
本实验采用的鱼类循环水运动训练装置,为本课题组自行设计(专利公开号:CN107593525A)[5]。装置分为上下两部分区域。水流经下部潜水泵抽吸,沿两条管道升至上部训练区域,成180°水平分布,使管上出水口位于上部区域底部,可沿壁形成涡形水流,水流经中部管道排入下部净化区域,给水中鱼类造成环形泳道,以便其进行逆流游泳行为。水流在装置内形成闭路循环通路,经净化后水质安全稳定,且可通过与水泵相连管道的开关阀门调节流速以控制鱼类游泳训练的强度。
1.3 实验方法
选健康的紫红笛鲷幼鱼[体长(7.57±0.33)cm,体质量(13.36±0.13)g],通过预实验确认在该环形泳道中,本规格紫红笛鲷的临界游泳速度,及其1/2和1/4/速度,设置0(对照组)、1.43、2.87、5.74体长·s-14个训练强度组,每组3个平行,每个平行20尾鱼(减少因空间和食物争夺致使鱼体受伤害)。分别于第7、14、28天进行3次取样。为减小应激伤害,实验正式开始前,进行24 h观察并缓慢提高水流速度,作为紫红笛鲷适应刺激的缓冲期。实验开始后,每日训练时间从8∶00到20∶00,投料时间为9∶00和17∶00,投喂时停止训练,饱食投喂后1 h清理残饵及粪便,并恢复训练。日换水量约为15%,实验水环境条件如前。
取样前禁食24 h,取样时用洁净捞网在每个平行样本中轻轻捞取3尾紫红笛鲷,移至加有少量丁香酚麻醉剂的水中,以降低后续采样对鱼的刺激。麻醉后尾静脉取血。全血室温静置2 h后3 000 r·min-1离心10 min,吸取上层血清,保存于-80℃。
1.4 血液生化指标测定
取冻存的血清样品,4℃融化,使用全自动生化分析仪(7600型号,日本日立公司)检测其基础血清学指标:血糖(glucose,GLU);总胆固醇(total cholesterol,TCHOL);甘 油 三 酯(triglyceride,TG);高密度脂蛋白(high density lupoprotein,HDL);低密度脂蛋白(low density lupoprotein,LDL);总蛋白(total protein,TP);白蛋白(albumin,ALB);球蛋白(globulin,GLB);谷丙转氨酶(glutamic pyruvic transaminase,GPT);谷草转氨酶(glutamic oxalacetic transaminase,GOT)。
1.5 免疫相关指标测定
使用试剂盒进行检测,试剂盒信息如下:
酸性磷酸酶(acid phosphatase,ACP)采用分光光度法检测;碱性磷酸酶(alkaline phosphatase,AKP)采用可见光比色法检测;补体3(complement3)和补体4(complement 4)采用免疫比浊法检测;溶菌酶(lysozyme,LYZ)采用比浊法检测。皮质醇(cortisol,COR)采用酶联免疫试剂盒检测,用酶联免疫分析法中的双抗体夹心法测定血清中COR水平。免疫球蛋白M(immunoglobulin M,IgM)采用酶联免疫试剂盒检测,用酶联免疫分析法中的双抗体夹心法测定血清中IgM水平。上述指标所有试剂盒均购于南京建成生物工程研究所。抗菌活性(antimicrobial,ANT)参考MACKINTOSH等方法[17]进行血清抗菌活性检测。根据以下公式计算:Ua=(空白组菌落数-血清组菌落)/空白组菌落数。
1.6 抗氧化相关指标测定
抗氧化力指标采用试剂盒测定。丙二醛(malondialdehyde,MDA)测定试剂盒(TBA法),超氧化物歧化酶(superoxide dismutase,SOD)分型测试盒(羟胺法),过氧化氢酶(catalase,CAT)测定试剂盒(可见光法),还原型谷胱甘肽(glutathione,GSH)测定试剂盒(分光光度法),谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPX)测定试剂盒(比色法),总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒(比色法),蛋白质羰基(protein carbonyl)含量测定试剂盒(紫外比色法),过氧化氢(hydrogen peroxide,H2O2)测定试剂盒(比色法),抑制羟自由基能力(inhibition of hydroxyl radicals,IHFRC)试剂盒(比色法),谷胱甘肽S转移酶(glutathione S transferase,GSH-ST)试剂盒(比色法)。
1.7 统计分析
实验数据用SPSS 17.0软件进行双因素方差分析(two-way ANOVA),统计值用平均值±标准误差(Mean±SD)表示,显著水平定为P<0.05。
2 结果与分析
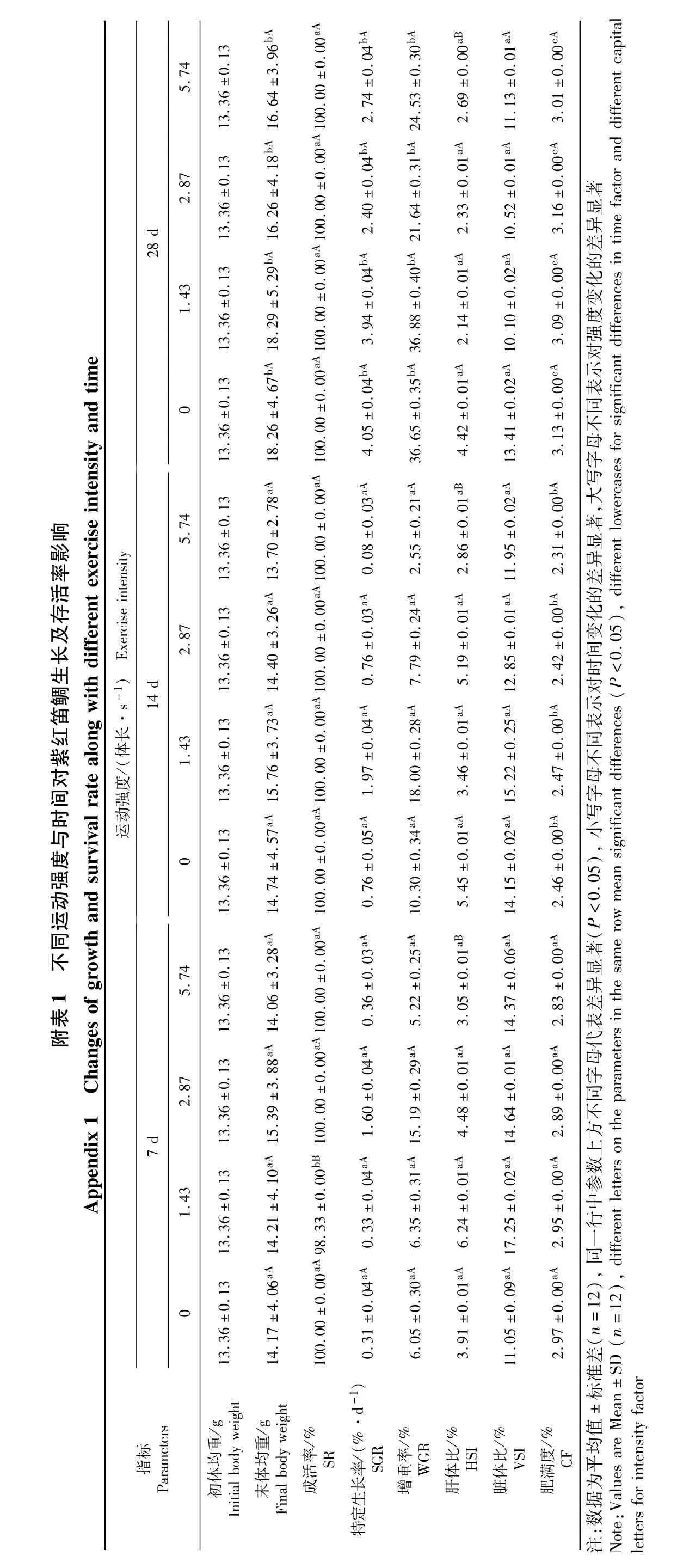
2.1 运动强度和训练时间对紫红笛鲷幼鱼生长及存活率的影响
在训练期间,紫红笛鲷幼鱼体质量均有增加(附表1)。成活率方面,在7 d内仅1.43体长·s-1组死亡1尾,经分析为意外死亡,其他组均达到100%成活率,因此成活率不具有统计学意义。特定生长率、增重率、肝体比、肥满度在运动组与对照组之间差异不显著,且各训练组之间差异也不显著;从训练时间对上述指标的影响上看,对照组与训练各组都有显著变化(P<0.05),即这些生长指标主要受时间影响。训练与否,对紫红笛鲷幼鱼的以上生长指标影响甚微。
脏体比在训练组与对照组之间有显著差异(P<0.05),且低强度1.43体长·s-1组的脏体比较高,而训练时长对脏体比的影响不显著。总体上,运动训练对紫红笛鲷幼鱼的生长无显著影响。
2.2 运动强度和训练时间对紫红笛鲷幼鱼基础血清生化指标的影响
如附表2所示,紫红笛鲷幼鱼的基础血清生化水平在训练组和对照组之间及不同强度的训练组之间均差异显著(P<0.05)。血糖、总胆固醇、血脂、脂蛋白、转氨酶(图1-A,B,C,D,E,I,J)在训练水平为1.43体长·s-1和2.87体长·s-1时显著低于对照组,在训练水平为5.74体长·s-1时则显著高于对照组。总蛋白、白蛋白及球蛋白在训练组1.43体长·s-1和2.87体长·s-1中显著高于对照组,在训练组5.74体长·s-1则显著低于对照组(图1)。
时间对紫红笛鲷幼鱼的各项基础血清生化指标总体上也有显著影响(P<0.05),训练7、14、28 d后的基础血清生化水平总体上有显著差异(P<0.05)。总蛋白(图1-F)随训练时间延长而升高,血糖、总胆固醇、血脂、脂蛋白、转氨酶随训练时间延长而降低,但血糖、总胆固醇、总蛋白在14 d与28 d时差异不显著(P>0.05)。训练强度和训练时长两个因素在对基础血清生化指标的影响上具有显著的交互作用(P<0.05),随着训练时间的延长,训练组与对照组的差距及各强度训练组间差距增大。

图1 紫红笛鲷幼鱼的基础血清生化指标随运动强度与时间变化趋势Fig 1 Change of basic serological indicators along w ith exercise intensity and time
2.3 运动强度和训练时间对紫红笛鲷幼鱼血清免疫力水平的影响
紫红笛鲷幼鱼的酸性磷酸酶、碱性磷酸酶、补体C3\补体C4、溶菌酶、抗菌活性、皮质醇、免疫球蛋白(图2-A~H)在训练后与对照组间均呈现出显著差异(P<0.05)(附表2),在1.43体长·s-1和2.87体长·s-1训练后上述指标显著高于对照组;在5.74体长·s-1训练组,以上各项指标则显著低于对照组。免疫指标各训练组之间也有显著差异(P<0.05),在2.87体长·s-1训练组达到相对较高水平。
训练时间对紫红笛鲷幼鱼的免疫力总体上也有显著影响(P<0.05)。免疫球蛋白、磷酸酶、补体C3、溶菌酶、抗菌活性、皮质醇均随训练时间延长而升高,在训练7、14、28 d后有显著差异(P<0.05)。补体C4则在训练14 d中保持升高趋势,然而在训练28 d后回落至与训练7 d时的相似水平。酸性磷酸酶和抗菌活性在训练14 d与28 d差异不显著(P>0.05)。训练强度和训练时长两个因素在对紫红笛鲷免疫力的影响上具有显著的交互作用(P<0.05),随训练时间增长,训练组与对照组的差距及各强度训练组间差距增大。
2.4 运动强度和训练时间对紫红笛鲷幼鱼血清抗氧化水平的影响
紫红笛鲷幼鱼的各项血清抗氧化指标在训练组与对照组间均有显著差异(P<0.05)(图3)。在不同训练强度下,紫红笛鲷幼鱼的血清抗氧化水平在训练组和对照组之间差异显著(P<0.05),在各强度组之间也具有显著差异(P<0.05)(附表2);超氧化物酶、谷胱甘肽相关酶类、总抗氧化能力、过氧化氢、抑制羟自由基能力(图3-C,D,E,F,H,I,J)在训练强度为1.43体长·s-1和2.87体长·s-1时显著高于对照组,其中在2.87体长·s-1训练组达到相对较高水平,在强度为5.74体长·s-1时其水平则显著低于对照组。丙二醛、超氧化物歧化酶(图3-A,B)在1.43体长·s-1和2.87体长·s-1训练组中的水平显著低于对照组,在训练强度为2.87体长·s-1达到相对较低水平,在5.74体长·s-1训练组中的水平则显著高于对照组。
训练时长对血清抗氧化水平总体上也有显著影响(P<0.05)。训练时间为7、14、28 d时,抗氧化水平总体上具有显著差异(P<0.05)。丙二醛与超氧化物酶在训练14 d与28 d后差异不显著(P>0.05)。训练强度和训练时长两个因素在对鱼体抗氧化水平的影响上具有显著的交互作用(P<0.05),随训练时间延长,训练组与对照组的差距及各强度训练组间差距增大。
训练时长对蛋白质羰基水平的影响不显著(P>0.05),训练强度对于蛋白质羰基的影响也仅在对照组与低流速组之间具有显著性差异(P<0.05)。
3 讨论
3.1 运动强度和训练时间对紫红笛鲷幼鱼血清生化指标的影响
鱼类应激的短期生理反应包括接受应激信号分泌肾上腺素、刺激头肾组织释放皮质醇、提供能量和涉及生理生化的代谢反应[33]。血浆皮质醇、血糖等指标被广泛地用于评估鱼类所受到的刺激[33],如本研究中迫使其做逆流游泳运动的水流刺激。通过对紫红笛鲷幼鱼28 d的训练研究发现,在水流速为1.43体长·s-1和2.87体长·s-1时鱼体血清中血糖、总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、谷丙转氨酶以及谷草转氨酶均显著低于对照组,总蛋白和白蛋白显著高于对照组,表明适度的训练有助于紫红笛鲷幼鱼降低体内血糖血脂和胆固醇,促进蛋白吸收,进而提高鱼体的健康水平。对黑鲷(S.acrocephalus)[5]的研究发现适度的运动训练(2.0体长·s-1)同样具有调节血糖水平、降低血脂、提高免疫力、降低肝损伤的作用。其原因可能是长期或短期适宜的运动加强了鱼体代谢能力,促进机体对糖和胆固醇的代谢和转化以及蛋白质的合成[13]。另外,本研究发现5.74体长·s-1训练组鱼体在28 d训练过程中,血液指标的变化与1.43体长·s-1和2.87体长·s-1训练组的变化相反,表明过高的训练强度和过长的训练时间可能会降低紫红笛鲷幼鱼血清生化指标,进而损害了鱼的健康。研究显示,当鱼体长期处在高强度的游泳运动时,不仅会过量消耗体内的能量储备,增加运动性疲劳,还可造成转氨酶的含量升高。转氨酶主要存在于肝脏中,只有当肝脏受到损伤才会大量释放到血液中,作用于糖类、脂肪和蛋白质的代谢和转运[19]。当鱼体长期处在高强度运动状态,鱼体中转氨酶含量高于正常值,导致血糖和脂质代谢功能紊乱,血糖和血脂上升,机体免疫力下降[20-22]。另外,有研究认为水流在过低或过高时都有负面影响,仅适中的强度能带来正面效果[26-27],本研究结果呈现的趋势与其一致。紫红笛鲷幼鱼在训练28 d后的水平与训练14 d水平相近,显著优于训练7 d的效果,即说明训练效果随时长增加而趋于稳定,选择适当的训练时长能在保持训练效果达到相对较好水平的前提下,节约时间和训练设施等成本。
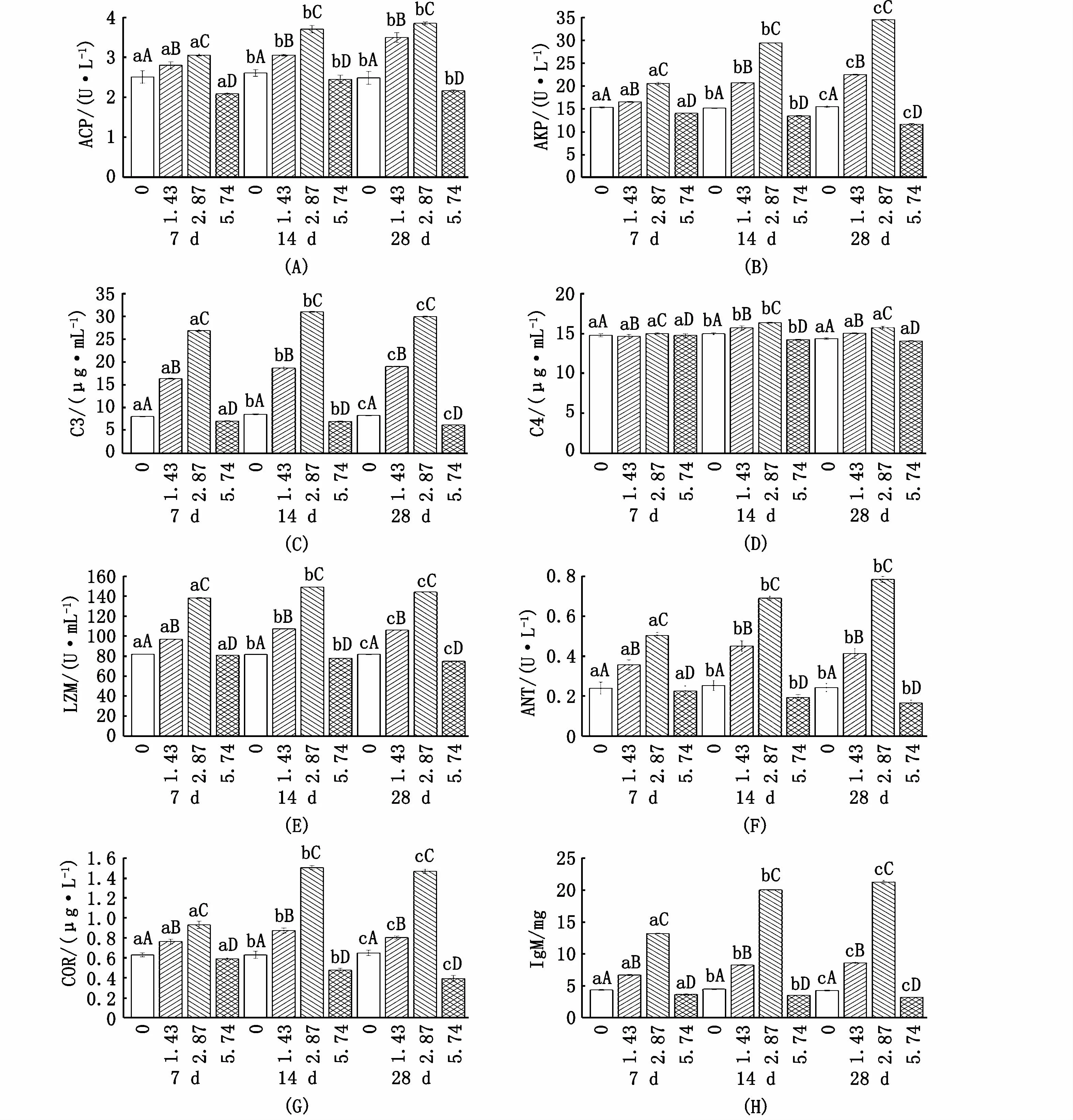
图2 紫红笛鲷幼鱼的免疫学血清生化指标随运动强度与时间变化趋势Fig 2 Changes of immunological serum indicators along w ith exercise intensity and time

图3 抗氧化力血清生化指标随运动强度与时间变化趋势Fig 3 Change of serum indicators of antioxidation along w ith exercise intensity and time
3.2 运动强度和训练时间对紫红笛鲷幼鱼血清免疫力水平的影响
鱼体的生存环境决定了鱼类的免疫功能受多方面因素的影响,如温度、食物以及游泳运动[27]。硬骨鱼的免疫功能由先天性免疫起主要作用。在抵御病原生物侵袭过程中,鱼类的先天性免疫发挥着重要作用[25-26]。紫红笛鲷幼鱼经过28 d的训练实验,鱼体血清中酸性磷酸酶、碱性磷酸酶、补体C3、溶菌酶、抗菌活性、皮质醇以及免疫球蛋白含量在水流速为1.43体长·s-1和2.87体长·s-1时均显著高于其在对照组的含量,其在流速为5.74体长·s-1时的含量则低于其在对照组的含量。补体C3含量及溶菌酶活性升高时,表明机体免疫机能增强[11,28]。血浆皮质醇含量升高常被用来衡量鱼体承受的压力水平适应情况[29-30]。碱性磷酸酶作为巨噬细胞溶酶体的标志性酶,具有杀死外来侵入病原微生物的能力,其浓度升高反映了鱼类机体免疫应答增强[22]。因此,适当的水流刺激(1.43体长·s-1和2.87体长·s-1)训练可以增强紫红笛鲷幼鱼免疫力,而当水流速较高(不低于5.74体长·s-1)时免疫能力下降。同样,对红鳍银鲫(Barbodes schuanenfeldi)、斜带石斑鱼和黑鲷的研究发现,在水流速低于2体长·s-1时,鱼体的免疫水平随着流速的增加而增强,当流速高于2体长·s-1时,鱼体的免疫水平随着流速增加而降低,最终低于对照组[5-6,31]。这可能是过高的运动强度使机体产生了大量自由基,造成细胞损伤,从而使免疫机能下降,增加机体被病原菌感染的风险。另外,本研究显示,鱼类的免疫能力维持可能与持续时间有关[11,32],呈现饱和曲线特征,即在1.43体长·s-1和2.87体长·s-1时鱼体血清中酸性磷酸酶、碱性磷酸酶、补体C3、溶菌酶、抗菌活性、皮质醇以及免疫球蛋白含量随着训练时间的增加趋于稳定,训练组5.74体长·s-1的免疫力随着时间的延长无显著变化。王晓杰等[32]也证实了通过盐度胁迫提升鱼体的免疫能力时,其呈现先增加后稳定的变化趋势。
3.3 运动强度和训练时间对紫红笛鲷幼鱼血清抗氧化水平的影响
分析不同运动强度和训练时间紫红笛鲷幼鱼的血清指标,结果显示鱼体还原型谷胱甘肽、谷胱甘肽过氧化物酶、总抗氧化能力、过氧化氢、抑制羟自由基能力、谷胱甘肽S转移酶浓度或活性先随着训练强度的增加而上升,当训练强度高于2.87体长·s-1时呈现降低的趋势,而丙二醛和超氧化物歧化酶的变化则相反。谷胱甘肽S转移酶具有消除生物体内自由基和解毒的双重功能[37],在生物体内起到抵抗外源物质入侵和细胞毒性防御的作用[38-41]。谷胱甘肽S转移酶随训练强度上升而升高,表明机体代谢自由基的能力随训练强度加大而增强,在训练强度达到5.74体长·s-1时又回落至低于对照组的鱼体水平,说明虽然在一定范围内的训练显著提升了紫红笛鲷的抗氧化力,但过度训练则使机体产生过量的自由基相关产物,且自由基清除系统中的相关酶含量降低,可能是训练对于酶的生成、转运、分泌过程产生了负面影响[34]。总抗氧化能力表示机体抗氧化酶系统和非酶系统的功能状态,代表机体对刺激因素的代偿能力以及反映自由基代谢的水平,是体内组织抗氧化功能的一个常用指标[34]。机体与抗氧化能力相关的酶包括过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶、谷胱甘肽S转移酶[35]。过氧化氢酶催化细胞内过氧化氢分解[36],超氧化物歧化酶是超氧阴离子自由基的清除剂,通过歧化反应保护机体对抗活性氧自由基,超氧化物歧化酶活性的水平间接地反映了鱼体活性氧水平高低[22]。当环境条件发生改变时,体内自由基的生成量会发生变化,抗氧化系统也会发生相应的变化来保护机体免受损伤。本研究中超氧化物歧化酶浓度随运动强度加大而降低,可能是在运动机制中,歧化反应不作为主要的清除自由基途径[18]。本研究中紫红笛鲷幼鱼的总抗氧化能力、超氧化物歧化酶、还原型谷胱甘肽、谷胱甘肽过氧化物酶均随训练强度加大而升高,但当训练强度高于5.74体长·s-1时则降低,甚至有低于对照组的情况。而训练时间的增加对紫红笛鲷幼鱼的抗氧化能力的影响是持续升高的,但在训练28 d后与训练14 d后的水平,经统计学分析比较差异不显著,说明适当强度的运动提高了紫红笛鲷幼鱼的抗氧化能力,而过度运动则反而有损害,且经过一段时间的训练后,鱼体的抗氧化力保持在一定水平,已经达到机体抗氧化系统新的平衡。
丙二醛是细胞脂质过氧化的最终产物,间接反应自由基对机体的损伤程度[39]。在本研究中,随着运动强度提升,紫红笛鲷幼鱼血清中丙二醛水平显著下降,证明自由基代谢水平得到明显促进,而5.74体长·s-1训练组的血清丙二醛含量高于对照组的现象说明,机体在过度训练中产生大量自由基无法被及时清除。从时间变化上看,过度训练使鱼体内产生的丙二醛随时间延长而增多,是机体受自由基损伤持续叠加的显著证明。而2.87体长·s-1训练组中,随时间延长丙二醛逐渐减少,说明适当强度训练能有效控制自由基对机体的损伤,利于鱼体健康。自由基可导致多种生物大分子的损伤,其中包括蛋白质羰基的产生,即不可逆的氧化修饰。通过测定羰基含量可判断蛋白质是否被氧化损伤。氧化的蛋白质与衰老及许多疾病都有关系,蛋白质羰基是机体氧化应激程度的一个重要指标[42-43]。但在本研究中,蛋白质羰基对训练强度和时间变化并无明显响应,可能牵涉更为复杂的机制,不适合作为观察运动训练能否提高成活率的指征之一。总之,适宜的运动强度和训练时间可以增强紫红笛鲷幼鱼血清抗氧化水平,进而增强鱼体的免疫能力。
4 小结与展望
通过对紫红笛鲷幼鱼在不同运动强度和训练时间鱼体血清生理生化指标变化特征的研究发现,适宜的运动强度(1.43体长·s-1和2.87体长·s-1)和训练时间(14~28 d)均可以增加鱼体的健康程度。运动提升鱼体生长速率、代谢水平以及免疫能力,训练时间的延长可使鱼体保持健康状态。紫红笛鲷幼鱼的适宜生长最高流速为1.43体长·s-1,而适宜代谢水平以及免疫能力最高的流速为2.87体长·s-1,表明水流速1.43~2.87体长·s-1可能会存在一个阈值既满足紫红笛鲷幼鱼的快速增长,又能实现免疫能力最大限度的增加。另外,室内驯化水环境和野外的水环境差别很大,主要表现在温度、盐度、食物源以及生存空间的竞争,而模拟真实海域环境的中场实验作为从室内实验到野外实验的过渡是一个必要的过程,后续工作应主要针对运动强度阈值的筛选以及增殖放流前的中场实验展开,以期为紫红笛鲷的增殖放流提供更精确的指导。
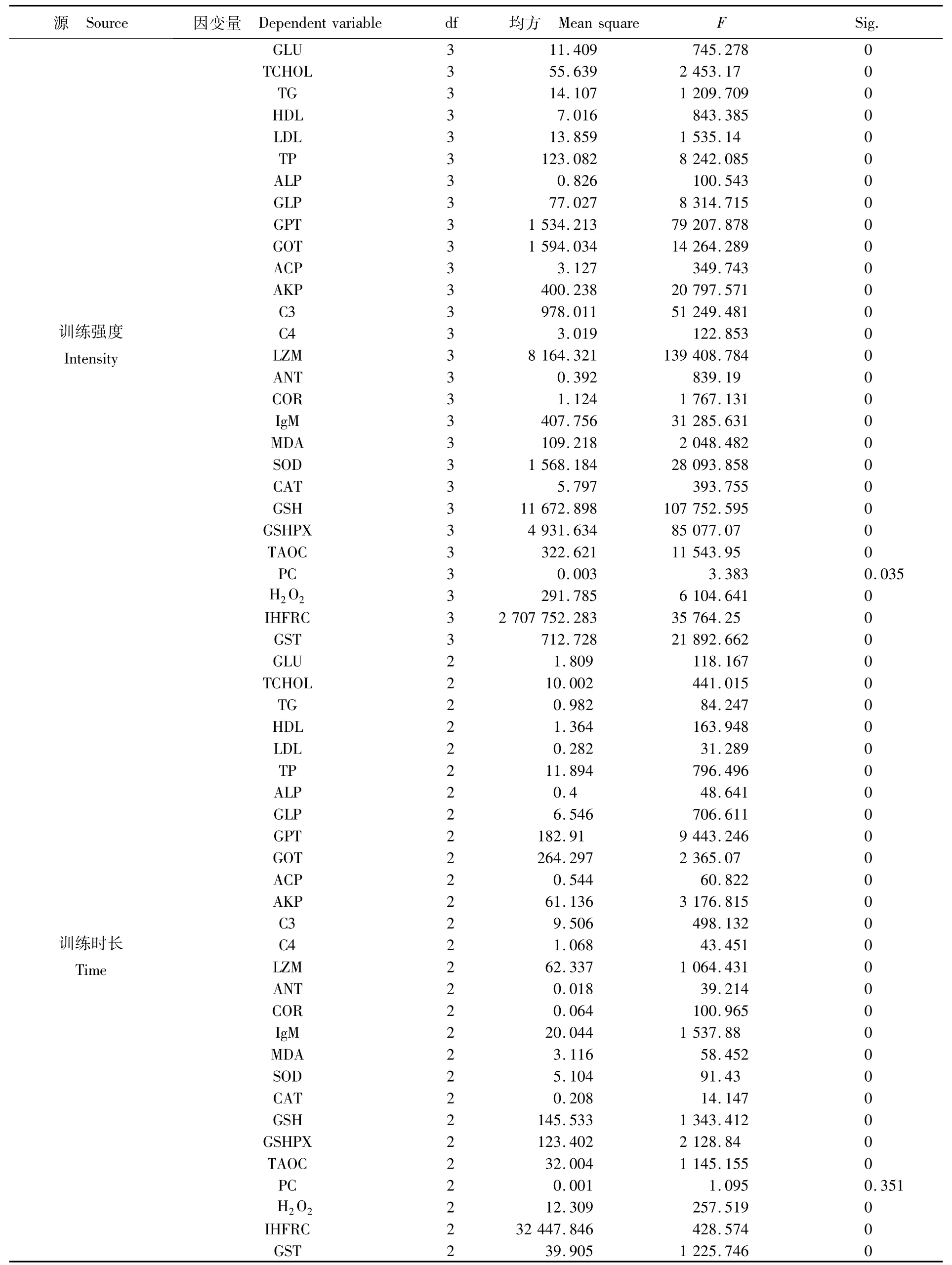
附表2 不同训练强度及训练时长下紫红笛鲷血清生化指标双因素方差分析结果Appendix 2 Two-way ANOVA analysis of serum indicators of juvenile Lutjanus argentimaculatus w ith different training intensities and time
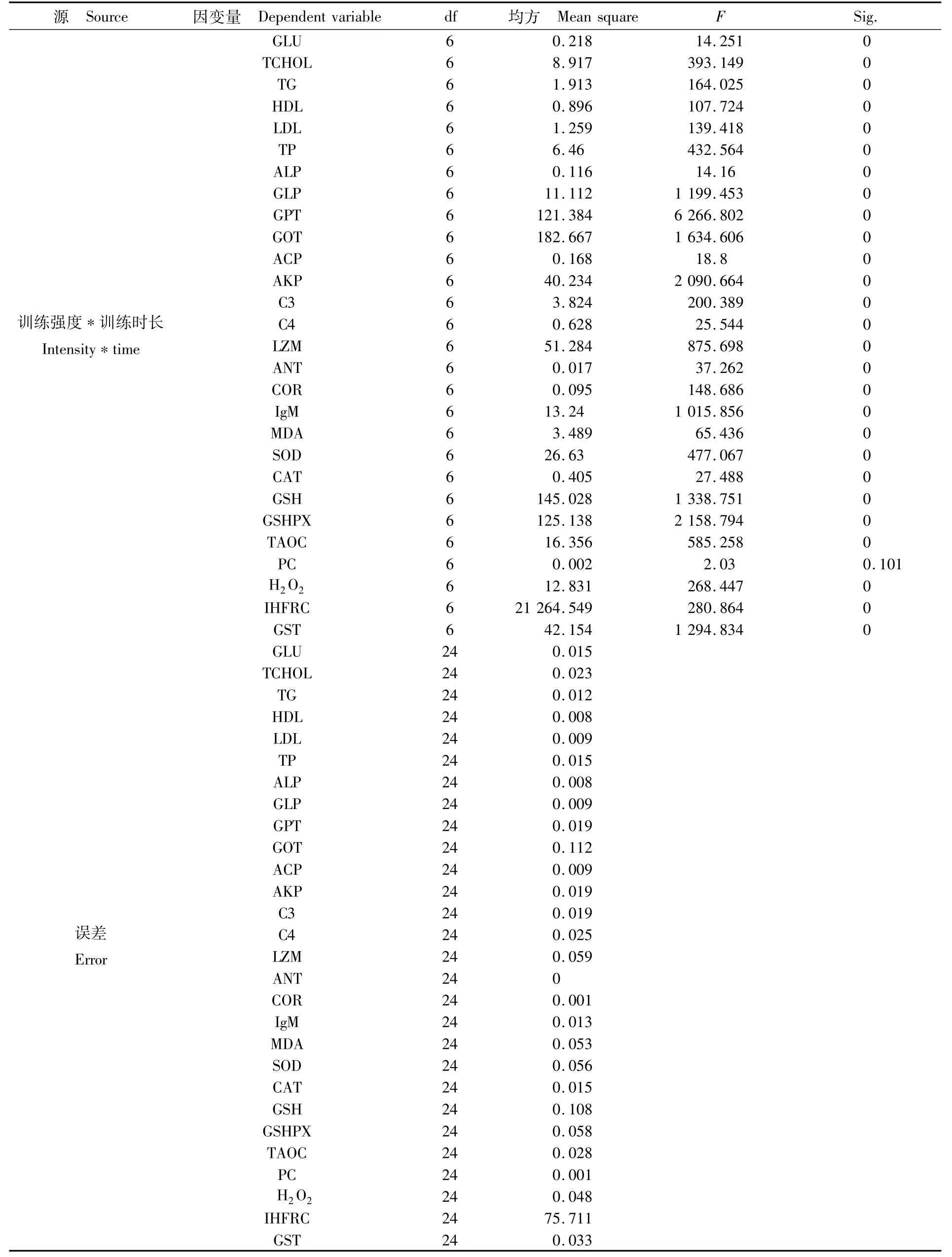
续附表2

