α-卤代腙与α-异氰酸酯反应合成4-腙基-2-异氰基丁酸酯类化合物
全保学, 赵建强, 袁伟成
(1. 中国科学院 成都有机化学研究所,四川 成都 610041; 2. 成都大学 高等研究院,四川 成都 6101062; 3. 中国科学院大学,北京 100049)
α-卤代腙是有机合成中的一种重要底物,常作为四元合成子参与杂环化反应:[4+1]环化反应构建含吡唑骨架的化合物[1-4];[4+2]环化构建含哒嗪骨架或者三氮嗪骨架的化合物[5-8];[4+3]环化构建含二氮或者三氮骨架的化合物[9-12]。
α-异氰酸酯常作为三元合成子参与环化反应[13-16]。鉴于此,希望在有机碱作用下,α-卤代腙能与α-异氰酸酯发生[4+3]环化反应,遗憾的是,在反应体系中并没有检测到[4+3]环化产物,而是意外发现了α-卤代腙与α-异氰酸酯反应得到的4-腙基-2-异氰基丁酸酯类化合物。由于产物结构中仍然保留着腙和异氰基等化学活性官能团,通过后续衍生,可以进一步转化为杂环化合物或者氨基酸衍生物,具有潜在应用价值。
Scheme 1
Scheme 2
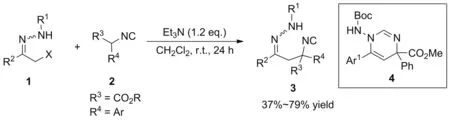
本文对α-卤代腙1与α-异氰酸酯2的反应进行了简要探讨。在三乙胺作用下,α-异氰酸酯的α-位进攻α-卤代腙的卤素原子,脱去一分子卤化氢,得到产物3。通过简单的条件筛选后,对反应的底物普适性进行了考察,获得了37%~79%的收率(Scheme 1)。此外,还对产物进行了衍生化和一锅法制备嘧啶衍生物4的尝试(Scheme 2)。所有产物和衍生产物均经1H NMR,13C NMR和MS(ESI)确证。并采用单晶衍射确证了化合物3h和4e的单晶结构。
1 实验部分
1.1 仪器与试剂
Büchi B-545型显微熔点仪(温度未校正);Bruker 300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Daltonics型质谱仪。
所用试剂均为分析纯。
1.2 合成
(1)3a~3i的合成通法
向干燥的反应试管中依次加入1(0.1 mmol, 1 eq.),二氯甲烷2 mL,2(0.12 mmol, 1.2 eq.)和三乙胺(0.12 mmol, 1.2 eq.),室温反应24 h。向反应体系中加入水5 mL,用二氯甲烷萃取,有机相用无水硫酸钠干燥后减压浓缩。残余物经硅胶柱层析[洗脱剂:石油醚/乙酸乙酯=20/1~10/1,V/V]纯化得化合物3。
2-异氰基-2,4-二苯基-4-(2-对甲苯磺酰腙基)丁酸甲酯(3a): 白色固体,收率58%, m.p.155.0~156.8 ℃;1H NMR(300 MHz, CDCl3)δ: 7.87(d,J=8.1 Hz, 2H), 7.67(s, 1H), 7.60~7.57(m, 2H), 7.48~7.41(m, 3H), 7.40~7.31(m, 5H), 7.18~7.14(m, 2H), 3.81(s, 3H), 3.76(d,J=16.8 Hz, 1H), 3.14(d,J=16.8 Hz, 1H), 2.45(s, 3H);1H NMR(300 MHz, CDCl3-D2O)δ: 7.86(d,J=8.1 Hz, 2H), 7.60~7.56(m, 2H), 7.45~7.43(m, 3H), 7.38~7.35(m, 5H), 7.18~7.14(m, 2H), 3.81(s, 3H), 3.76(d,J=16.8 Hz, 1H), 3.14(d,J=16.8 Hz, 1H), 2.44(s, 3H);13C NMR(75 MHz, CDCl3)δ: 167.3, 161.5, 149.6, 144.1, 135.3, 134.8, 131.4, 130.3, 129.8, 129.7, 129.1, 128.9, 127.9, 126.9, 125.1, 67.7, 54.0, 47.8, 21.6; HR-MS(ESI)m/z: Calcd for C25H24N3O4S{[M+H]+}462.1482, found 462.1469。
2-异氰基-2,4-二苯基-4-(2-(苯磺酰)腙基)丁酸甲酯(3b): 白色固体,收率37%, m.p.163.5~164.7 ℃;1H NMR(300 MHz, CDCl3)δ: 8.01~7.98(m, 2H), 7.69(s, 1H), 7.65~7.55(m, 5H), 7.49~7.32(m, 6H), 7.18~7.15(m, 2H), 3.90~3.69(m, 4H), 3.15(d,J=16.8 Hz, 1H);13C NMR(75 MHz, CDCl3)δ: 167.3, 161.9, 149.9, 138.3, 134.9, 133.2, 131.4, 130.4, 129.8, 129.2, 129.2, 129.0, 127.9, 126.9, 125.1, 67.8, 54.0, 47.8; HR-MS(ESI)m/z: Calcd for C24H22N3O4S{[M+H]+}448.1326, found 448.1333。
2-异氰基-4-(2-(甲磺酰)腙基)-2,4-二苯基丁酸甲酯(3c): 白色固体,收率39%, m.p.167.7~169.3 ℃;1H NMR(300 MHz, CDCl3)δ: 7.66~7.63(m, 2H), 7.56~7.40(m, 7H), 7.33~7.31(m, 2H), 3.91~3.83(m, 4H), 3.25~3.20(m, 4H);13C NMR(75 MHz, CDCl3)δ: 167.4, 160.9, 149.5, 134.5, 131.2, 130.6, 129.8, 129.3, 129.1, 126.9, 125.1, 68.3, 54.2, 47.6, 39.2;HR-MS(ESI)m/z: Calcd for C19H19N3O4SNa{[M+Na]+}408.0994, found 408.0988。
4-(2-乙酰腙基)-2-异氰基-2,4-二甲基丁酸甲酯(3d): 白色固体,收率76%, m.p.128.3~129.4 ℃;1H NMR(300 MHz, CDCl3)δ: 8.39(s, 1H), 7.63~7.60(m, 2H), 7.50~7.35(m, 6H), 7.24~7.21(m, 2H), 3.71(d,J=17.1 Hz, 1H), 3.73(s, 3H), 3.21(d,J=17.1 Hz, 1H), 2.30(s, 3H);13C NMR(75 MHz, CDCl3)δ: 172.8, 167.5, 161.4, 146.1, 134.7, 131.8, 130.1, 129.7, 129.2, 129.0, 126.9, 124.9, 67.8, 53.7, 47.4, 20.4; HR-MS(ESI)m/z: Calcd for C20H19N3NaO3{[M+Na]+}372.1324, found 372.1323。
4-(2-叔丁氧羰基腙基)-2-异氰基-2,4-二甲基丁酸甲酯(3e): 无色半固体,收率79%;1H NMR(300 MHz, CDCl3)δ: 7.71(s, 1H), 7.60~7.58(m, 2H), 7.50~7.31(m, 6H), 7.26~7.23(m, 2H), 3.87(d,J=15.5 Hz, 1H), 3.64(s, 3H), 3.29(d,J=15.5 Hz, 1H), 1.47(s, 9H);1H NMR(300 MHz, CDCl3+ D2O)δ: 7.60~7.57(m, 2H), 7.50~7.31(m, 6H), 7.26~7.24(m, 2H), 3.88(d,J=15.3 Hz, 1H), 3.64(s, 3H), 3.29(d,J=15.5 Hz, 1H), 1.47(s, 9H);13C NMR(75 MHz, CDCl3)δ: 167.6, 162.0, 151.9, 145.8, 135.1, 132.0, 129.8, 129.6, 129.0, 128.8, 127.3, 125.1, 81.2, 68.6, 53.8, 47.9, 28.2; HR-MS(ESI)m/z: Calcd for C23H26N3O4{[M+H]+}408.1918, found 408.1928。
2-异氰基-2-苯基-4-(2-对甲苯磺酰腙基)戊酸甲酯(3f): 白色固体,收率64%, m.p.112.6~113.5 ℃;1H NMR(300 MHz, CDCl3)δ: 7.91(d,J=8.3 Hz, 2H), 7.77(s, 1H), 7.60~7.57(m, 2H), 7.43~7.34(m, 5H), 3.85(s, 3H), 3.49(d,J=16.8 Hz, 1H), 2.88(d,J=16.9 Hz, 1H), 2.43(s, 3H), 1.79(s, 3H);13C NMR(75 MHz, CDCl3)δ: 167.3, 161.2, 149.8, 144.1, 135.3, 135.0, 129.8, 129.1, 129.0, 128.1, 125.1, 67.5, 54.0, 48.3, 21.6, 16.4; HR-MS(ESI)m/z: Calcd for C20H22N3O4S{[M+H]+}400.1226, found 400.1325。
2-异氰基-2,4-二苯基-4-(2-对甲苯磺酰腙基)丁酸乙酯(3g): 白色固体,收率37%, m.p.144.2~146.0 ℃;1H NMR(300 MHz, CDCl3)δ: 7.87(d,J=8.1 Hz, 2H), 7.66(s, 1H), 7.59~7.56(m, 2H), 7.46~7.42(m, 3H), 7.39~7.35(m, 5H), 7.16~7.13(m, 2H), 4.27~4.17(m, 2H), 3.75(d,J=16.8 Hz, 1H), 3.16(d,J=16.8 Hz, 1H), 2.45(s, 3H), 1.26(t,J=7.2 Hz, 3H);13C NMR(75 MHz, CDCl3)δ: 166.6, 161.4, 149.8, 144.1, 135.3, 135.0, 131.4, 130.3, 129.8, 129.7, 129.0, 128.9, 127.9, 126.9, 125.0, 67.8, 63.4, 47.7, 21.6, 13.7; HR-MS(ESI)m/z: Calcd for C26H26N3O4S{[M+H]+}476.1644, found 476.1625。
2-(4-氟苯基)-2-异氰基-4-苯基-4-(2-对甲本磺酰腙基)丁酸甲酯(3h): 白色固体,收率50%, m.p.163.3~165.1 ℃;1H NMR(300 MHz, CDCl3)δ: 7.85(d,J=8.1 Hz, 2H), 7.67(s, 1H), 7.58~7.54(m, 2H), 7.45~7.43(m, 3H), 7.36(d,J=8.1 Hz, 2H), 7.16~7.13(m, 2H), 7.05(t,J=8.7 Hz, 2H), 3.81(s, 3H), 3.72(d,J=16.8 Hz, 1H), 3.14(d, J=16.5 Hz, 1H), 2.45(s, 3H);13C NMR(75 MHz, CDCl3)δ: 167.2, 162.9(d,J=247.7 Hz, 1C), 162.0, 149.3, 144.1, 135.3, 131.3, 130.6(d,J=3.4 Hz, 1C), 130.4, 129.81, 129.75, 127.9, 127.2(d,J=8.5 Hz, 2C), 126.8, 115.9(d,J=22.2 Hz, 2C), 67.2, 54.1, 47.8, 21.6; HR-MS(ESI)m/z: Calcd for C25H23N3O4SF{[M+H]+}480.1393, found 480.1392。
2-(4-氯苯基)-2-异氰基-4-苯基-4-(2-对甲本磺酰腙基)丁酸甲酯(3i): 白色固体,收率53%, m.p.168.4~170.0 ℃;1H NMR(300 MHz, CDCl3)δ: 7.85(d,J=8.1 Hz, 2H), 7.67(s, 1H), 7.51(d,J=8.7 Hz, 2H), 7.46~7.44(m, 3H), 7.37~7.32(m, 4H), 7.16~7.13(m, 2H), 3.81(s, 3H), 3.71(d,J=16.8, 1H), 3.13(d,J=16.5, 1H), 2.45(s, 3H);13C NMR(75 MHz, CDCl3)δ: 167.0, 162.1, 149.2, 144.1, 135.35, 135.27, 133.3, 131.2, 130.4, 129.81, 129.75, 129.0, 127.8, 126.8, 126.6, 67.3, 54.2, 47.7, 21.6; HR-MS(ESI)m/z: Calcd for C25H23N3O4SCl{[M+H]+}496.1098, found 496.1102。
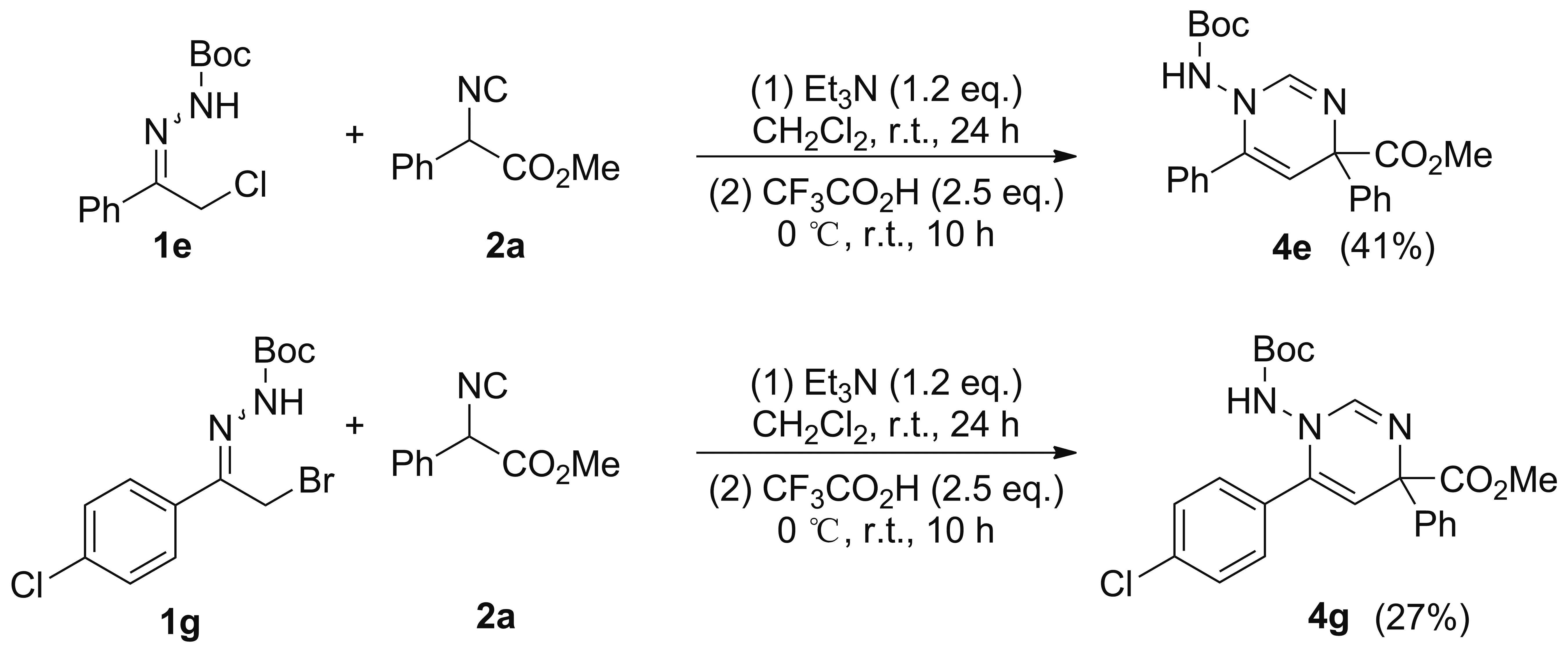
(2) 1-((叔丁氧羰基)氨基)-4,6-二苯基-1,4-二氢嘧啶-4-羧酸甲酯(4e)的合成
将化合物3e40.7 mg(0.1 mmol, 1.0 eq.)溶于二氯甲烷(2 mL)中,冰水浴冷却,加入CF3CO2H(0.1 M, 1.2 eq.)的二氯甲烷(1.2 mL)溶液,反应10 h。倒入碳酸氢钠溶液中,用二氯甲烷(3×5 mL)萃取,合并有机相,用无水硫酸钠干燥,浓缩,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=20/1~1/1,V/V)纯化得白色固体4e24.5 mg,收率60%, m.p.207.9~208.9 ℃;1H NMR(300 MHz, CDCl3)δ: 7.54~7.52(m, 1H), 7.39~7.27(m, 9H), 6.57(s, 1H), 5.40(s, 1H), 3.75(s, 3H), 1.24(s, 9H);1H NMR(300 MHz, CDCl3+D2O) δ 7.54~7.52(m, 1H), 7.39~7.27(m, 9H), 5.40(s, 1H), 3.75(s, 3H), 1.23(s, 9H);13C NMR(75 MHz, CDCl3)δ: 173.2, 154.3, 148.0, 144.2, 140.2, 133.0, 128.9, 128.6, 128.3, 127.5, 125.9, 103.3, 66.1, 52.8, 27.8; HR-MS(ESI)m/z: Calcd for C23H26N3O4{[M+H]+}408.1916, found 408.1920。
(3) 1-((叔丁氧羰基)氨基)-6-(4-氯苯基)-4-苯基-1,4-二氢嘧啶-4-羧酸甲酯(4g)的合成
将α-卤代腙1e53.6 mg(0.2 mmol,1.0 eq.),2a42.0 mg(0.24 mmol, 1.2 eq.)和Et3N 24.2 mg(0.24 mmol, 1.2 eq.)溶于二氯甲烷(4 mL)中,室温反应24 h。加入CF3CO2H(0.1 M, 2.5 eq.)的二氯甲烷(5 mL)溶液,室温反应10 h。倒入碳酸氢钠溶液中,用二氯甲烷(3×10 mL)萃取,合并有机相,用无水硫酸钠干燥,浓缩,经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=20/1~1/1,V/V)纯化得白色固体4e33.5 mg,收率41%。
将α-卤代腙1g69.2 mg(0.2 mmol, 1.0 eq.),2a42.0 mg(0.24 mmol, 1.2 eq.)和Et3N 24.2 mg(0.24 mmol,1.2 eq.)溶于二氯甲烷(4 mL)中,室温下反应24 h。加入CF3CO2H(0.1 M, 2.5 eq.)的二氯甲烷(5 mL)溶液,室温反应10 h。倒入碳酸氢钠溶液中,用二氯甲烷(3×10 mL)萃取,合并有机相,用无水硫酸钠干燥,浓缩,经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=20/1~1/1,V/V)纯化得白色固体4g24.0 mg,收率27%, m.p.214.0~215.1℃;1H NMR(300 MHz, CDCl3)δ: 7.50~7.47(m, 2H), 7.37~7.18(m, 9H), 5.36(s, 1H), 3.71(s, 3H), 1.26(s, 9H);13C NMR(75 MHz, CDCl3)δ: 173.0, 154.3, 148.2, 144.0, 139.2, 134.9, 131.5, 130.0, 128.6, 128.4, 127.6, 125.8, 103.5, 82.0, 66.0, 52.8, 27.9; HR-MS(ESI)m/z: Calcd for C23H25N3O4Cl{[M+H]+}442.1528, found 442.1537。
2 结果与讨论
2.1 反应条件优化
以1a和2a的反应为模型反应,对碱的种类进行了简单考察,结果见表1。由表1可见,使用有机碱,如三乙胺或DBU时,能以中等收率(分别为58%, 54%)获得产物3a。使用碱性更强的有机碱DMAP时,α-卤代腙与DMAP形成季铵盐,不能得到产物。当使用常规无机碱,如Na2CO3时,不能得到目标产物。
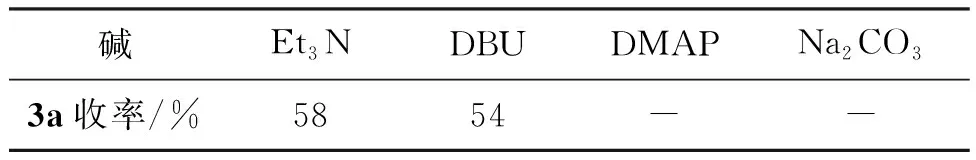
表1 反应条件优化
以1a和2a的反应为模型反应,对碱的种类进行了简单考察。当使用有机碱,如三乙胺或DBU时,能以中等收率(分别为58%, 54%)获得4-腙基-2-异氰基丁酸酯类化合物3a。使用碱性更强的有机碱DMAP时,α-卤代腙与DMAP形成季铵盐,无法生成3a。当使用常规无机碱(如碳酸钠)时,亦不能得到目标产物3a。
2.2 底物拓展
在优化的反应条件下,对底物普适性进行了考察,结果见表2。首先考察了α-卤代腙上的R1取代基对反应的影响,当R1为吸电子能力较强的磺酰基[如对甲苯磺酰基(Ts),苯磺酰基(Bs)和甲磺酰基(Ms)]时,能以37%~58%的收率得到对应产物3a~3c(Entry 1~3);当R1为吸电子能力相对较弱的取代基,如乙酰基(Ac)或者叔丁氧羰基(Boc)时,目标产物3d,3e的收率分别提高至76%和79%(Entry 4, 5)。随后考察了当R2为烷基(如甲基)时,对反应的影响,同样也能以良好的收率得到产物(Entry 6)。接着,考察了异氰上的R3和R4取代基对反应的影响,当R3为乙氧羰基时,收率略有下降,但仍然能顺利得到产物3g(Entry 7);当R4为4-FPh或者4-ClPh时,亦可以中等收率得到目标。
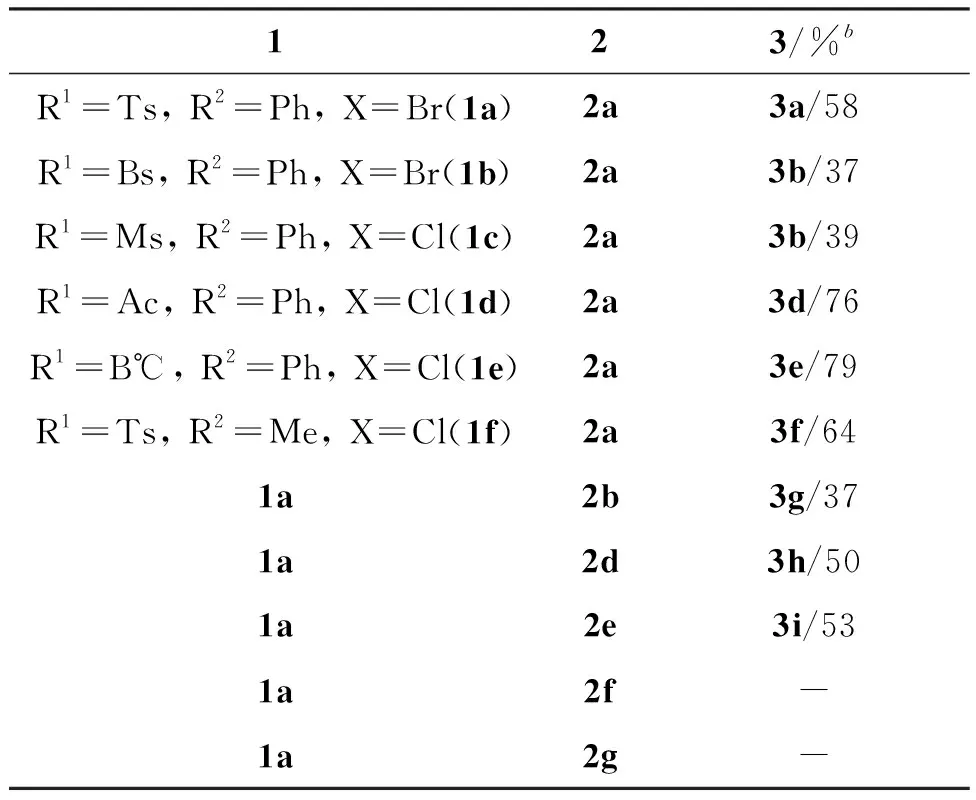
表2 α-卤代腙和异氰的底物扩展a
2.3 衍生化反应
α-卤代腙和α-异氰反应得到的4-腙-2-异氰基丁酸酯类产物,是一类非常有用的中间体。其中,化合物3e可以在CF3CO2H作用下,发生分子内环化得到嘧啶衍生物4e,收率为60%。
2.4 一锅法制备嘧啶衍生物
此外,化合物4e还可以通过一锅法直接制得,收率41%。为了验证一锅两步法的可靠性,以1g为原料,经过一锅法制得了化合物4g,收率27%。
2.5 单晶结构
为了确认产物和衍生物的结构,培养了化合物3h和4e的单晶。通过对化合物3h和4e的单晶结构进行解析,确认了产物的链状结构和衍生物的嘧啶环结构(图1)。
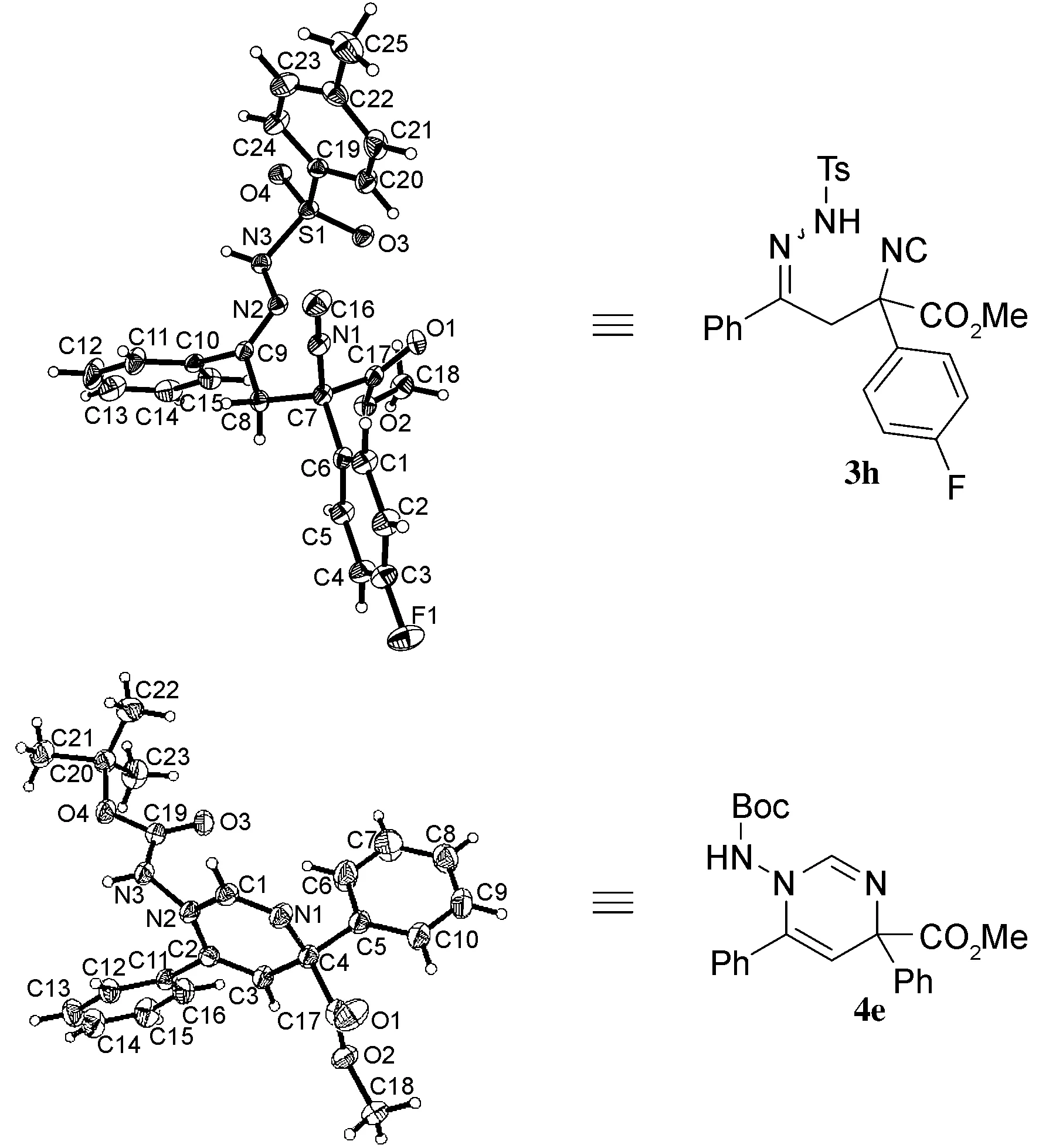
图1 3h和4e的单晶结构
在有机碱三乙胺作用下,α-卤代腙和α-异氰反应构建了一系列4-腙-2-异氰基丁酸酯类化合物,收率37%~79%。产物经三氟乙酸处理可发生分子内环化反应得到嘧啶衍生物,此外,还可以通过一锅法直接合成嘧啶衍生物,为嘧啶类化合物的合成提供了一种新方法。

