新型离子型配合物的合成、晶体结构及性质
陈 钦, 郭依洁, 张 冲, 张淑华
(桂林理工大学 化学与生物工程学院 广西磁电化学功能物质重点实验室,广西 桂林 541004)
配位化学在催化[1-3]、生物药用[4-7]、吸附与分离[8-10]、光学[11-15]和磁学[16]等领域有广泛应用,设计并合成结构和功能多样的新型化合物已成为热门课题。近年来,随着科学家对分子间弱相互作用(如π…π作用[17]、氢键[18-19]、分子识别[20-21]等)研究的深入,配位化学研究逐渐向超分子化学领域发展。
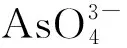
本文以4-(N,N′-双(4-羧基苄基)氨基)苯磺酸和邻菲罗啉为原料,分别与醋酸锰和醋酸锌反应,通过水热法合成了两例新型的离子型配合物{[Mn(phen)2(H2O)2]·(HL)·(H2O)4}(1)和{[Zn(phen)2(H2O)2]·(HL)·(H2O)6}(2),其结构和荧光性质经FL、 IR、元素分析、X-射线单晶衍射、X-射线粉末衍射和TG表征。
1 实验部分
1.1 仪器与试剂
Hitachi F-4600型荧光光谱仪;Nicolet Nexus 470FT-IR型红外光谱仪(KBr压片);Perkin-Elmer 240Q型元素分析仪;Agilent G8910A CCD型X-射线衍射仪;PANalytical X′Pert3Powder型多功能X-射线衍射仪;SDT Q600 V20.9型热重分析仪。
所用试剂均为分析纯。
1.2 1和2的合成(以1为例)
将H3L 0.220 g(0.5 mmol)和phen 0.180 g(1 mmol)溶于20 mL二次蒸馏水中,滴加10滴乙酸,搅拌使其混合均匀;加入Mn(CH3COO)2·4H2O 0.122 g(0.5 mmol),转移至25 mL内衬聚四氟乙烯的高压反应釜中,于180 ℃反应2 d。冷却至室温,反应釜底部为透明块状晶体1,产率50%(基于H3L), Anal. calcd for1: C 57.38, H 4.71, N 7.27, found C 57.31, H 4.77, N 7.25。
用Zn(CH3COO)2·2H2O替代Mn(CH3COO)2·4H2O,用类似的方法合成2,产率48%(基于H3L), Anal. calcd for2: C 54.74, H 4.99, N 6.94, found C 54.66, H 5.05, N 6.98。
1.3 晶体结构测定
将样品单晶1(0.23×0.20×0.17 mm)和2(0.22×0.18×0.15 mm)置于衍射仪上,用石墨单色化的MoKα射线(λ=0.71073 Å),于293 K以ω-θ方式扫描并收集3.30°≤θ≤25.00°(1)和3.35°≤θ≤25.10°(2)的数据点。使用SADABS程序[23]进行Lp因子校正和吸收校正,先用帕特森法确定金属离子的位置,然后用理论加氢法得到氢原子位置,用最小二乘法对结构进行修正.计算工作在PC机上用SHELXL-97[23]程序完成。所有非氢原子进行各向异性操作,计算和图片用SHELXTL和Olex2[24]完成。化合物1和2的晶体学参数见表1,化合物1和2的部分键长、键角见表2,化合物1氢键的键长和键角见表3,化合物2氢键的键长和键角见表4。

表1 1和2的晶体学参数
2 结果与讨论
2.1 晶体结构
1和2的结构类似,均为单斜晶系,P21/c空间群的共晶化合物(图1)。以2为例,讨论了配合物的结构。如图1所示,离子型化合物2由一个配阳离子[Zn(phen)2(H2O)2]2+和一个抗衡阴离子HL2-,以及6个溶剂水分子构成。其中Zn2+分别和两个邻菲罗啉的4个氮原子,以及两个水分子配位,形成变形八面体构型。Zn1—N5, Zn1—O9, Zn1—O8, Zn1—N2, Zn1—N3, Zn1—N4键长分别为2.164(5), 2.128(4), 2.125(4), 2.125(4), 2.208(5), 2.150(6) Å。配位键长与文献[25]报道的Zn配合物接近。
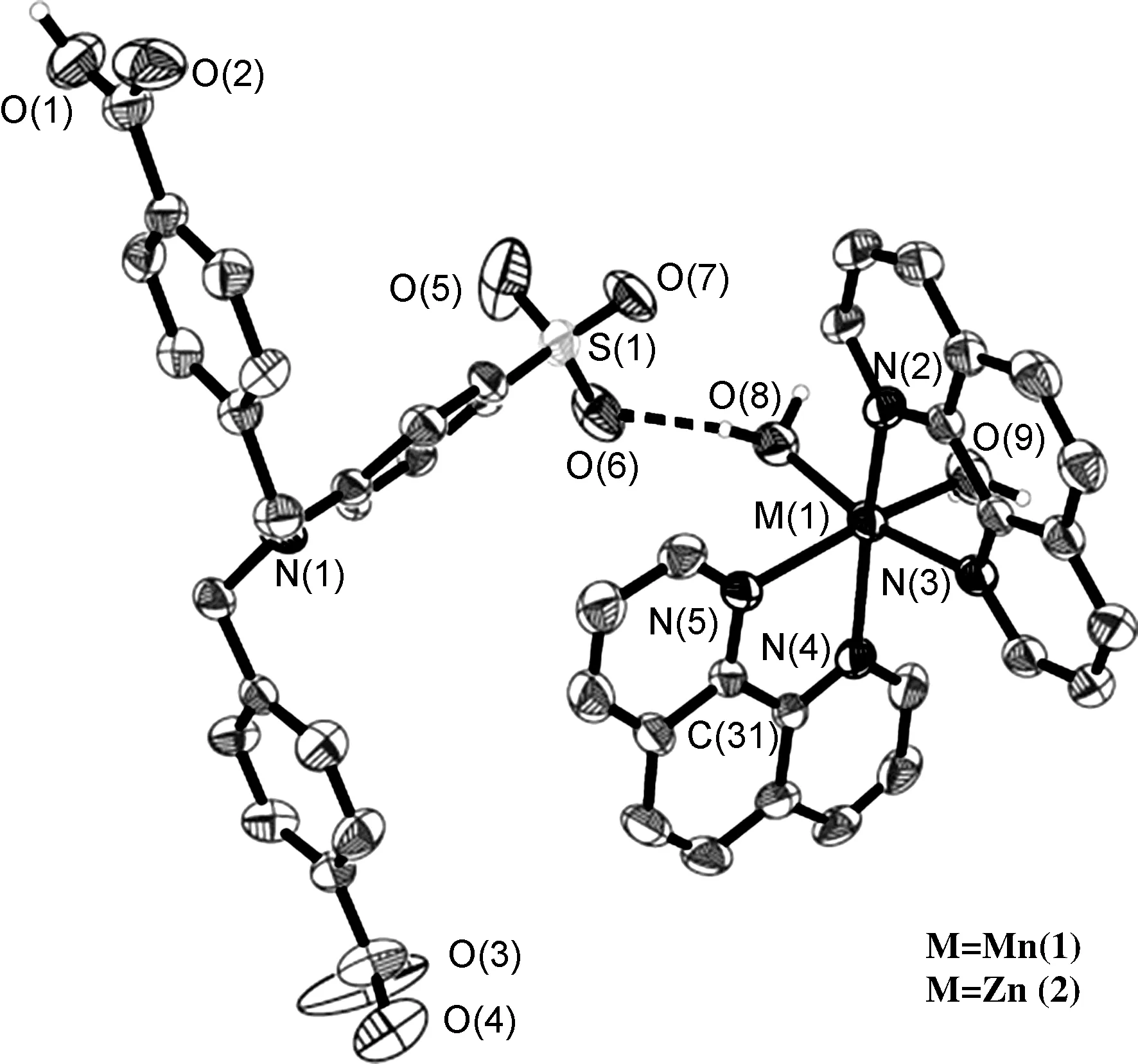
图1配合物1和2的分子结构
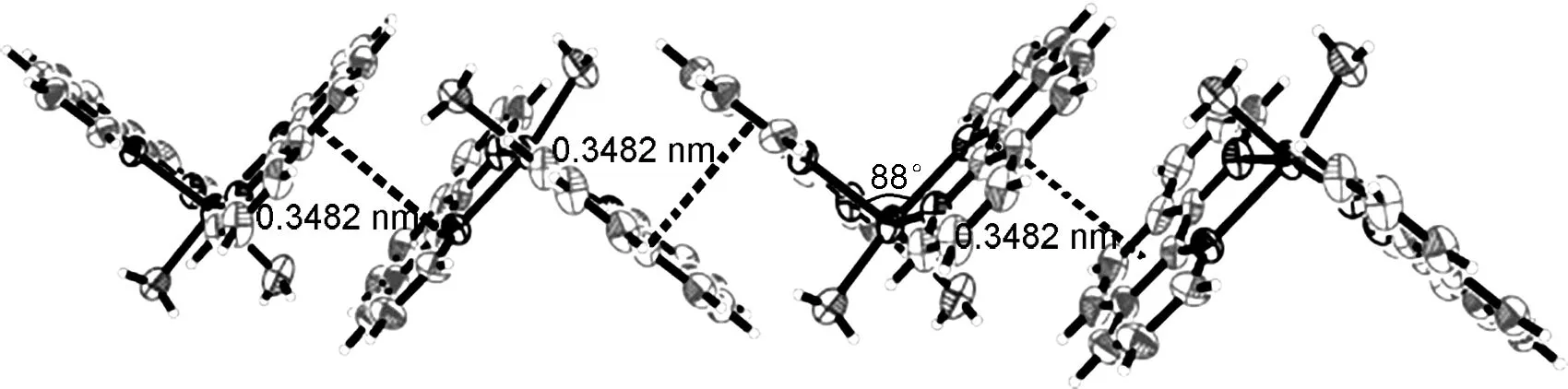
图2[Zn(phen)2(H2O)2]2+形成的1D链
配位阳离子和抗衡阴离子之间除了静电引力外,还存在强O—H…O氢键(O8—H8B…O6, 2.771(7) Å)。同时,[Zn(phen)2(H2O)2]2+阳离子的两个邻菲罗啉之间的二面角为88°(几乎相互垂直)。两个邻菲罗啉配体分别和临近配阳离子的邻菲罗啉通过π…π堆积作用形成一维链[π…πi, 3.482 Å,对称操作:(i)x, 1.5-y, -0.5+z,设邻菲罗啉(N3, N4, C26—C31)的中心为X, 另一个邻菲罗啉(N2, N3, C38—C43)的中心为X1, 则X…X1i的距离为3.71 Å][17]。在链内,Zn…Zn距离为9.191 Å(图2)。
有趣的是,离子型配合物的溶剂水分子通过丰富的氢键形成六元水簇(图3,表4)。水簇通过给体氢键[O12—H12A…O1ii, 2.721(11) Å, 对称操作:(ii) 1+x, 1.5-y, 0.5+z)和受体氢键(O2—H2…O15, 2.675(11) Å, O9—H9A…O11iii, 2.731(7) Å,对称操作:(iii) 2-x, 1.5+y, 1.5-z]分别连接抗衡阴离子和配阳离子,使得水簇能够稳定在共晶化合物中。最后2通过各种弱作用构成三维结构(图4)。
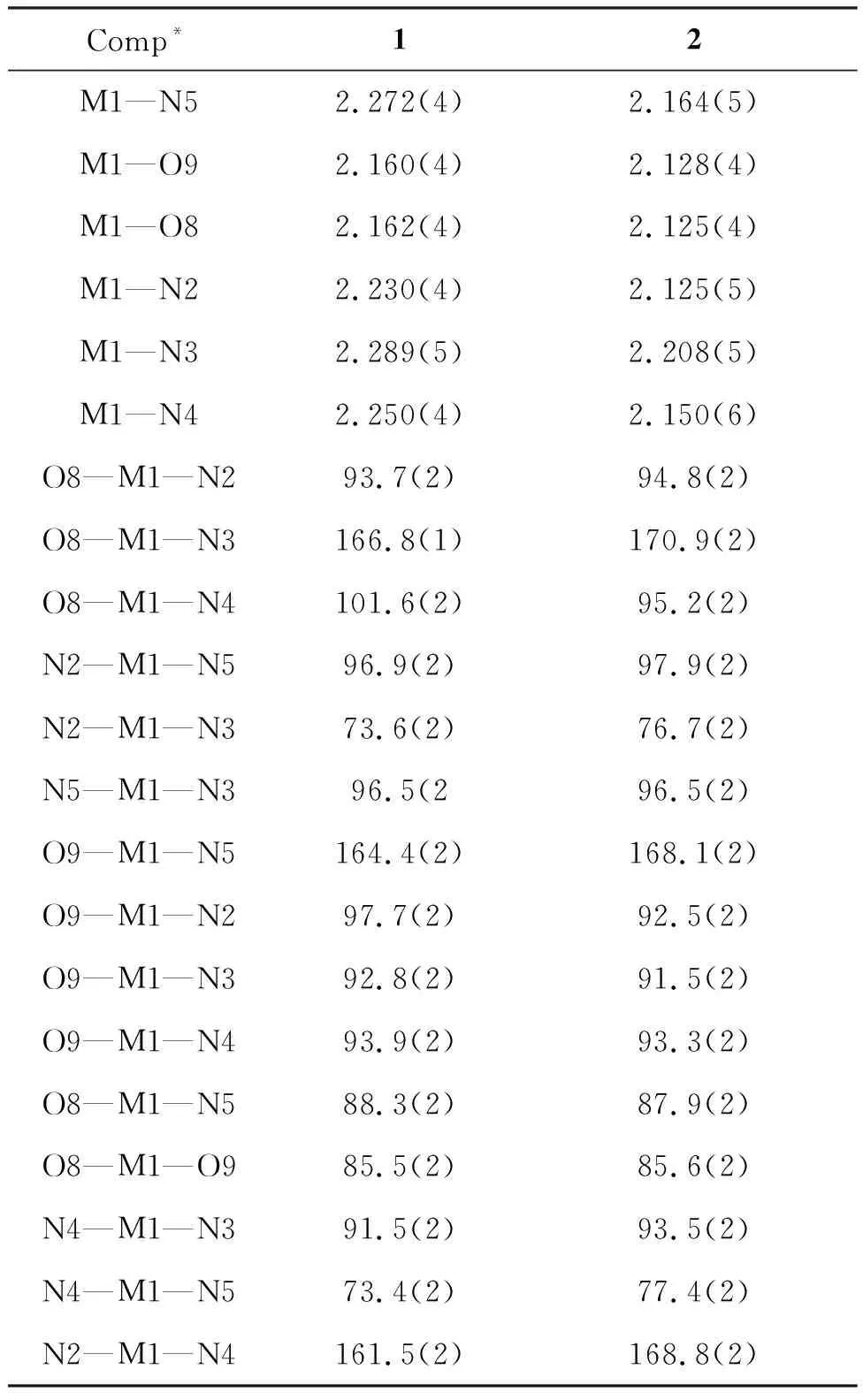
表 2 1和2的部分键长(Å)和键角(°)*
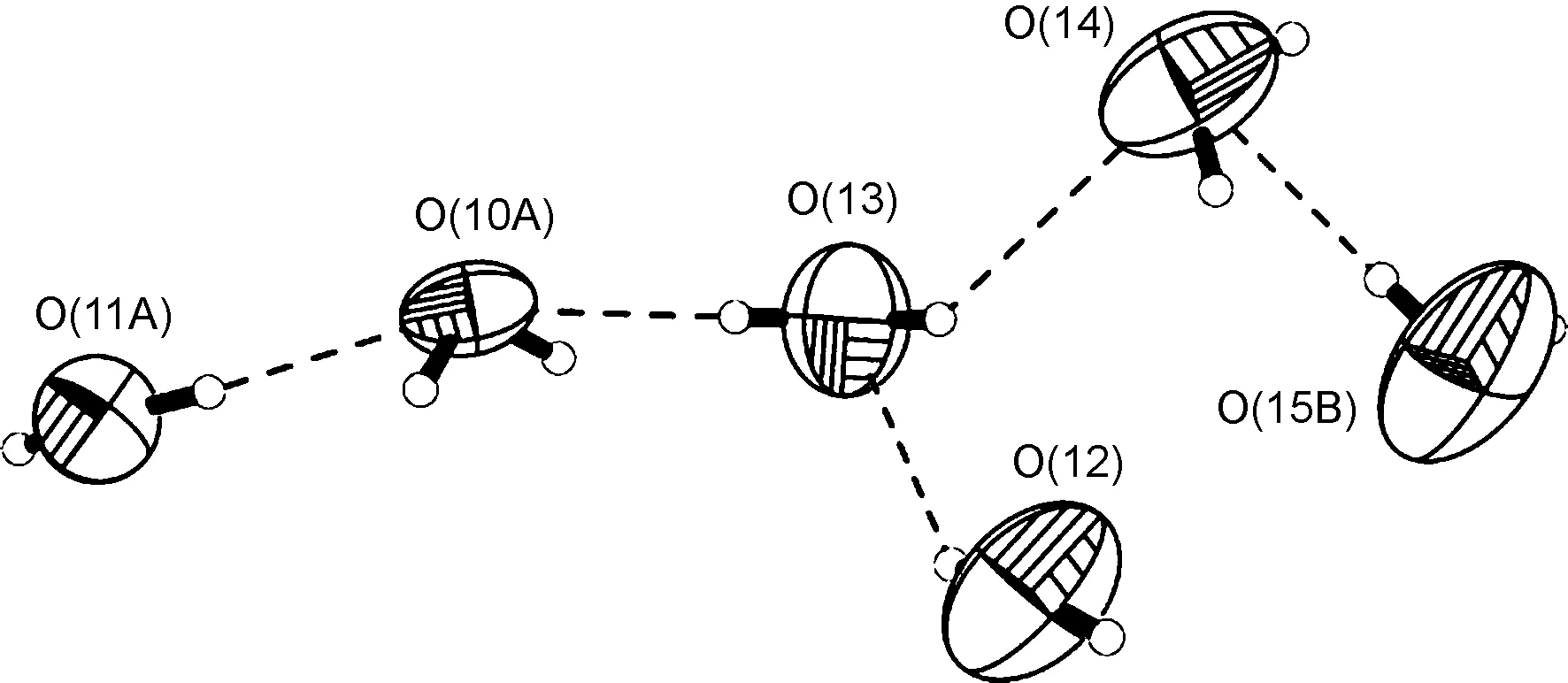
图3 2中形成的水簇
图4配合物2的三维堆积图
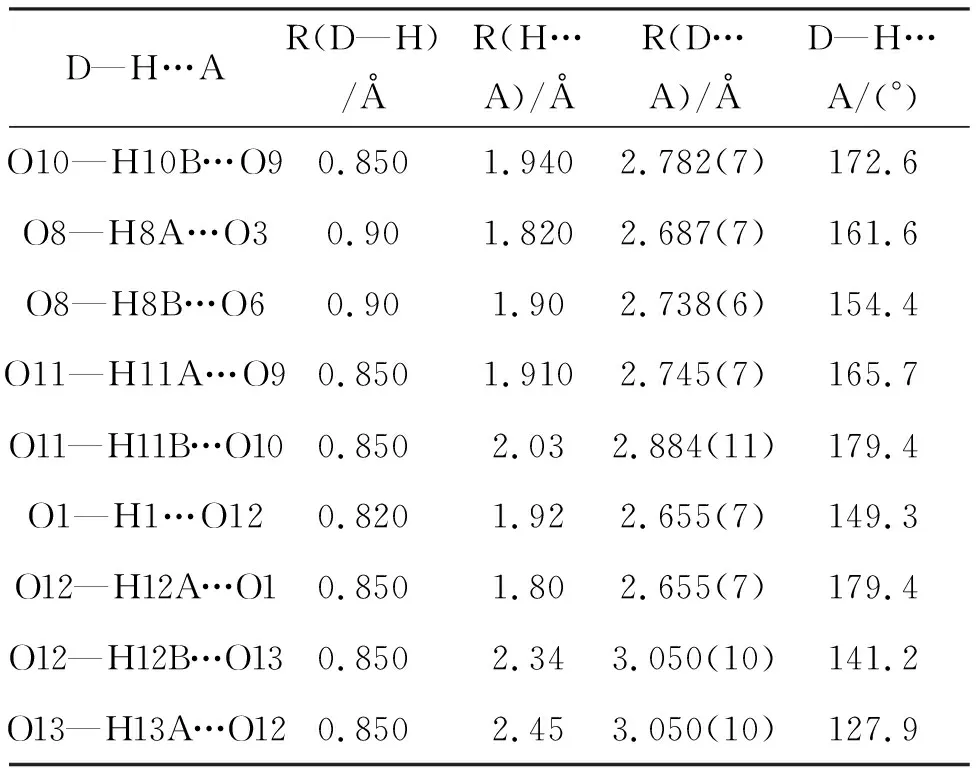
表3 1中氢键的键长(Å)和键角(°)
对比1和2,发现配阳离子和抗衡阴离子结构完全一样,但是1只有4个溶剂水分子而2有6个溶剂水分子。此外,在1和2中,锰的配位键长(平均键长为2.227 Å)比锌的平均键长(平均键长为2.150 Å)更长。由此,锰配阳离子更加伸展,占用空间更大,和抗衡阴离子堆积过程中预留的空间就更少,故溶剂水分子减少。
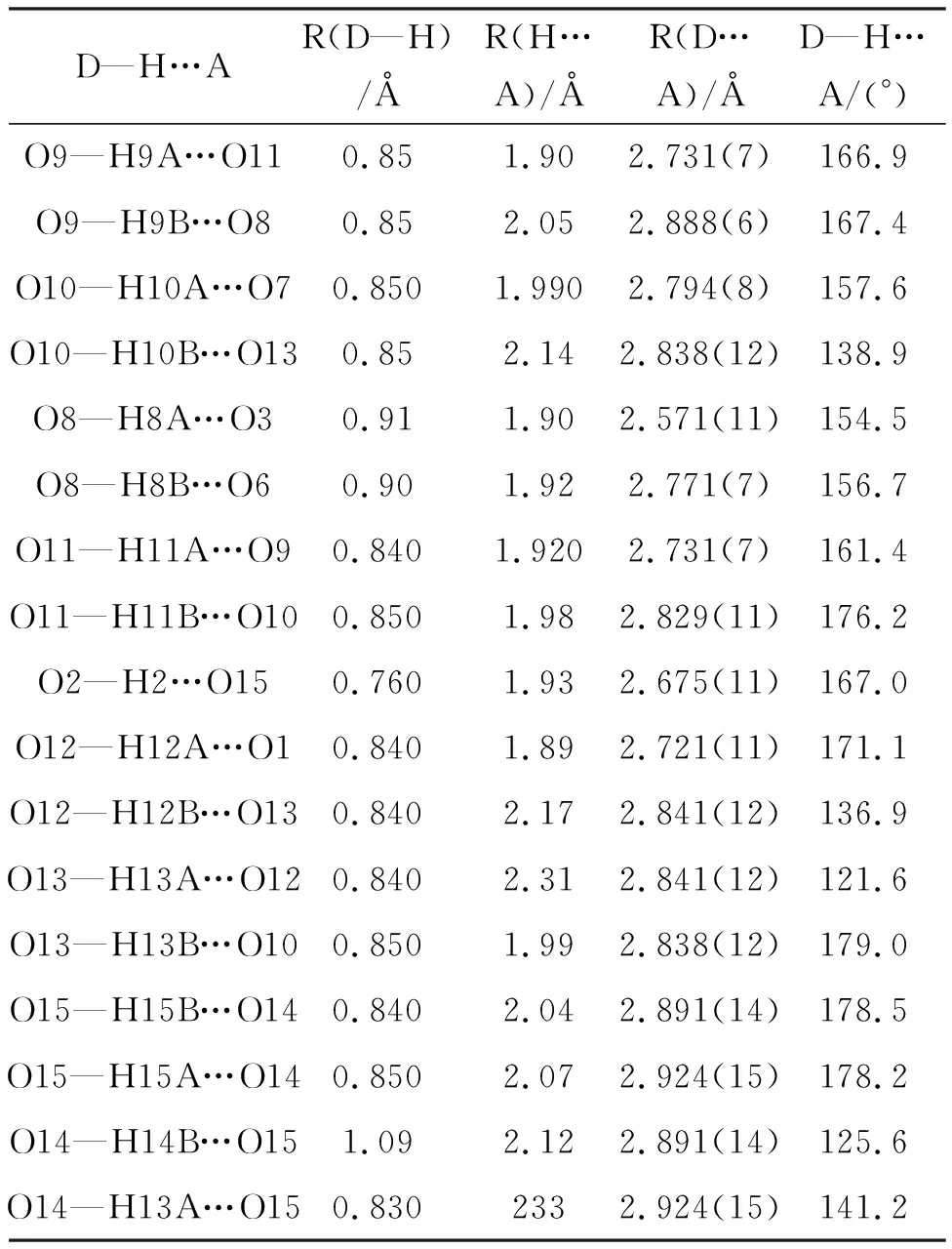
表4 2中氢键的键长(Å)和键角(°)
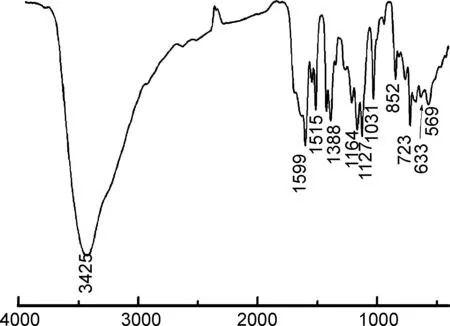
ν/cm-1
2.2 表征
(1) IR
图5为2的IR谱图。由图5可知,3425 cm-1处吸收峰为溶剂水分子和配位水分子的羟基峰[26];1388 cm-1处特征峰为芳环C=C伸缩振动峰;1031 cm-1处伸缩振动峰为芳香磺酸的O=S=O伸缩振动峰;1515 cm-1处特征峰为羧基吸收峰[27-28];852 cm-1处特征峰为苯环C—H的面外弯曲峰; Zn—O伸缩振动峰位于633 cm-1, Zn—N伸缩振动峰位于569 cm-1。
(2) XRD
图6为2的XRD谱图。由图可知,2的测试值与软件模拟的衍射峰基本吻合,说明2为纯相。
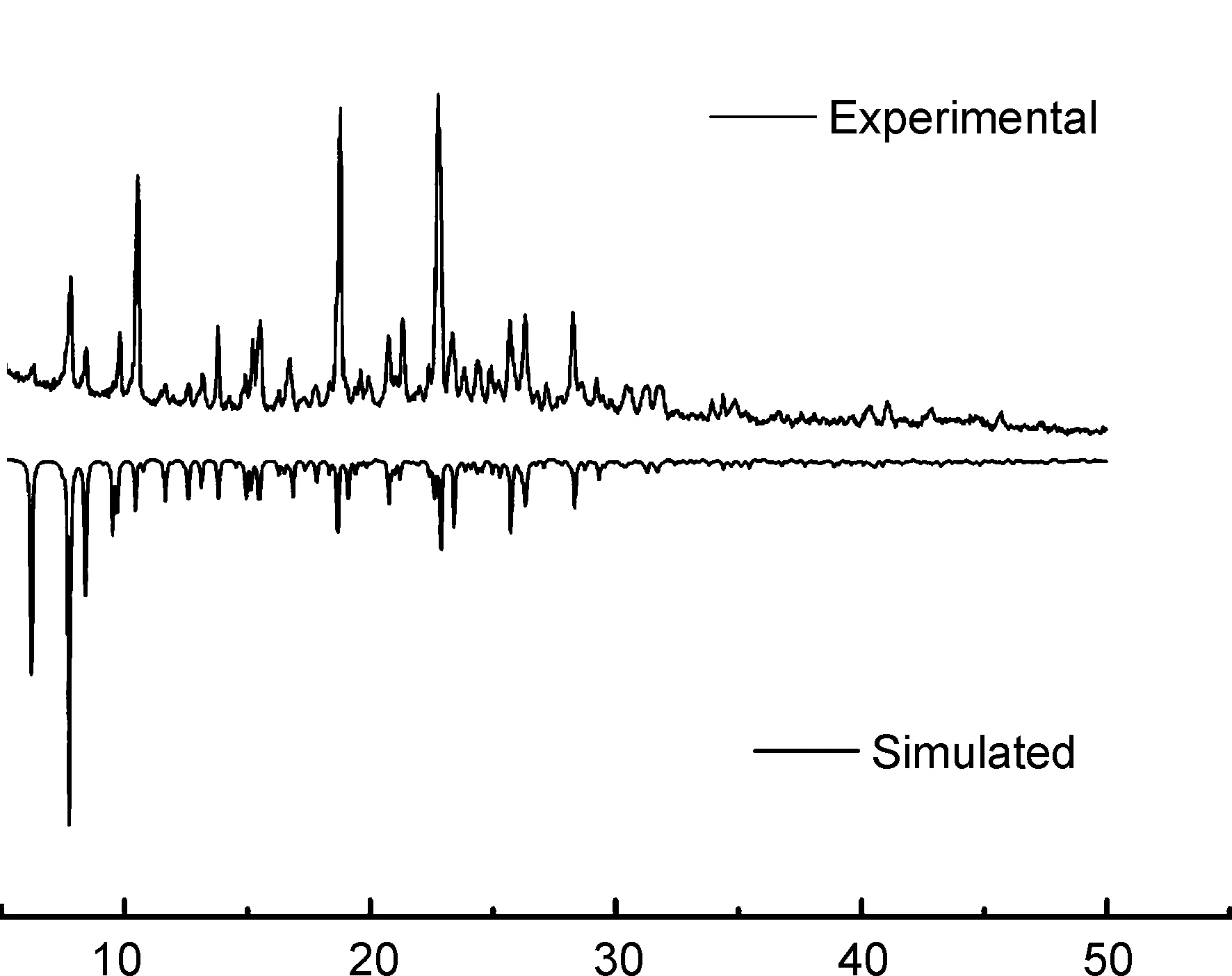
2θ/(°)
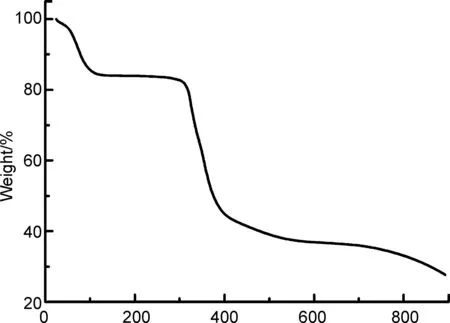
Temperature/℃
(3) TG
图7为2的TG曲线。由图7可知,配合物的热分解反应主要由两个过程组成。配合物分解的第一阶段为60~114 ℃,由失重量计算(15.9%),配合物2失去6个结晶水和两个配位水分子(理论失重率为14.27%);在114~305 ℃出现一个平台,分子碎片[Zn(phen)2]·(HL)相对稳定;从305 ℃开始,分子碎片[Zn(phen)2]·(HL)开始分解,最后形成复杂的混合物。
(4) FL
图8为配体H3L和配合物2的固体荧光曲线。从图8可以看出,激发光波长为253 nm时,配体H3L的最大蓝色荧光发射波长位于462 nm处,配体Phen的最大紫色荧光发射波长位于380 nm处,配合物2在585 nm和499 nm处有两个最大发射峰。其中配体的荧光发射峰归属为π-π*跃迁。与配体H3L和Phen的荧光相比较,2的荧光强度远大于配体H3L和Phen,可能是发生了配体到金属离子(LMCT)的电子转移[12,16]。
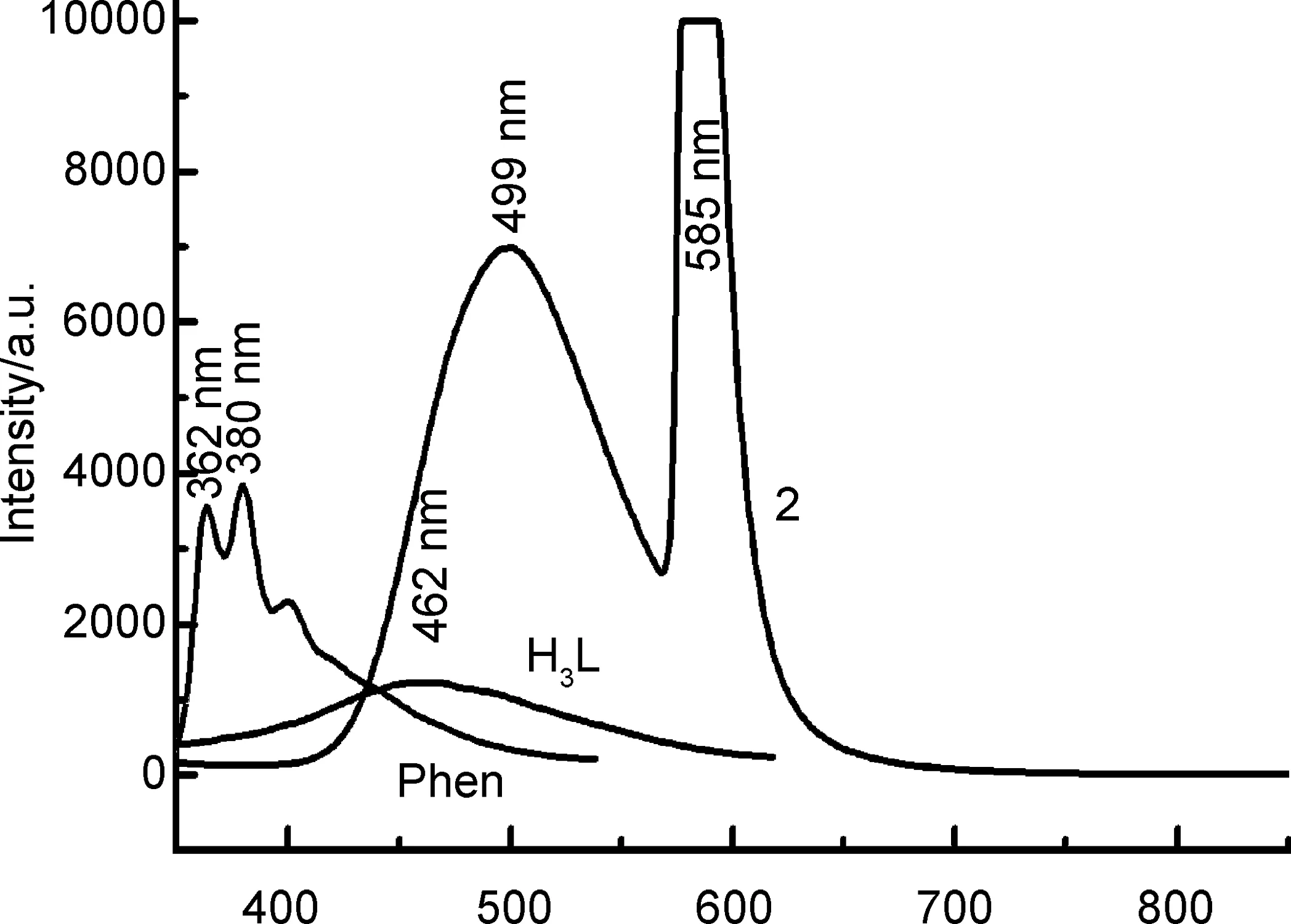
λ/nm
采用水热法合成了两个新型配合物[Mn(phen)2(H2O)2]·(HL)·(H2O)4(1)和[Zn(phen)2(H2O)2]·(HL)·(H2O)6(2),并研究了2的荧光和热性能。结果表明,2的热稳定性较好,在585 nm和499 nm处有最大发射峰。
——以高中化学“氢键”的教学为例

