1例基因KIF1A错义突变致常染色体显性智力障碍9型病例报道
沈茹 蒋鸿超 吴建敏 杨晓红 张林 段丽芬 李海波
常染色体显性智力障碍9 型(Autosomal dominant mental disorder type 9,MRD9)是一种常染色体显性遗传病,目前报道的文献非常少,它是由于染色体2q37 肌动蛋白家族1A(Kinesin family member 1A,KIF1A)基因突变引起的智力障碍(OMIM:614255)[1]。KIF1A基因突变可以导致常染色体显性遗传痉挛性截瘫[2-3],遗传性感觉和自主神经病变2 型(HSAN2)(OMIM:614213),可导致自闭症和多动症并伴有感觉障碍和痉挛性截瘫[4],也可导致非综合征和综合征性智力障碍(MRD9)[5]。MRD9 的智力障碍和步态不稳是进行性的,发生在婴儿期早期,严重程度不一[6]。如果能够早期确诊后对患儿的生长发育进行干预和对症处理,对脚部畸形的矫正和后期患儿的康复起到至关重要的作用。目前虽然已经有报道KIF1A基因突变能够导致MRD9。也有研究证实KIF1A基因突变导致常染色体显性遗传,如KIF1A运动域的新发突变(p.S69L)主要由痉挛性截瘫形式的父亲遗传给儿子[7],另一个文献同样报道KIF1A杂合变异体在一个HSP 显性分离模式的家族中被发现[8],这些病例的主要表型也有发育迟缓和/或伴有小脑、大脑和/或视神经萎缩。目前KIF1A基因突变导致MRD9 的发病机制尚不明确,鉴别诊断非常困难,本次研究采用全外显子测序发现了KIF1A基因新的致病位点,扩展了MRD9 基因型与临床表型谱。
1 材料与方法
1.1 患者资料
患儿2019年6月到本院门诊就诊,患儿主诉是自幼行走不稳,步态异常易跌倒,语言表达差,外斜视;门诊拟诊双下肢行走不稳待查,精神运动语言发育迟滞收入本院病房。
入院后对患儿进行全面检查。患儿,女孩,G3P2,2014年10月在云南省墨江县医院出生。其母亲产前检查一切正常,在孕41 周顺产。患儿出生体重3.2 kg,出生时无窒息,Apgar 评分10 分,喂养正常。生长发育史:8 个月开始爬;20月会站立;24 个月开始走,走路不稳,经常摔倒,早上较重;12 个月始出牙;12 个月始说话,但是至今已4 岁7个月只会说爸爸、妈妈简单两三个字的词语。父母无亲缘关系;家族遗传史:患儿爷爷、两个伯父和父亲均为耳聋;患儿姐姐2010年出生,目光呆滞,反应迟钝,智力语言明显落后。目前患儿身高90 cm,体重14 kg,大小便可自理;咽反射基本正常;听力正常。眼科检查:看人时双眼角膜向上,外斜视,无视神经萎缩迹象。神经系统检查:步态异常,行走不稳,共济运动检查:指鼻试验(-),跟膝胫试验(-),Romberg 试验(+)。双侧足内翻,没有足下垂;四肢肌力正常,下肢肌张力正常,腹壁反射(+),膝反射(+),双侧自发巴氏征(+),颈无抵抗,布氏征(-),克氏征(-)。见图1。
1.2 诊疗经过
1.2.1 临床检查
患儿入院后除了进行肝肾功、心肌酶和电解质等常规检查外,还进行血糖、血氨、骨化二醇、铜蓝蛋白、微量元素,铁蛋白,血脂、肾功能、甲状腺功能等代谢相关检查;同时进行了颅脑及肢体的影象学检查;以及心脏超声和心电图检查。采集患儿的足跟血干血斑进行新生儿遗传代谢病串联质谱,及尿液的气相质谱检测。
1.2.2 全外显子组基因测序
本研究通过了昆明医科大学附属昆明市儿童医院医学伦理委员会审查批准,征得患儿父母遗传分析的知情同意。采集病人及其父母、姐姐和弟弟的外周血进行家系(Trios)测序和全外显子组+拷贝数变异(CNV)检测。
首先进行先证者及其家系的外周血提取基因组DNA,经片段化、连接接头、扩增纯化后,使用杂交捕获方法制备DNA 文库,然后采用高通量测序平台(Illumina Novaseq6000,USA)检测人类全外显子组中20 099 个基因的外显子区域及旁侧内含子区域(20 bp)。将测序数据与人类基因组hg19(GRCh37)参考序列进行比对,并对目标区域的覆盖度和测序质量进行评估。通过数据库多重检索,获取与受检者表型相关的1 523 个基因。参照2015年版美国医学遗传学与基因组学学会(ACMG)指南对变异进行致病性评估。本检测分析了所列基因的大片段(连续2 个及以上外显子)CNV,报告的CNV 均经正交试验验证(qPCR或MLPA)。当检出的致病或可能致病变异存在于常染色体隐性基因中时,实验室通过NGS 和/或Sanger 测序确保该基因编码序列的覆盖率达到100%。
1.2.3 测序数据分析及Sanger 测序验证
公共数据库(ESP6500,1000genomes,ExAC,GnomAD)用于过滤频率高于0.001 的变异。使用四种软件(PolyPhen-2、SIFT、CADD 和Mutation Taster)预测单核苷酸变异(single nucleotide variants,SNV)的致病性。测序后根据ACMG 指南致病性评估结合患儿临床资料分别进行遗传学分析。随后根据WES 中发现的突变分别设计引物,进行PCR 扩增以进行Sanger 测序,验证WES 的结果及遗传模式。测序结果通过Mutation Surveyor软件进行序列比对分析,并进行家系验证。
2 结果
2.1 临床结果
2.1.1 常规检查结果患儿血液、尿液的串联质谱检查显示结果无异常,排除患儿有遗传代谢性疾病。
2.1.2 影像检查结果
影像学检查:颅脑+颈椎+腰骶椎MRI 平扫显示双侧小脑半球体积减小,脑沟加深、增宽;第四脑室稍扩大。螺旋CT 颅脑平扫未见异常;周围神经传导功能:周围神经运动传导功能异常(左侧CMAP 波幅稍低)。常规心脏彩超检查未见异常。十二通道心电图检查为窦性心律,正常心电图。胸部正侧位片示双肺纹理增多,心隔未见明显异常。见图2。
2.2 全外显子组基因测序
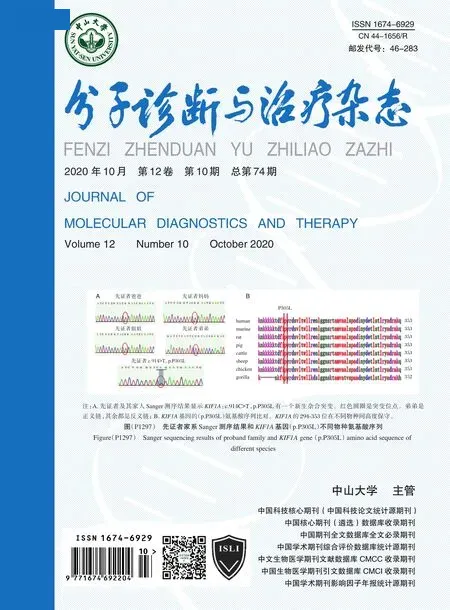
测序结果发现一个与患儿临床表型高度相关的基因KIF1A:c.914C>T(p.Pro305Leu)(NM_004321.7)杂合错义突变位点。此突变位点在KIF1A基因11 号外显子区域,出现的杂合突变c.914C>T 使编码区第914 位碱基的胞嘧啶(C)变为胸腺嘧啶(T),该变异导致编码蛋白的第305 位氨基酸的脯氨酸(Pro)变成亮氨酸(Leu)。
2.3 Sanger 测序验证结果
Sanger 测序验证结果显示此患儿携带KIF1A:c.914C>T(p.Pro305Leu)杂合突变,其父母均未携带,其姐姐及弟弟此位点均无突变,因此,该变异位点为新生变异。见图3。
3 讨论
基因突变位点KIF1A:c.914C>T(p.Pro305Leu)(NM_004321.7)在一般人群数据库gnomAD 中未收录,该变异尚未在HGMD 数据库收录,为新发现的变异位点。通过Grantham's Distance 软件预测提示脯氨酸和亮氨酸的理化性质差异中等(Grantham dist:98)[6-7]。氨基酸保守性分析表明,该位点的野生型氨基酸(Pro305)在分析的90 种脊椎动物中保守,表明该位点发生变异很大的可能将不被容忍,并可能对蛋白质的结构和/或功能产生不良影响。该错义突变在3 种功能预测软件中都提示有害(SIFT Score:0.001,Polyphen2 HVAR Score:0.999,Mutation Taster Score:1.1),根据ACMG 指南,该变异评级为疑似致病突变,根据患儿的临床表现和基因分析结果,此患儿诊断为MRD9。
KIF1A基因新生突变致病有报道称表型特征为中度至重度发育迟缓或智力落后,多数表现为小脑萎缩、视神经萎缩、轴索感觉运动神经病和痉挛性麻痹[6]。本例患者突变与MDR9 已经报道过的表型有相同的特征;MRI 显示双侧小脑半球体积减小,脑沟加深、增宽,说明有小脑萎缩。步态异常和行走不稳的表型特征在MRD9 的OMIM 数据库中均有描述,值得注意的是患者还存在双侧足内翻和自发巴氏征阳性,右足尤其明显。本次病例出现的足内翻、自发巴氏征阳性、看人时角膜向上和外斜视都是MRD9 首次报道的表型。
KIF1A基因编码特定于神经元的运动蛋白[9],最早是在研究神经轴突的膜泡运输时发现的,KIF1A主要负责神经系统里轴突上突触囊泡前体的快速运输,并且它介导的轴突运输对神经的成长、存活和功能发挥有重要的作用[10-12]。疾病相关突变使突触囊泡前体的KIF1A 运动和轴突顺行转运亢进,导致运动神经元受损[13],因此走路不稳易摔倒、语言发育迟缓和智力落后为其主要临床症状。本例患儿的原因可能与KIF1A基因突变使运动神经元受损相关。
尽管KIF1A基因突变已经在一些神经退行性疾病的家族中被描述过,但是儿童患病报道很少,对于KIF1A基因导致MRD9 的表型程度和致病机制的研究知之甚少。Hamdan et al 2011年报道的一个新生错义突变(p.T99M)影响了发育迟缓和小脑萎缩儿童的KIF1A 结构域的ATP 结合位点[14]。为了确定Thr99Met 错义突变是否影响KIF1A沿神经突的运动,曾经有研究者们使用不同的KIF1AMD-EGFP 融合构建转染了大鼠初级海马神经元,该突变被证明会影响KIF1A的运动活性[15]。因此,我们这例患儿发病的确切机制需要进一步的功能研究来充分阐明KIF1A变异的遗传优势和神经元类型特异性。
本次研究患儿有家族遗传史,爷爷、爸爸和叔叔均为不同程度的耳聋。本研究结果说明MYT1L基因exon 15 碱基缺失发生6 个移码突变后使翻译停止导致的常染色体显性精神发育迟滞39 型。因此,本研究也证实患儿与姐姐虽然都有先天性智力落后和发育迟缓缺陷,但是WES 显示她们的致病基因明显不同,所患疾病也不同。这也提示一个遗传病家族成员中,可能同时存在多个遗传学病因。