慢性乙型肝炎患者外周血中sFGL2检测的临床意义
洪晓绿 潘小平 徐沛演 黄小华
可溶性纤维介素蛋白2(soluble fibrinogen like protein 2,sFGL2)属纤维蛋白原相关超家族,与纤维蛋白原β 链和γ 链同源,其基因定位于7q11.23,全长约7 kb,含2 个外显子,1 个内含子[1]。sFGL2 主要是由T 淋巴细胞分泌,作为免疫抑制因子,它可抑制T 淋巴细胞和树突状细胞活性,介导B 淋巴细胞凋亡[2]。国内外已有研究表明,sFGL2 与胰腺炎[3]、冠心病[4]、肾细胞癌[5]等疾病相关。近年来,sFGL2在病毒性肝炎发病机制中的作用越来越受到重视,但大多研究主要以病理组织为主[6-7],鉴于此,本文将分析sFGL2 表达变化及临床意义,并与临床相关指标进行相关性分析,旨在探讨其预测CHB 患者临床转归和预后的价值;同时深入研究sFGL2 在CHB 患者抗病毒治疗前后表达变化,分析它成为CHB 患者抗病毒治疗监测指标的可行性。
1 资料与方法
1.1 一般资料
随机选取2019年8月1日~2020年1月22日在本院就诊的CHB 患者140 例作为乙型肝炎病毒感染观察组(CHB 组),男性86 例,女性54 例,平均年龄(38.96±12.07)岁。其中25 例CHB 患者依据临床诊断需进行抗病毒治疗(抗病毒治疗组),男性16 例,女性9 例,平均年龄(40.65±13.41)。选取同期丙型肝炎患者42 例作为丙型肝炎病毒感染观察组(CHC 组),男性35 例,女性7 例,平均年龄(40.95±6.24)岁。另外选取同期体检健康人群68例作为对照组,男性26 例,女性42 例,平均年龄(36.71±12.85)。各组间年龄比较差异无统计学意义(F=2.492,P=0.116),具有可比性。
纳入标准分别符合中华医学会感染病学会分会和中华医学会肝病学分会制定的慢性乙型肝炎防治指南(2019年版)[8]或慢性乙型肝炎防治指南(2019年版)[9]的诊断标准。排除标准:①乙肝及丙肝重叠感染者;②合并其他慢性肝病者;③合并肝恶性肿瘤或其他脏器恶性肿瘤者;④其他重要脏器功能不全。健康体检志愿者未携带肝炎病毒。患者参与前均签署知情同意书,本研究经本院伦理委员会审核批准。
1.2 方法
1.2.1 标本采集及处理
所有受试者清晨空腹采集静脉血5 mL 置于乙二胺四乙酸二钠抗凝管中,抗病毒治疗患者于抗病毒治疗3 个月后清晨空腹另采集静脉血5 mL置于乙二胺四乙酸二钠抗凝管中。采血后30 min内取全血1.5 mL 置于离心管中,按照人外周血淋巴细胞分离液(碧云天生物技术,上海)说明书,提取并纯化外周血单个核细胞,-80℃保存;剩余全血1 500 rpm 离心20 min,分离血浆,-80℃保存。
1.2.2 酶联免疫吸附试验检测血浆sFGL2 浓度
按照人可溶性纤维介素蛋白2(sFGL2)试剂盒(科易达生物科技有限公司,广州)说明书检测所有受试者血浆中sFGL2 浓度,CHB 组血浆同时送本院医学检验科检测HBV-DNA、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、谷氨酰转肽酶(γ-glutamyl transferase,GGT)、总胆红素(total bilirubin,T-Bil)和甲胎蛋白(alpha fetoprotein,AFP)。
1.2.3 实时定量聚合酶链式反应检测sFGL2mRNA 表达
Trizol(Invitrogen,美国)提取外周血单个核细胞总RNA 后,反转录为cDNA。以cDNA 为模板,用特异性引物(sFGL2-F:AGGCAGAAACGGACTGTTGT,sFGL2-R:CCAGGCGACCATGAAGTACA)进行扩增,以GAPGH(GAPGH-F:TGCACCACCAACTGCTTAGC,GAPGH-R:GGCATGGACTGTGGTCATGAG)为内参。体系如下:SYBRTMPremix 10 μL;Forward primer(10 pmol/μL)2 μL;Reverse primer(10 pmol/μL)2 μL;cDNA 3 μL;H2O 8 μL。95℃预变性2 min,然后按照以下条件执行40 个循环:95℃10 s,60℃45 s。采用2-△△Ct法计算其相对表达量,其中△CT=CT目的基因-CT内参基因,△△CT=△CT-△CT对照组最大值,每样品重复3 次,取平均Ct 值。
1.3 统计学方法
运用SPSS 13.0 软件进行数据分析,计量资料采用(±s)表示,两组间比较采用t检验,多组间比较F检验,相关性分析采用Pearson 法,P<0.05 为差异有统计学意义。
2 结果
2.1 3 组间血浆sFGL2 浓度和sFGL2 mRNA 表达比较
3 组血浆sFGL2 浓度和sFGL2mRNA 表达水平比较:CHB 组>CHC 组>对照组,差异有统计学意义(P<0.05)。见表1。
表1 3 组间血浆sFGL2 和sFGL2 mRNA 表达量比较(±s)Table 1 Coparing the levels of plasma sFGL2 and sFGL2 mRNA in 3 groups(±s)
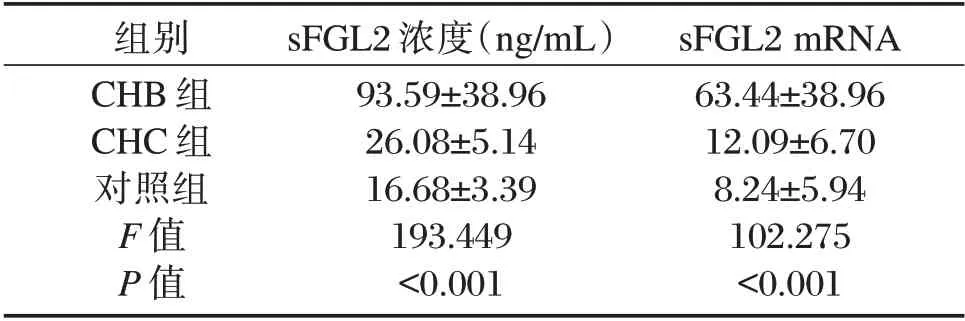
表1 3 组间血浆sFGL2 和sFGL2 mRNA 表达量比较(±s)Table 1 Coparing the levels of plasma sFGL2 and sFGL2 mRNA in 3 groups(±s)
组别CHB 组CHC 组对照组F 值P 值sFGL2 浓度(ng/mL)93.59±38.96 26.08±5.14 16.68±3.39 193.449<0.001 sFGL2 mRNA 63.44±38.96 12.09±6.70 8.24±5.94 102.275<0.001
2.2 血浆sFGL2 和sFGL2 mRNA 表达与CHB 患者各临床指标间的相关性分析
Spearman 分析结果表明,sFGL2 与HBV-DNA病毒载量、ALT、AST 呈正相关(P<0.05),与GGT、T-Bil、AFP 无相关(P>0.05),见表2。

表2 血浆sFGL2 和sFGL2 mRNA 表达与CHB 患者各临床指标间的相关性分析Table 2 analysising the correlation between plasma sFGL2 and sFGL2 mRNA expression with clinical indexes in CHB patients
2.3 抗病毒治疗前后血浆sFGL2 浓度和sFGL2 mRNA 表达比较
抗病毒治疗组经3 个月抗病毒治疗后血浆sFGL2 浓度和sFGL2mRNA 表达较抗病毒治疗前显著下降,差异均有统计学意义(P<0.05),见表3。
3 讨论
目前,乙型肝炎病毒(hepatitis B virus,HBV)造成患者慢性感染的免疫学损伤机制仍不明确,T 淋巴细胞尤其是调节性T 淋巴细胞(regulatory T cell,Treg)在其发生发展进程中起关键作用[10]。sFGL2 主要由T 淋巴细胞分泌,是Treg 细胞活性功能不可缺少的重要调节因子,其生物学功能已成为近年来研究的热点[11],与肝脏相关疾病的研究也涉及其中,如COLAK 等[12]报道sFGL2 在非酒精性脂肪肝病患者中高表达;AI 等[13]报道sFGL2在自身免疫性肝炎患者活动期显著升高,其升高程度与AIH 严重程度成正比;YU 等[14]报道在暴发性肝炎中sFGL2 可激活补体系统,参与疾病的发展进程。
sFGL2 在病毒相关持续感染过程中亦具有十分重要的作用。体外实验表明,重组的sFGL2 可通过抑制Tregs 细胞,使Th1/Th2 淋巴细胞失衡[15]。体内研究中,Foerster 等[16]证实在慢性丙型肝炎外周血中sFGL2 水平与疾病的分期和预后密切相关,肝脏炎性反应和纤维化程度越严重,外周血sFGL2 水平越高。而本研究结果提示sFGL2 与病毒性肝炎密切相关。有研究指出sFGL2 是活化型肝脏星状细胞的效应分子,参与调控HBV 相关肝癌患者的T 淋巴细胞功能,而T 淋巴细胞失衡及免疫耐受是导致HBV 感染后慢性化成为CHB的关键性因素之一[17]。综上推测,sFGL2 可能抑制了机体针对于HBV 的T 淋巴细胞活性,导致机体产生免疫耐受,从而促进HBV 的复制和肝病的进一步发展。因此,sFGL2 在CHB 中的发生发展以及临床分期中的作用值得深入探讨。
陈云茹等[18]研究血浆sFGL2 在HBV-DNA 不同病毒载量间无相关性,sFGL2 水平与CHB 患者肝功能密切相关。这些结果表明,sFGL2 参与了肝细胞炎症坏死过程,从而影响肝脏合成功能。因此,sFGL2 水平有可能成为评估CHB 患者疾病严重程度的预测因子,它可作为CHB 诊治、病情变化、临床转归的观察指标,宜在临床工作中开展检测。
表3 抗病毒治疗前后血浆sFGL2 和sFGL2 mRNA 表达量比较(±s)Table 3 Coparing the levels of plasma sFGL2 and sFGL2 mRNA befor and after antiviral treatment in 25 CHB cases(±s)

表3 抗病毒治疗前后血浆sFGL2 和sFGL2 mRNA 表达量比较(±s)Table 3 Coparing the levels of plasma sFGL2 and sFGL2 mRNA befor and after antiviral treatment in 25 CHB cases(±s)
观察指标血浆sFGL2 浓度sFGL2 mRNA 相对表达量n 25 25抗病毒治疗前127.41±24.07 97.26±12.38抗病毒治疗后74.40±22.97 25.72±12.52 t 值48.463 22.068 P 值<0.001<0.001
本研究中CHB 患者经抗病毒治疗3月后,sFGL2 也显著下降,这与吴盛迪等[19]研究结果一致,提示sFGL2 表达水平与抗病毒治疗疗效密切相关。因此,sFGL2 可成为CHB 患者抗病毒治疗监测指标。然而本研究仅局限于sFGL2 在CHB患者外周血中的表达差异以及分析CHB 患者抗病毒前后该指标的变化,未涉及其机制研究,下一步需进行HBV 对sFGL2 基因的激活功能以及sFGL2抑制Tregs 细胞的相关机制研究。
综上所述,sFGL2 作为一种免疫调节分子,在CHB 的病理生理过程中具有重要的免疫调控作用。它在CHB 患者外周血中高度表达,与肝损害临床指标密切相关,可作为CHB 诊治、病情变化、临床转归的观察指标。同时,sFGL2 在CHB 患者抗病毒治疗后显著性下降,它也可作为CHB 患者抗病毒治疗疗效的监测指标,宜在临床工作中推广应用。