人类白细胞抗原B27核酸检测国家参考品的建立
胡泽斌 高飞 孙楠 孙彬裕 李丽莉 孙晶 曲守方 黄杰
人类白细胞抗原(human leukocyte antigen,HLA)B27 抗原的表达与强直性脊椎炎有高度相关性,超过90%的强直性脊椎炎患者其HLA-B27 抗原表达为阳性,普通人群中仅5%~10%的为阳性[1-3]。迄今已有70 多种HLA-B27 亚型被发现和鉴定,在中国人群中B2705 和B2704 亚型分布最广并且与强直性脊椎炎密切相关[4-6]。随着基因检测技术的发展和相关试剂盒的研发上市,基于聚合酶链反应(polymerase chain reaction,PCR)的HLA-B27 核酸检测已成为临床上的常用检测手段[7-9]。然而目前,我国尚无针对HLA-B27 核酸检测试剂盒的国家参考品,无法对此类试剂盒进行统一的质量评估。为确保HLA-B27 核酸检测临床测定结果可靠,为临床诊断提供有力证据,中国食品药品检定研究院体外诊断试剂检定所非传染病诊断试剂室计划研制一套能够进行HLA-B27 核酸检测性能评价的国家参考品。
1 材料与方法
1.1 材料
1.1.1 主要试剂
人外周血淋巴细胞分离液、环孢霉素A 和二甲基亚砜,由北京索莱宝科技有限公司提供;基因组DNA 提取试剂盒(磁珠法),HLA 高分辨基因分型建库试剂盒,Qubit™ssDNA Assay Kit(Invitrogen),MGISEQ-2000RS 高通量测序试剂套装,由深圳华大智造科技有限公司提供;人类白细胞抗原B 位点基因高分辨分型试剂盒(测序法)由北京博奥晶典生物技术有限公司提供;人类白细胞抗原B27 核酸检测试剂盒(荧光PCR 法)由江苏默乐生物科技股份有限公司提供;SeCore HLA B 位点测序分型试剂盒(测序法)由北京旌准医疗科技有限公司提供;人类白细胞抗原B*27 基因分型试剂盒(SSP 法和荧光PCR 法)由江苏伟禾生物科技有限公司提供。
1.1.2 主要仪器
MGISEQ-2000RS 测序仪由深圳华大智造科技有限公司提供;基因扩增仪S1000(Bio-Rad)、基因分析仪3730xL(ThermoFisher)由北京博奥晶典生物技术有限公司提供;SLAN-96P 全自动医用PCR分析系统由江苏默乐生物科技股份有限公司提供;ABI 3130/3130XL DNA 测序仪/基因分析仪由北京旌准医疗科技有限公司提供;ABI GeneAmp-PCR System 9700、ABIReal-Time PCR Systems 7500由江苏伟禾生物科技有限公司提供。
1.2 方法
1.2.1 样本收集
招募自愿参与本项目的外周血捐献者,并签署了知情同意书。自2018年2月至2019年2月,共收集到HLA-B2704 阳性样本2 例、HLA-B2705阳性样本3 例、HLA-B27 阴性样本8 例。采集志愿者10 mL 新鲜外周血,放入一次性肝素钠/锂或枸橼酸钠抗凝管采血管中,2~8℃保存运输至实验室。核淋巴细胞,加入病毒液制备完全转化液,进行细胞转化与细胞培养、冻存。建立细胞系后进行种子细胞系扩大培养。
1.2.2 国家参考品的制备与验证
将采集的志愿者外周血进行永生化细胞系的建立[10-11],按基因组DNA 提取试剂盒操作步骤,提取10 例成功建系的细胞基因组DNA,使用安捷伦NanoDorp 测定其OD260/OD280 值检验纯度,利用琼脂糖凝胶电泳胶检验DNA 的完整性。使用Qubit Fluorometer3.0 对10 例DNA 样本进行定量后稀释至20 ng/μL 的浓度,采用高通量测序(next generation sequencing,NGS)技术对每个样本验证。验证合格的DNA 样本进行分装并贴上标签。
1.2.3 国家参考品的协作标定
分别使用4 家协作标定单位的HLA-B27 检测试剂盒对国家参考品进行协作标定,按照试剂盒说明书进行操作。测序法每个样本测定1 次,PCR法每个样本测定3 次。按照说明书的检测限要求将参考品样本稀释之后进行再次检测。
1.2.4 国家参考品稳定性和均匀性验证
随机选取五套国家参考品,在-20℃与25℃之间反复冻融3 次(每隔1 天一次)之后,分别使用测序法、PCR 法、SSP 法的HLA-B27 检测试剂盒对参考品进行稳定性验证。另外随机取出三套国家参考品,使用测序法的HLA-B27 检测试剂盒对参考品进行均匀性验证。
2 结果
2.1 国家参考品的制备及验证
每套HLA-B27 国家参考品包括10 例基因组DNA 样本(3 例HLA-B2705 阳性、7 例HLA-B27 阴性)。琼脂糖凝胶电泳结果显示01-10 号样本的DNA 条带完整锐利,且分子量在23 kb 左右,见图1。
01-10 号样本的OD260/OD280 值均在1.80~2.15 之间,表明DNA 的纯度较高符合检测需求经NGS 测序技术对每个样本的HLA-B 位点进行4 位高分辨基因分型检测,HLA-B 位点的分型结果均与建系之前的外周血基因组DNA 的分型信息一致,最后按照30 μL 体积进行分装,贴标签,见表1。
2.2 国家参考品的协作标定
实验室邀请4 家协作标定单位(分别用A、B、C、D 代表),采用PCR-基因测序分型法(sequence based genotyping,SBT)、荧光PCR 法、和PCR--序列特异性引物法(sequence specific primer,SSP)对国家参考品进行了验证,见表2。
2.3 国家参考品的稳定性和均匀性验证
使用A 单位的HLA-B 位点基因高分辨分型试剂盒(SBT 法)对3 套参考品和2 套反复冻融3 次后的参考品进行检测,使用C 单位和D 单位的HLA-B27 核酸检测试剂盒(PCR 法和SSP 法)对3 套反复冻融3 次后的参考品进行检测。见表3。
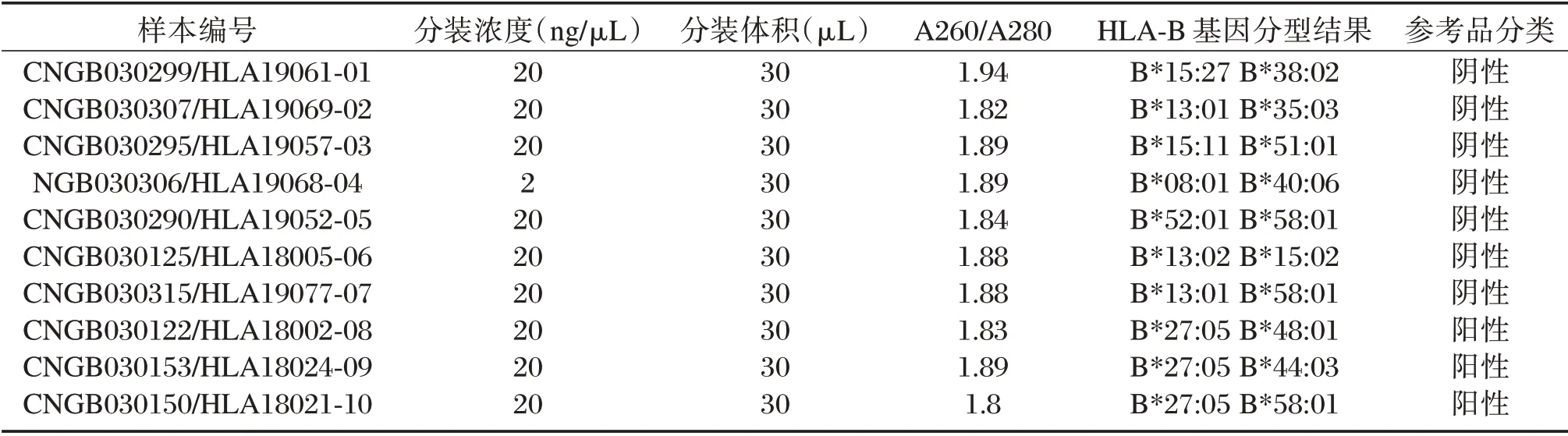
表1 10 例DNA 样本的验证结果Table 1 Verification results of genomic DNA from 10 Samples
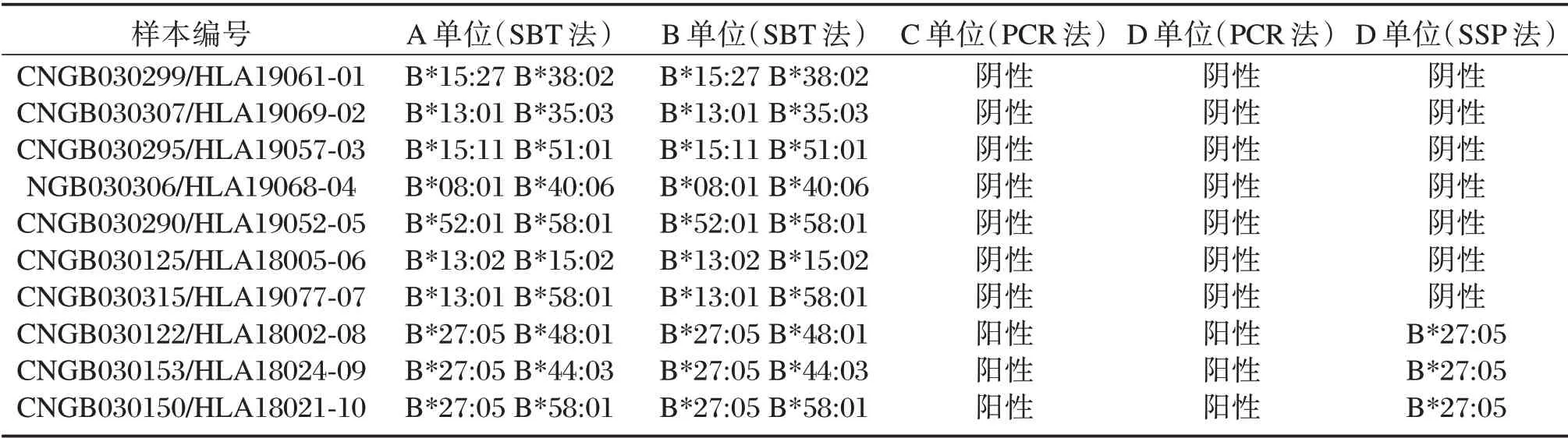
表2 4 家协作标定单位的验证结果Table 2 Verification results of references by detection kits from 4 manufacturers
3 讨论
大量研究数据表明,基于PCR 方法学的HLA-B27 核酸检测已经成为临床辅助诊断强直性脊柱炎的常用方法[12-14],而试剂盒的质量是保障临床诊断准确的关键因素。然而不同企业不同方法学的试剂盒在检测原理、原材料、生产工艺等方面均有所差异,在质量控制和性能评价中使用各自的企业参考品,导致不同试剂盒的检验结果缺乏可比性,建立标准化的国家参考品可以对不同试剂盒的质量进行统一评价。
标准物质是指具有一种或多种足够均匀并且稳定的具有准确特性量值的测量标准,量值准确性、足够均匀性和良好稳定性是标准物质的三大重要特性[15-17]。本研究通过4 家实验室采用荧光PCR 法、PCR-SSP 法以及PCR-SBT 测序法的HLA-B27 检测试剂对参考品进行协作标定,其中A 单位和B 单位两家实验室均使用世界卫生组织推荐的HLA 分型方法金标准即PCR-SBT 测序法,对10 例国家参考品(每一例均含2 条染色体)进行4 位基因分型,结果完全一致;C 单位和D 单位两家实验室使用荧光PCR 法、PCR-SSP 法的不同检测试剂,对10 例国家参考品B27 的阴阳性结果进行判断,结果完全一致,以上数据充分保障了国家参考品的定值准确。
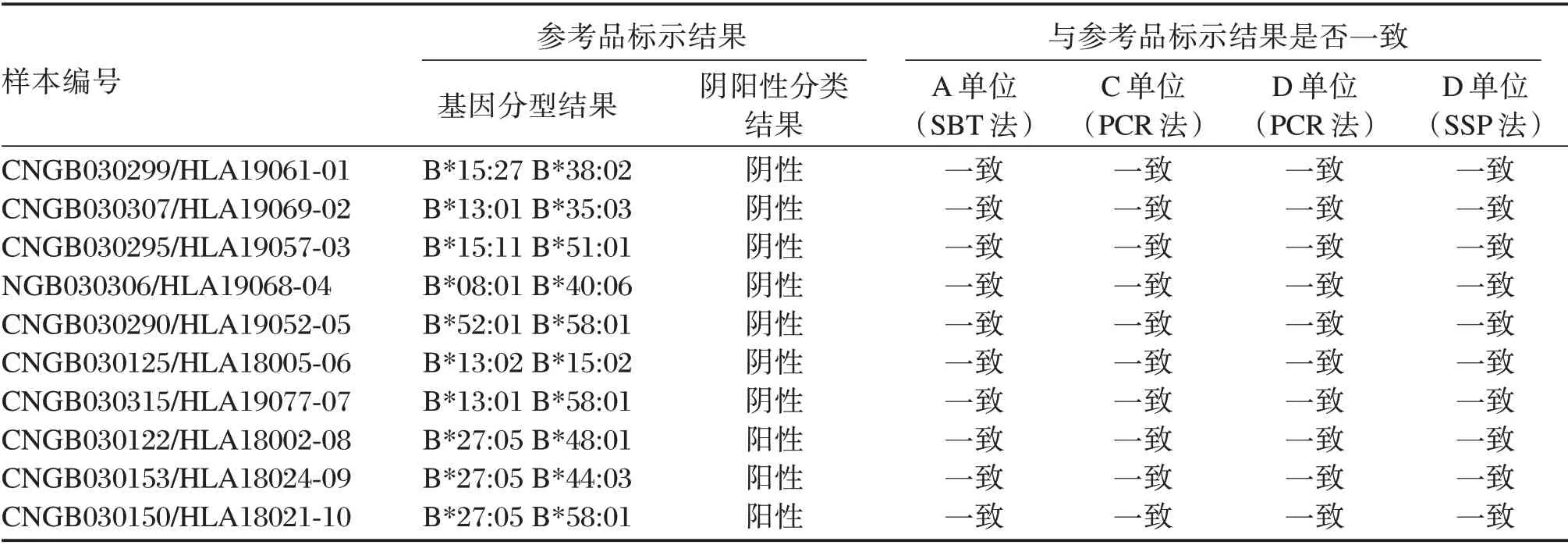
表3 国家参考品稳定性和均匀性的验证结果Table 3 Verification results of stability and homogeneity for references
本参考品是细胞系提取的基因组DNA 样本,常规在在-20℃以下保存,且要求干冰或-20℃冷链运输,用户不宜反复冻融后使用。DNA 样本自身的均匀性和稳定性是良好的。本研究通过3 家实验室采用PCR 法、PCR-SSP 法以及PCR-SBT 测序法,对3套国家参考品、以及5 套在-20℃与25℃之间反复冻融3 次之后的国家参考品进行验证,结果显示A 单位、C 单位和D 单位的验证结果均与-20℃保存的国家参考品的标示结果完全一致,表明国家参考品在反复冻融3 次之后依然稳定和均匀。此外,本参考品销售半年以来,多家用户使用后反馈良好,也表明了其稳定性和均匀性良好;本实验室既往研制的多套DNA 参考品的稳定性和均匀性实验结果以及售后反馈,均表明DNA 参考品一直非常稳定[18];同时还将对该国家参考品进行长期稳定性研究以及期间核查,以确保长期放置后依然满足要求。
由于测序法的HLA-B 核酸检测试剂盒应对待测样本报告出HLA-B 的4 位基因分型信息,国家参考品在对此类试剂盒进行性能评价时,10 例参考品均作为阳性参考品可对试剂盒的准确性指标进行评价,10 例参考品稀释后可对试剂盒的检测限指标进行评价;其他方法学的HLA-B 核酸检测试剂盒主要包括:荧光PCR 法、PCR-SSP 法、PCR-序列特异性寡核苷酸探针法(sequence specific oligonucleotide,SSO)、PCR 熔解曲线法,此类试剂盒一般针对B27 的常见亚型如B2705 和B2704 设计特异性引物,对待测样本报告阴性或阳性的结果。7 例B27 阴性国家参考品可对试剂盒的特异性指标进行评价,3 例B27 阳性国家参考品可对试剂盒的准确性和检测限指标进行评价。
综上所述,本实验室成功建立了人类白细胞抗原B27 核酸检测国家参考品,该参考品的准确性、均一性和稳定性均符合要求,可用于人类白细胞抗原B27 核酸检测试剂盒的质量评价。