胞外囊泡携带的非编码RNA在肝癌发生、发展中的作用
陈 鹏 综述 李 涛 审校
(上海交通大学医学院附属瑞金医院外科,上海 200025)
肝细胞肝癌简称肝癌,是全球范围常见的恶性肿瘤,死亡率较高。我国恶性肿瘤死亡率中肝癌列第三位。虽然近年来手术切除、化疗及靶向治疗等提高肝癌的治疗效果,但5年总生存率并无明显改善,对于进展期肝癌病人更是收效甚微。探索肝癌的发生、发展机制,寻找新型肿瘤标志物,有助于早期诊断、早期治疗,提高病人生存率。
胞外囊泡及其携带的非编码RNA
胞外囊泡(extracellular vesicle,EV)是从细胞膜上脱落或由细胞分泌双层膜结构的囊泡状小体,主要包括外泌体、微囊泡和凋亡小体组成[1-2]。外泌体直径30~100 nm,由细胞内的多泡小体与细胞膜融合后,以外分泌形式释放到细胞外。其过程为质膜内芽形成早期内体,进一步发育可形成胞内囊泡。大量胞内囊泡融合形成多泡小体[3]。微囊泡是细胞激活或损伤后以出芽方式从细胞膜脱落的小囊泡,直径在100~1 000 nm。凋亡小体则更大,直径>1 000 nm,伴随细胞凋亡而产生。本质上,EV可看作溶酶体的流动、囊泡内容物的降解而产生。这些EV带有表面分子标志,可靶向受体细胞。一旦与受体细胞接触,EV可通过受体-配体结合激活信号通路或内吞、吞噬或膜融合的方式输送内部成分,影响受体细胞的生理状态[2]。
EV广泛存在于细胞培养上清液以及各种体液中,携带细胞来源相关的多种蛋白质、DNA、RNA等[2,4]。 EV 可通过所携带的RNA等成分在细胞间传递生物信息并调节受体细胞的功能[4-7]。已有研究证实肝癌来源的EV有助于肝癌细胞的扩散、肝内转移以及多灶性生长[8]。EV通过传递内含的活性RNA[包括非编码 RNA(non-coding RNA,ncRNA)]和蛋白质,使肝癌细胞微环境受到影响,增强细胞增殖与上皮细胞-间充质转化,增加肿瘤的血管生成,且具有逃避免疫监视的能力[9-10],促进肝癌进展及转移[11]。ncRNA指RNA不具有编码RNA的功能,但通过多种途径参与基因的转录与转录后的修饰过程,从而影响细胞的生物学行为[12]。这些RNA成分包括信使 RNA (messenger RNA,mRNA)、 微小 RNA(microRNA,miRNA)、长链非编码 RNA(long non-coding RNA,lncRNA)、PIWI相互作用 RNA (piwi-interacting RNA)、小核仁 RNA(small nu-cleolar RNA,snoRNA)、 小核 RNA (small nuclear RNA,snRNA)等[4]。不同的ncRNA发挥不同的作用。如snoRNA是介导RNA化学修饰的关键,参与转运RNA(transfer RNA,tRNA)与mRNA的修饰,而后者是蛋白质合成必不可少的部分[12]。
本文综述EV中的miRNA和lncRNA在肝癌发生、发展中的重要作用。
EV携带的miRNA促进肝癌发生、发展
miRNA是包含20~22个核苷酸的ncRNA,不具有编码蛋白质的功能,但可通过RNA沉默和转录后的调控来影响基因表达,从而在分子水平通过多种机制影响肿瘤的发生和发展[13]。
已有学者证实miRNA的异常表达与肝癌增殖、转移、化疗药物耐药等肿瘤特有的生物学行为密切相关。Zhang等[13]发现miR-196b-5p在肝癌的高水平表达促进肿瘤的发生和发展,具体体现在增大肿瘤体积、促进肿瘤的血管和神经侵袭等方面。Xu等[14]发现肝癌组织的miR-885-5p表达下调,而此ncRNA直接作用于己糖激酶2(HK2)的3'-未翻译区。MiR-885-5p/HK2轴与需氧糖酵解密切相关,从而抑制Warburg效应,促进肿瘤细胞的增殖。Xu等[15]发现肝细胞来源的miR-122水平下调,通过靶向调控IGF-1R作用于RAS/RAF/ERK信号通路,导致肝癌细胞对索拉非尼耐药。Hu等[16]发现miR-26b直接抑制人含锌带状蛋白-1(zinc ribbon domain containing protein 1,ZNRD-1)转录活性,后者促进 Wnt/β-catenin 信号通路激活而促进肿瘤增殖。因此,miR-26b可能作为一种潜在的肿瘤治疗靶点来指导相关药物研究,改善病人预后。Gao等[17]发现肝癌组织中异常升高的miR-26a通过靶向抑制人肝癌的Mcl1,诱导p53介导的线粒体凋亡。此研究具有重大意义,可能为IFN-α1b和5-FU在肝癌病人的联合应用提供指导。
此外,肝癌细胞通过分泌EV来参与细胞活动调控或改变肿瘤生长的微环境,为肿瘤的发生和发展提供便利。Lin等[18]发现肝癌细胞分泌的EV内miR-210水平上调,可诱导内皮细胞分化,增加局部血管密度,从而促进肝癌细胞增殖。Shi等[19]发现肝癌病人体内EV来源的 miR-638水平下调,有望成为肿瘤标志物,预示预后较差。Ke等[20]发现一条新的miR-148b-CSF1-巨噬细胞信号通路。其中EV来源的miR-148b通过抑制肿瘤中CSF1产生和释放,抑制巨噬细胞向肿瘤组织浸润。通过改变肿瘤细胞所处的微环境免疫状态来促进肝癌发生、发展。Zhou等[21]发现肝癌来源的EV携带miR-21,可靶向作用于PTEN,激活PDK1/AKT信号通路。肝细胞星形细胞转化为癌相关成纤维细胞而促进肿瘤进展,可作为潜在的药物靶点。Liu等[22]发现,肝癌来源的EV内异常表达的miR-25-5p促进肿瘤细胞自播散,可下调LRRC7蛋白的表达来增强肿瘤细胞的跨内皮运动能力,这解释了肝癌的高度侵袭性。
EV携带的lncRNA促进肝癌发生、发展
lncRNA是一类>200个核苷酸、无长阅读框架、通常有mRNA结构特征的RNA。lncRNA在基因组中普遍存在转录现象,其表达水平也受转录及转录后调控机制的严密调节。lncRNA不编码蛋白质,但参与调节多种重要的细胞生物学行为,如基因表达、招募染色质修饰物、调节X染色体失活、基因组印记、蛋白质折叠和蛋白质活性等。相对于mRNA与miRNA,对lncRNA在疾病发展中作用的了解还很有限[23]。
研究表明lncRNA在肝癌组织中异常表达,在其发生、发展中起至关重要的作用。如HULC是最早证实在肝癌中表达显著上调的lncRNA[24]。HULC在产生HBx的细胞中表达上调,且上调的HULC抑制p18的活性,进而促进肝癌细胞增殖[25]。H19在HBV相关性肝癌中高表达,并通过IGF-2发挥促进肿瘤生长的作用[26-27]。lncRNA-ATB是TGF-β信号通路的介导物,在肝癌组织中高表达,可通过IL-11以及STAT3信号通路促进肿瘤侵袭转移[28]。HOTAIR是一种研究较广泛的lncRNA,在多种肿瘤组织中表达异常。其在肝癌组织及肝癌细胞系中明显过表达[29]。HOTAIR还与肝癌肝移植术后复发密切相关,可用来预测复发[30]。LncRNA-HEIH在HBV相关性肝癌的表达与肿瘤复发密切相关[31]。lncRNA-HEIH在HCV所致肝癌病人血浆和EV中的表达升高[32],是预测生存的独立因素。该lncRNA与EZH2的增强子相互作用,抑制重要的细胞周期蛋白依赖蛋白激酶抑制剂EZh2目标基因p15、p16和p57的活性[31]。lncRNA-FAL1在肝癌组织上调,加速肿瘤细胞增殖与转移[33]。其还可作为分子海绵结合miR-1236,即lncRNA与对应mRNA竞争结合microRNA反应元件,抑制miRNA表达[34]。后者主要通过抑制 HDAC3与 SENP1的表达,调节缺氧导致的上皮细胞-间充质转化和细胞增殖[35]。其与门静脉癌栓、淋巴结转移、TNM分级、总体生存率等有明显的相关性[36],可作为肝癌新型标志物。Lin等[37]发现在肝癌组织和癌旁组织中,lncRNA-UBE2CP3表达有差异,在肝癌中表达升高。进一步研究表明,其通过ERK1/2/HIF-1α/VEGFA通路促进VEGFA表达而增强肿瘤的血管侵袭性。此外,lncRNA OGFRP1通过下调AKT/mTOR信号通路抑制肝癌[38]。lncRNA PTTG3P则激活 PTTG1与PI3K/AKT信号通路调控肿瘤生长[39]。lncRNA-00364通过调整p-STAT3-AS1抑制肝癌[40]。Li等[41-42]对肝癌组织 lncRNA ZEB1-AS1与 lncRNA ZFAS1的表达进行研究,发现两者在肝癌细胞系及肝癌组织中表达均明显上调,通过不同分子机制参与肝癌侵袭转移,与预后密切相关,可作为预测肝癌预后的可靠指标。上述研究均表明,多种lncRNA参与肝癌的发生、发展,有望成为预测肝癌预后的生物学标志物。
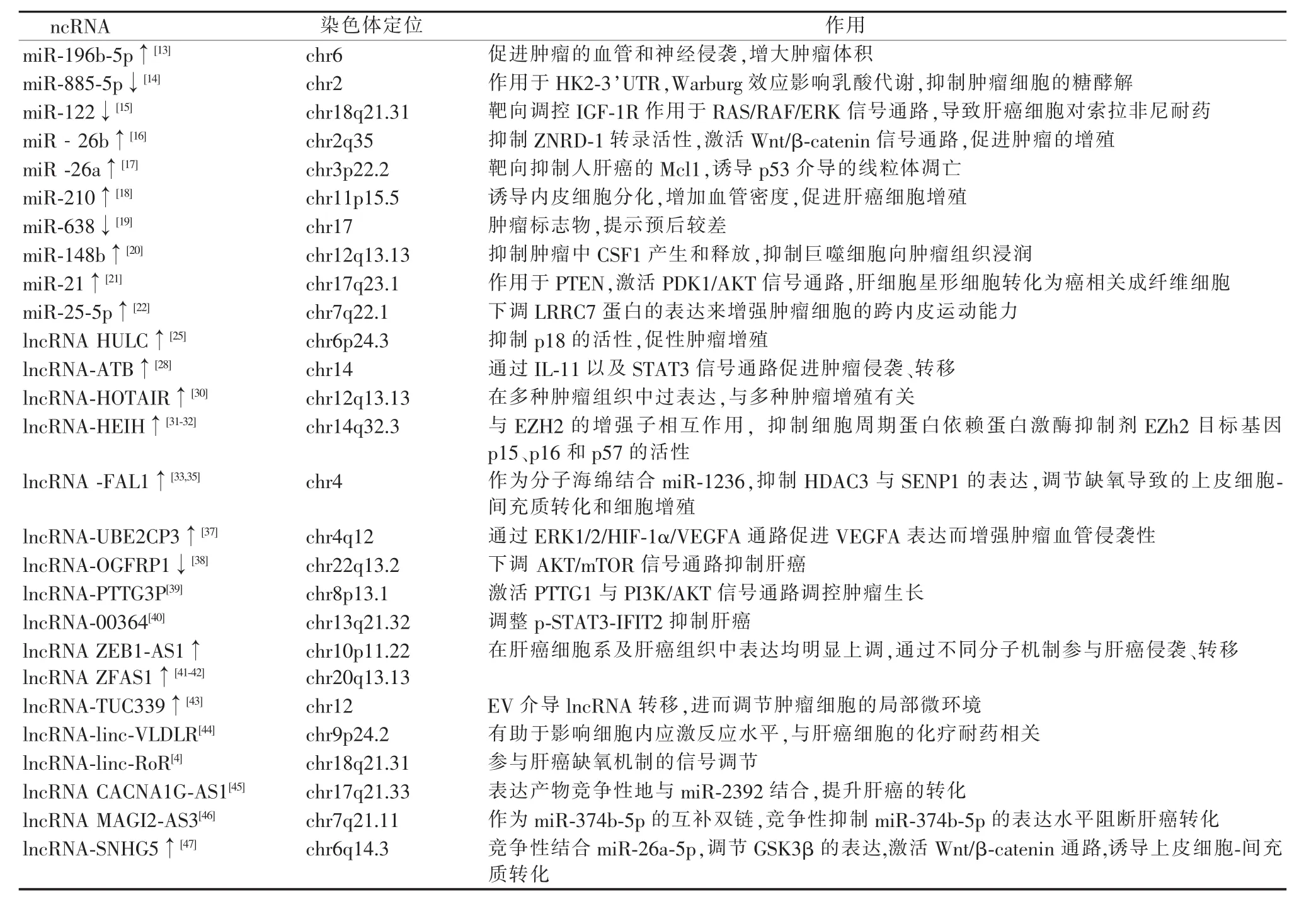
表1 ncRNA在肝癌发生、发展中的作用
最近的研究证实肝癌来源的EV富含lncRNA,且影响肿瘤细胞的生物学行为。Kogure等[43]在肝癌来源的EV中鉴定出超保守的lncRNA-TUC339。其促进肝癌细胞的增殖,证实肿瘤细胞可通过EV介导lncRNA转移,进而调节肿瘤细胞的局部微环境并对其他细胞产生影响。Takahashi等[44]研究表明肝癌来源EV的lncRNA-linc-VLDLR有助于影响细胞内应激反应水平,与肝癌细胞化疗耐药相关。其还报道,同样源于肝癌EV的linc-RoR参与肝癌缺氧机制的信号调节[4]。这些lncRNA富集于EV中,可避免被机体降解,在细胞间传递lncRNA,发挥生理功能。Yang等[45]发现lncRNA CACNA1GAS1有望成为新的癌基因,其表达产物竞争性地与miR-2392结合,提升肝癌的转化。Yin等[46]发现EV来源的lncRNA MAGI2-AS3作为miR-374b-5p的互补双链,竞争性抑制miR-374b-5p的表达水平,阻断肝癌转化。Li等[47]发现肝癌细胞来源的lncRNA-SNHG5可作为内源性RNA竞争性结合miR-26a-5p,调节下游目标GSK3β的表达,并激活Wnt/βcatenin通路,诱导上皮细胞-间充质转化等机制促进肿瘤生长和转移。
综上所述,诸多miRNA与lncRNA参与肝癌发生、发展(见表1)。但对EV来源的miRNA与lncRNA在肝癌发生、发展中的作用尚未完全明确。借助目前二代测序等最新的检测手段,可检测EV来源miRNA与lncRNA的微量表达,深入研究其在细胞间信息传递等的作用。这将有助于发现肝癌的早期诊断、治疗效果及预后判断的新型血清标志物,为阐明肝癌发生、发展及转移机制提供新思路,寻找肝癌治疗的新靶点。

