自然发酵牛乳中乳酸菌和酵母菌的活菌动态变化
徐伟良,李春冬,雅 梅,2,郭 梁,2
(1.锡林郭勒职业学院 生物工程研究院,内蒙古 锡林浩特 026000;2.锡林郭勒职业学院 食品检验检测和风险评估中心,内蒙古 锡林浩特 026000)
微生物广泛存在于自然界中,有着极高的多样性和丰富度,并且这些微生物并不是单独存在的,而是共存于微生物群落中,如乳酸菌与酵母菌常共生形成复杂的相互作用网络[1]。人们很早就学会利用乳酸菌与酵母菌作为益生菌用于生产、生活,例如,日常生活中常见的泡菜[2]、葡萄酒[3]、醋[4]、馒头[5]及酸粥[6]等,也有如马奶酒[7]、开菲尔[8]、干酪[9]、黄油[10]等通过天然微生物菌群生产的发酵乳制品。虽然乳酸菌和酵母菌之间的相互作用对产品的质地、风味及生物保健功效等起着不可代替的作用[11-12],但目前对于乳酸菌和酵母菌相互作用机理还处于推测阶段,多数学者认为乳酸菌与酵母菌之间可能存在代谢产物互补机制,以及通过信号分子进行信息交流,来调控相关基因的表达[13-14]。随着对微生物代谢途径的深入理解以及限制性片段长度多态性(restriction fragment length polymorphism,RFLP)、荧光原位杂交技术(fluorescence in situ hybridization,FISH)等现代分子生物学技术的不断发展,乳酸菌与酵母菌的相互作用机理势将得以阐明,从而对更广泛挖掘和利用微生物资源具有重要的理论意义和实际应用价值[15]。
自然发酵乳制品是指以乳(包括马乳、牛乳、驼乳、羊乳、牦牛乳等)为原料,经微生物自然发酵,形成的主要产物为乳酸的乳制产品[16]。我国发酵乳制品的制作历史悠久,制作工艺源远流长,据记载,北方游牧民族早在2 000多年前由于游牧生活的需要,就有制作和食用自然发酵乳制品的习俗[17]。发酵乳制品利用环境中的微生物进行自然发酵,不仅保留了乳品的天然品质特色,而且其中蕴藏着丰富的乳酸菌和酵母菌资源。
本研究通过构建自然发酵牛乳体系,对不同发酵时期乳酸菌和酵母菌的活菌动态变化进行研究,有助于深入了解自然发酵过程中乳酸菌和酵母菌的变化规律以及相互作用,为进一步工业化鲜制奶酪的生产以及富含乳酸菌和酵母菌的功能发酵乳的研发奠定科学基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
新鲜牛乳:每隔1 d从锡林郭勒盟溪沐力克乳品有限公司采集同一种群奶牛的三个批次新鲜牛乳(A、B、C),三个批次新鲜牛乳的感官、理化及微生物指标检测基本一致,每批次100 kg。
1.1.2 培养基与试剂
MRS培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:北京路桥技术股份有限公司;氢氧化钠、酚酞(均为分析纯):国药集团化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HWS-250BX恒温恒湿培养箱:天津泰斯特仪器有限公司;SW-J-2FD净化工作台:苏州博莱尔净化设备有限公司;Lactoscan LWA乳成分分析仪:杭州麦力斯科技有限公司。
1.3 实验方法
1.3.1 初始奶源质量品质检测
感官指标的测定:将100 kg新鲜牛奶经过滤除杂后,取适量试样置于50 mL烧杯中,在自然光下观察色泽和组织状态,闻其气味,品尝滋味,对其进行色泽、风味、组织状态等感官指标评价[18]。
理化指标的测定:采用酸度计直接测定样品pH值;参照国标GB 5009.239—2016《食品安全国家标准食品酸度的测定》[19]中的方法测定酸度;利用乳成分分析仪测定蛋白质、脂肪、乳糖、非脂乳固体等理化指标[20-21]。
微生物指标的测定:参照GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》[22]对初始奶源乳酸菌进行计数;参照GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》[23]对初始奶源酵母菌进行计数。
将连续3个批次(A、B、C)均符合GB 19301—2010《食品安全国家标准 生乳》[18]中感官、理化要求,并且检测的微生物指标(乳酸菌与酵母菌)基本一致的牛乳作为后续自然发酵的原料乳。
1.3.2 自然发酵牛乳样品的采集
将符合上述检测指标的新鲜牛乳倒入敞开式发酵池中,环境温度控制在(20±1)℃条件下,自然发酵72 h,每隔8 h取样一次,连续采集10次,现场测定pH值和温度,并将样品装入无菌采样袋中4 ℃低温保存,尽快送回实验室进行乳酸菌和酵母菌计数。
1.3.3 自然发酵牛乳样品中乳酸菌和酵母菌计数
取1 mL采集的新鲜自然发酵牛乳样品加入到含9 mL 0.85%生理盐水的试管内,进行梯度稀释,选取3个适宜的梯度,涂布于MRS培养基和PDA培养基。将MRS平板倒置于37 ℃恒温培养箱中,厌氧培养3 d;PDA平板正置于28 ℃恒温培养箱中,培养5 d。参照方法1.3.1对自然发酵牛乳样品中的乳酸菌和酵母菌进行计数。
1.3.4 统计分析
每批次样品的理化指标检测与乳酸菌和酵母菌计数结果均重复测定3次,采用SPSS 20.0分析软件进行数据分析。利用单因素方差分析与t检验方法,在α=0.05显著水平下进行统计分析。
2 结果与分析
2.1 初始奶源质量品质检测结果
通过对初始新鲜牛奶的感官评价、理化及微生物指标检测,以保证牛乳来源的质量品质,从而排除奶源对后续自然发酵试验条件的影响。感官评价结果显示,连续三个批次的新鲜牛乳色泽均为乳白色,有固有的乳香味,无异味,组织状态均匀一致,无凝块及沉淀。故三个批次的牛乳感官评价相一致,符合奶源一致性要求。其理化指标检测结果见表1,微生物指标检测结果见表2。

表1 初始奶源理化指标检测结果Table 1 Determination results of physicochemical indexes of initial milk

表2 初始奶源微生物指标检测结果Table 2 Determination results of microbial indexes of initial milk
由表2可知,三个批次初始牛乳样品(A、B、C)的pH值、酸度、蛋白质、乳糖、非脂乳固体含量均无显著差异(P>0.05),C批次初始牛乳脂肪含量显著高于A与B批次(P<0.05),而A批次与B批次牛乳脂肪含量差异不显著(P>0.05)。其中脂肪、蛋白质及非脂乳固体含量均符合GB 19301—2010《食品安全国家标准生乳》[18](脂肪≥3.1%,蛋白质≥2.8%,非脂乳固体≥8.1%)中要求。由于pH值和酸度能够间接反映牛乳的发酵程度,因此,对于初始奶源中pH值和酸度的检测对描述初始牛乳发酵程度具重要意义。连续三批次初始牛乳样品(A、B、C)的pH值和酸度均无显著差异(P>0.05),从而推测奶源处于同一初始发酵程度。
由表2可知,三个批次初始牛乳样品(A、B、C)中乳酸菌活菌数经无显著差异(P>0.05);而对于酵母菌活菌数,A批次初始牛乳显著高于B与C批次(P<0.05),而B批次与C批次牛乳差异不显著(P>0.05),这可能与三批次初始牛乳样品来自同一个牧场的奶源有关。由此可知,三批次初始牛乳间的乳酸菌数和酵母菌整体波动范围较小,可作为三次独立材料用于后续自然发酵试验。
2.2 自然发酵牛乳温度与pH变化情况
2.2.1 自然发酵牛乳温度的变化
传统发酵牛乳的制作工艺是将新鲜牛奶不经过杀菌处理,直接过滤除杂后放入干净容器中,静置在蒙古包或室内的阴凉处自然发酵,发酵温度在20 ℃左右,发酵时间为夏季1~2 d,冬季3~4 d[24-25]。在自然发酵的后期,乳脂会随着发酵环境的变化富集在表层形成白色稠状物质,即为奶嚼口(民族传统乳制品),而酪蛋白经蛋白酶水解与水形成下层凝乳[26-27]。本实验利用空调设备将外部环境温度维持在(20±1)℃,通过对不同发酵时期样品的发酵温度进行测定,来监控温度对其发酵情况的影响,其结果见图1。
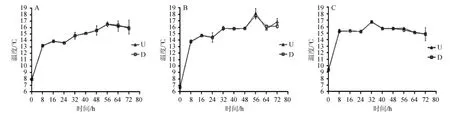
图1 自然发酵牛乳发酵过程中发酵温度的变化Fig.1 Changes of fermentation temperature during naturally fermented milk fermentation process
由图1可知,三个批次牛奶样品的初始温度平均值为(8.03±1.31)℃,随后样品的温度逐渐上升并基本维持在16 ℃左右,其中上层奶嚼口和下层凝乳样品的温度变化基本一致。因此,推断模拟牛乳自然发酵状态下,环境温度基本保持在同一波动幅度,对发酵牛乳中微生物的生长变化影响较小。
2.2.2 自然发酵牛乳pH值的变化
pH值对微生物的生命活动有很大的影响,而微生物对pH条件的不同要求在一定程度上反映出微生物对环境的适应能力。本实验对牛乳不同发酵时间阶段牛乳的pH值进行监测,结果见图2。

图2 自然发酵牛乳发酵过程中pH值的变化Fig.2 Changes of pH during naturally fermented milk fermentation process
由图2可知,三批次牛奶样品发酵过程中pH值的变化趋势基本一致,在发酵前32 h时,pH值下降不明显,平均pH值只降低了0.29±0.085,随后pH值呈快速下降趋势,当pH值下降至5左右时,发酵牛乳开始出现分层现象,乳脂不断上浮形成上层的奶嚼口,而下层乳基随着pH值不断下降,当pH值下降至4.6左右时,逐渐形成下层凝乳。并且奶嚼口在不同发酵阶段的pH值明显低于下层凝乳,因此,推测奶嚼口和下层凝乳中微生物生长变化存在一定的差异,具体还需对乳酸菌与酵母菌的计数进行验证。
通过上述三批次自然发酵牛乳中pH值变化均呈先缓慢下降后快速下降的趋势,推测这与发酵牛乳酸凝乳过程有关。牛乳中酪蛋白常以酪蛋白-磷酸钙复合体形式存在于牛乳溶胶中,酸凝乳方式则是利用乳酸菌发酵分解乳糖产酸或添加食用酸使原乳pH值下降从而诱导酪蛋白胶束聚集,逐渐形成凝乳[28]。通过对发酵牛乳中温度及pH值变化的研究表明,在(20±1)℃的自然发酵温度下,持续发酵56 h后,发酵牛乳的pH值下降至pH 4.6~5.0时,发酵牛乳会出现分层并形成上层奶嚼口和下层凝乳。
2.3 自然发酵牛乳中乳酸菌和酵母菌的动态变化
一般微生物的生长繁殖有一定规律性,典型的可分为延迟期、对数期、稳定期和衰亡期4个阶段[29]。本实验对不同发酵阶段的乳酸菌和酵母菌分别进行活菌计数,用以研究自然发酵牛乳中微生物的生长动态变化,结果见图3。

图3 自然发酵牛乳发酵过程中乳酸菌和酵母菌数的变化Fig.3 Change of lactic acid bacteria and yeast counts during naturally fermented milk fermentation process
由图3可知,综合评价三批次自然发酵牛乳发酵过程中乳酸菌和酵母菌的活菌动态变化后发现,乳酸菌的生长变化趋势与微生物生长所具有的延迟期、对数期、稳定期三个典型阶段相类似。在生长初期有近16 h的缓慢生长阶段,随后进入快速增长阶段,乳酸菌数不断增加。酵母菌的生长与乳酸菌相比,并没有出现明显的快速增长阶段,在生长初期呈平稳上升趋势,在发酵24~32 h时达到第一次生长峰值,随即生长逐渐下降,而此时乳酸菌正处于快速生长阶段。因此,推测在乳酸菌处于快速增长阶段时,酵母菌呈先增高后下降的现象可能是由于自然发酵过程中乳酸菌和酵母菌在开始表现出协同关系,随着乳酸菌的快速生长而抑制酵母的增多。例如有研究者报道乳酸菌和酵母菌混合培养的抑制作用表现在乳酸菌产生的代谢产物如苯乳酸、4-羟基-苯乳酸、环肽类物质抑制了酵母菌的生长[30]。
随着发酵时间的延长,当发酵牛乳出现分层现象后,上层奶嚼口和下层凝乳中的乳酸菌和酵母菌的生长又呈现不同的变化。三个批次奶嚼口和下层凝乳中乳酸菌和酵母菌活菌数见表3。
由表3可知,在发酵牛乳分层后的56 h、64 h、72 h三个发酵阶段,上层奶嚼口和下层凝乳中乳酸菌的平均活菌数分别为(12.02±1.21)lg(CFU/mL)、(11.54±1.30)lg(CFU/mL),两者间两者间没有显著差别(P>0.05);而上层奶嚼口和下层凝乳中酵母菌平均活菌数分别为(6.39±0.60)lg(CFU/mL)、(4.56±0.30)lg(CFU/mL),上层奶嚼口显著高于下层凝乳中的酵母菌平均活菌数(P<0.05)。此结果恰能说明由图2中奶嚼口的pH值明显低于下层凝乳推测奶嚼口和下层凝乳中微生物生长变化存在一定的差异的假设。对于上层奶嚼口中酵母菌数量增加的情况推测可能原因是上层奶嚼口暴露在空气中形成了高脂和高溶氧的环境促进了酵母菌的生长。如有学者认为酵母菌对脂肪酸的水解能力较强,并且分解脂肪产生出的游离脂肪酸可能会抑制乳酸菌的生长[31]。
乳品的自然发酵过程非常复杂,涉及微生物和生化变化。FOX P F等[32]研究奶酪的成熟过程发现,微生物的成熟包括初始发酵细菌的死亡和自溶,不定菌群(非发酵乳酸菌)的生长和继发微生物群生长。在奶酪成熟过程中,首先是起始细菌快速繁殖,在奶酪菌群中占主导地位,但大多数细菌都会很快死亡和裂解,并释放肽酶等多种细胞内酶,与凝乳酶一起将酪蛋白水解为肽和氨基酸,为后续菌群的生长提供营养物质。而非发酵乳酸菌多为异发酵乳杆菌和专一性异源发酵乳杆菌,继发微生物群多涉及短杆菌、微球菌、酵母菌和霉菌等,它们常常一起参与奶酪的成熟过程。因此,自然发酵牛乳微生物的生长中不仅受群落内部物种间交互作用的影响,还受到环境和空间因素对多样性的影响,整体处于动态变化的过程。
3 结论
本实验对自然发酵牛乳中乳酸菌和酵母菌的活菌动态变化分析表明,在(20±1)℃的自然发酵温度下,持续发酵56 h后,pH值下降至4.6~5.0范围时,自然发酵牛乳出现分层并形成上层奶嚼口和下层凝乳;其中奶嚼口和凝乳中乳酸菌的活菌数无显著差异(P>0.05),而凝乳中酵母菌活菌数显著低于奶嚼口(P<0.05)。乳酸菌的生长具有延迟期、对数期、稳定期三个典型阶段,酵母菌并没有典型的对数期增长;在自然发酵过程中乳酸菌和酵母菌开始表现出协同关系,随着乳酸菌的生长反而抑制酵母菌的增多。通过模拟自然状态下牛乳的发酵条件,初步分析了乳酸菌和酵母菌的动态生长变化和相互作用,将有助于为下一步富含乳酸菌和酵母菌的功能发酵乳的研发奠定科学基础。

