IL-1β通过抑制AKT下调人脐静脉内皮细胞eNOS Ser1177磷酸化水平*
罗明昊 , 胡舒鹏 , 王瑞钰 , 李 畅 , 吕鼎一 , 杨茜洋 , 罗素新
(1重庆医科大学附属第一医院心血管内科,2重庆医科大学生命科学研究院,重庆400016)
血管内皮作为循环血液与内皮下组织的屏障,在调节血管通透性与免疫炎症反应方面具有关键性作用[1]。血管内皮细胞中的内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)产生的一氧化氮(nitric oxide,NO)含量的异常会导致内皮功能障碍,这在糖尿病、动脉粥样硬化以及脓毒血症等血管炎症性病变的早期发病机制中尤为重要[2-3]。血管的内皮功能障碍主要机制之一为eNOS Ser1177磷酸化位点被抑制[4-6]。蛋白激酶B(protein kinase B,PKB/AKT)是使eNOS Ser1177 磷酸化的上游关键性调节激酶,AKT 功能增强可以激活eNOS,增加NO合成[7]。
炎症细胞因子,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素 1β(interleukin-1β,IL-1β)、IL-6等在体内体外条件下都对血管内皮具有损伤作用。IL-1主要是由活化的单核-巨噬细胞产生的关键性促炎细胞因子,是体内作用最强的炎症介质之一,可分为IL-1α(细胞膜型)和IL-1β(分泌型)[8]。IL-1β为血液循环中存在的主要形式,其生物学作用非常广泛,能介导多种炎症反应,能够诱导下游几百种二级炎症因子的合成与表达,进而对炎症起促进和放大的效应[9]。目前尚不清楚 IL-1β 如何参与调控血管内皮细胞eNOS 磷酸化。本研究以体外培养的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为实验对象,探讨炎症因子IL-1β 刺激对血管内皮细胞eNOS Ser1177 磷酸化的影响及其可能的相关机制。
材料和方法
1 细胞提取与培养
实验细胞为HUVECs,脐带的来源为重庆医科大学附属第一医院妇产科,选用胶原酶消化法,收集的细胞在M199 培养液[含有20%胎牛血清、20 mg/L内皮细胞生长补充剂(endothelial cell growth supplement,ECGS)、100 mg/L 肝素、2 mmol/L L-谷氨酰胺和1%青-链霉素]、CO2恒温培养箱(37℃、饱和湿度、5%CO2)中培养,倒置显微镜下观察细胞情况。选取第6~10 代细胞,增殖至80%左右时更换培养液后进行实验。细胞鉴定按本课题组先前的报道[10]进行。此研究经重庆医科大学附属第一医院伦理委员会批准,并取得所有涉及此项研究患者的同意。
2 实验试剂与抗体
人重组TNF-α、人重组IL-1β 和人重组IL-6(Sigma-Aldrich);AKT 特异性激动剂SC79(MedChemExpress);RIPA裂解液、BCA蛋白浓度测定试剂盒和总NO 检测试剂盒(Beyotime Biotechnology);抗eNOS、peNOS-Ser1177、AKT和p-AKT-Ser473 抗体(Cell Signaling Technology);羊抗兔Ⅱ抗(Proteintech);其它相关但未提及化合物均购于Sigma或Sangon Biotech。
3 方法
3.1 实验分组与实验条件 将HUVECs 随机分为对照组(control)组、TNF-α 处理组(10 μg/L TNF-α 处理1 h)、IL-1β 处理组(0.1、1、10 和100 μg/L IL-1β 处理 1 h,或者 1 μg/L IL-1β 处理 0.5、1、2和4 h)、IL-6处理组(50 μg/L IL-6 处理1 h)、单纯SC79 处理组(5 μmol/L 处理 1 h)和 SC79+IL-1β 处理组(5 μmol/L SC79预处理1 h后1 μg/L IL-1β处理1 h)。药物处理浓度均为细胞培养液中的终浓度,参考相关文献[10-15]选取。
3.2 Western blot 冰上裂解60 min 提取HUVECs总蛋白,BCA 法测定蛋白浓度。每孔蛋白上样量为30 μg,选用10%分离胶进行SDS-PAGE 后(浓缩胶80 V,分离胶120 V),100 V 100 min 湿转至PVDF 膜上。室温下用3%~5%脱脂奶粉溶液封闭1 h,分别加入相应Ⅰ抗[抗eNOS 抗体(1∶2 000 稀释)、抗peNOS-Ser1177 抗体(1∶1 000 稀释)、抗 AKT 抗体(1∶2 000 稀释)、抗 p-AKT-Ser473 抗体(1∶1 000 稀释)]4℃孵育过夜。Ⅱ抗(1∶10 000 稀释)孵育1 h 后,TBST 洗 3 次,每次 10 min。ECL 化学发光显色,条带用Image Lab 6.0 进行灰度值分析,以磷酸化蛋白与总蛋白灰度值的比值表示磷酸化水平的高低。
3.3 NO 含量检测 收集各组HUVECs 培养液,按照总NO 检测试剂盒步骤进行操作,检测样品中的硝酸盐与亚硝酸盐含量推算出总NO 的量。通过比色法在全波长酶标仪上测定吸光度(A),根据标准品测得标准曲线,将待测品A值代入标准曲线公式算得培养液中NO含量。
4 统计学处理
所有的实验数据来源于至少3 次独立实验结果,所得数据用均数±标准差(mean±SD)表示。采用GraphPad Prism 8.0 软件统计并作图。多组间均数比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 TNF-α、IL-1β和IL-6 处理 HUVECs 后 p-eNOSSer1177蛋白水平的变化
与对照组相比,IL-1β 干预 HUVECs 1 h 后 peNOS-Ser1177 蛋白水平显著下降(P<0.05),而TNF-α和IL-6 处理 HUVECs 1 h 后 p-eNOS-Ser1177 蛋白水平与对照组相比差异均无统计学意义(P>0.05),见图1。
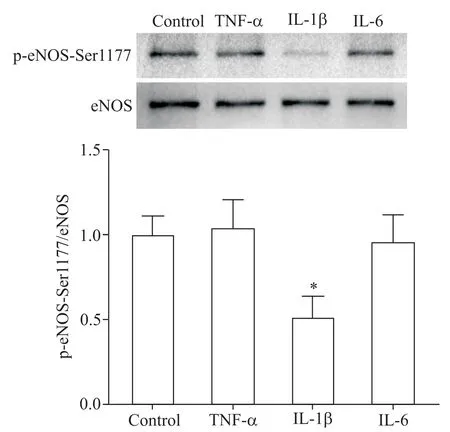
Figure 1.HUVECs were treated with TNF-α(10 μg/L),IL-1β(10 μg/L)and IL-6(50 μg/L)for 1 h,and the protein level of p-eNOS-Ser1177 in the HUVECs was detected by Western blot.Mean±SD. n=5. *P<0.05 vs control group.图1 TNF-α、IL-1β和IL-6 对 HUVECs 中 p-eNOS-Ser1177蛋白水平的影响
2 不同浓度的IL-1β 处理HUVECs 后p-eNOSSer1177蛋白水平的变化
用不同浓度(0.1、1、10 和100 μg/L)的IL-1β 处理HUVECs 1 h,结果显示,与对照组相比,1、10 和100 μg/L 浓度处理组的 p-eNOS-Ser1177 蛋白水平均显著降低(P<0.05),见图2。
3 IL-1β处理HUVECs不同时间后p-eNOSSer1177蛋白水平的变化
用IL-1β(1 μg/L)处理HUVECs 0.5、1、2 和4 h,结果显示,与对照组相比,1、2 和4 h 处理组的peNOS-Ser1177 蛋白水平均显著降低(P<0.05),见图3。
4 IL-1β处理HUVECs不同时间后培养液中NO含量的变化
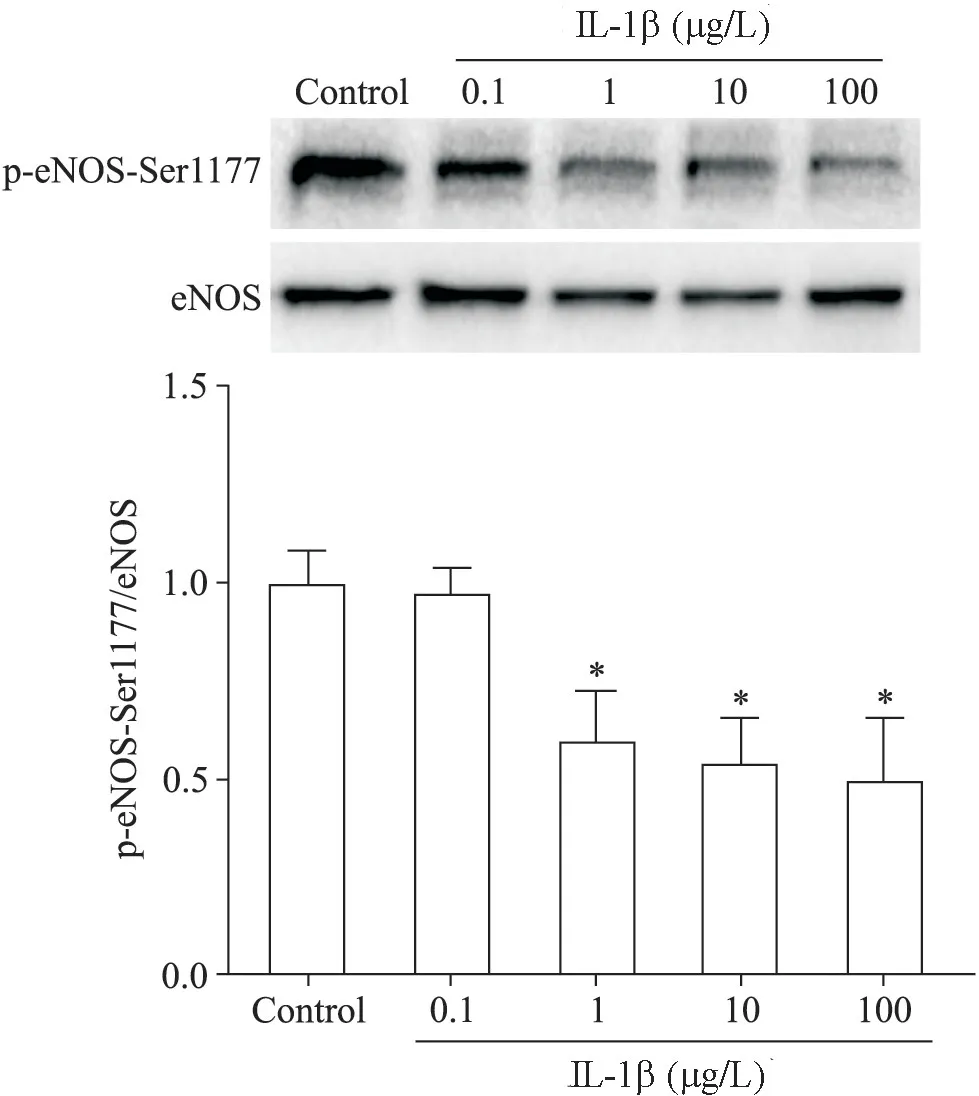
Figure 2 HUVECs were treated with 0.1,1,10 and 100 μg/L IL-1β for 1 h,and the protein level of p-eNOSSer1177 in the HUVECs was detected by Western blot.Mean±SD. n=5.*P<0.05 vs control group.图2 不同浓度的IL-1β 处理HUVECs 后p-eNOS-Ser1177蛋白水平的变化

Figure 3.HUVECs were treated with IL-1β(1 μg/L)for 0.5,1,2 and 4 h,and the protein level of p-eNOSSer1177 in the HUVECs was detected by Western blot.Mean±SD. n=5. *P<0.05 vs control group.图3 IL-1β 处理 HUVECs 不同时间后 p-eNOS-Ser1177 蛋白水平的变化
用IL-1β(1 μg/L)处理HUVECs 0.5、1、2 和4 h,结果显示,1、2 和4 h 处理组培养液中NO 含量较对照组均显著降低(P<0.05),见图4。

Figure 4.HUVECs were treated with IL-1β(1 μg/L)for 0.5,1,2 and 4 h,and the content of NO in the medium was detected by chemical colorimetry.Mean±SD. n=5. *P<0.05 vs control group.图4 IL-1β 处理HUVECs 不同时间后培养液中NO 含量的变化
5 IL-1β 处理 HUVECs 不同时间后 p-AKT-Ser473蛋白水平的变化
用IL-1β(1 μg/L)处理HUVECs 0.5、1、2 和4 h,结果显示,0.5、1、2 和4 h 处理组p-AKT-Ser473 蛋白水平均较对照组显著下降(P<0.05),见图5。
6 SC79预处理对IL-1β调节HUVECs 中 p-eNOSSer1177蛋白水平的影响
SC79 能显著阻断 IL-1β 对 HUVECs 中 p-eNOSSer1177 蛋白水平的下调作用(P<0.05),单纯SC79组p-eNOS-Ser1177 水平与对照组比较差异无统计学意义(P>0.05),见图6。
7 SC79预处理对IL-1β调节HUVECs 培养液中NO含量的影响
SC79能显著阻断IL-1β对HUVECs培养液中NO含量的下调作用(P<0.05),单纯SC79 组细胞培养上清中的NO含量与对照组比较差异无统计学意义(P>0.05),见图7。
讨 论
体外实验中HUVECs 已被广泛用于血管内皮细胞相关的研究[5-6],而本研究使用的HUVECs 已经Ⅷ因子和CD31 的荧光染色实验验证为高纯度(≥95%)的内皮细胞[10]。
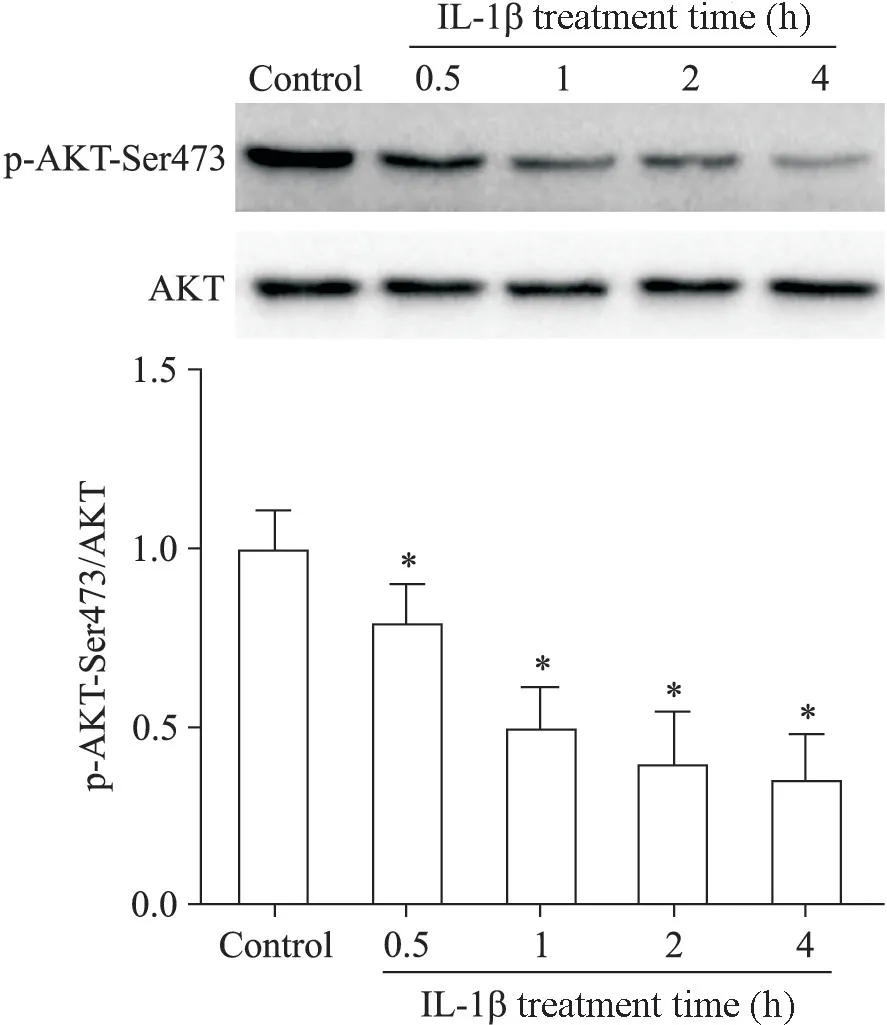
Figure 5.HUVECs were treated with IL-1β(1 μg/L)for 0.5,1,2 and 4 h,and the protein level of p-eNOSSer1177 in the HUVECs was detected by Western blot.Mean±SD. n=5. *P<0.05 vs control group.图5 IL-1β 处理 HUVECs 不同时间后 p-AKT-Ser473 表达水平的变化
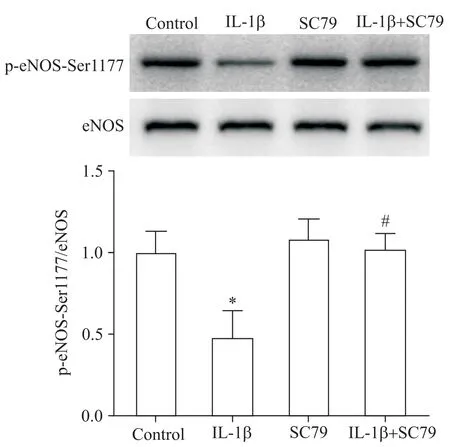
Figure 6.HUVECs were pretreated with AKT agonist SC79(5 μmol/L)1 h before IL-1β(1 μg/L)treatment,and the protein level of p-eNOS-Ser1177 in the HUVECs was detected by Western blot.Mean±SD. n=5. *P<0.05 vs control group;#P<0.05 vs IL-1β group.图6 SC79预处理对IL-1β调节HUVECs 中 p-eNOSSer1177蛋白水平的影响
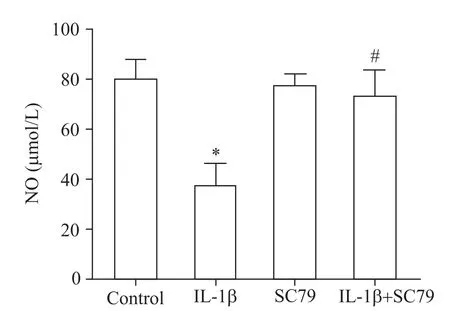
Figure 7.HUVECs were pretreated with AKT agonist SC79(5 μmol/L)1 h before IL-1β(1 μg/L)treatment,and the content of NO in the medium was detected by chemical colorimetry.Mean±SD. n=5.*P<0.05 vs control group;#P<0.05 vs IL-1β group.图7 SC79预处理对IL-1β 调节HUVECs培养液中NO 含量的影响
IL-1β 可通过调控 NF-κB 导致 HUVECs 中 eNOS蛋白表达量减少[11],还可以使人内皮细胞系ISOHAS 细胞 eNOS mRNA 的表达量降低[16];还有研究报道IL-1β 可使视网膜内皮细胞eNOS 蛋白表达量下降[17]。eNOS 功能的调控可以发生在基因的转录、转录后修饰、翻译、翻译后修饰和蛋白质之间的相互作用等多个层面[2]。但目前的研究多集中于解释IL-1β 如何使内皮细胞eNOS启动子活性降低(转录调节)和影响mRNA 稳定性(转录后调节)从而调控eNOS 的蛋白总量,而IL-1β 是否影响以及如何影响eNOS 的磷酸化位点国内外尚无报道。靠近eNOS 羧基端的Ser1177 位点是激活eNOS 功能一个关键的调控位点,在研究中常作为eNOS 活性的检测位点。本研究发现IL-1β 能浓度依赖性及时间依赖性地下调p-eNOS-Ser1177 蛋白水平,进而抑制eNOS 的活性,使NO 生成减少。已有大量文献证实各种血管炎性病变中内皮功能障碍的主要表现为eNOS 的Ser1177 位点磷酸化被抑制导致的NO 生成减少,具体是哪种炎症因子起关键作用文献报道不一[4]。本研究中用 TNF-α 与 IL-6 干预 HUVECs,但p-eNOS-Ser1177 蛋白水平均无显著变化,进一步证明在炎症因子中IL-1β 对该位点的特异性。有相关动物研究报道,使用IL-1β 抑制剂可以显著提高脓毒血症小鼠生存率[18];也有文献报道,IL-1β 参与了醛固酮介导的小鼠血管内皮舒张受损[19]。本研究通过体外实验提示,IL-1β 可能通过抑制eNOS 的Ser1177 位点磷酸化而参与了血管内皮功能障碍,在一定程度上解释了IL-1β 在血管炎性病变早期中的作用。
作为eNOS 关键上游蛋白,AKT 已被证明可通过激活eNOS 显著增强血管舒张,其过度表达导致静息血管直径和血流量显着增加,而AKT 的功能被抑制则减弱了乙酰胆碱对内皮依赖性血管舒张的反应[20]。AKT 在参与高血压的内皮功能障碍中也发挥重要作用[21]。本实验观察到 IL-1β 干预 HUVECs 后AKT 的Ser473 磷酸化水平下降且早于p-eNOSSer1177 的下降,激活AKT 功能可恢复eNOS 活性。这一结果提示AKT 活性被抑制是IL-1β 导致peNOS-Ser1177 蛋白水平降低及eNOS 活性降低的可能机制。IL-1β致使AKT活性下降的分子机制如何,本研究尚未完全阐明。本实验没有检测AMP 活化蛋白激酶、蛋白激酶A 等其他eNOS 上游蛋白表达,无法确定这些蛋白功能的变化是否也参与IL-1β 下调p-eNOS-Ser1177 的过程。此外,本实验主要研究eNOS Ser1177 磷酸化水平的变化,而对于 IL-1β 是否影响eNOS 的其他磷酸化位点如Thr495 位点或Ser633位点,还需要深入探讨。
综上所述,IL-1β 可能通过AKT 通路下调peNOS-Ser1177 蛋白水平,从而抑制eNOS 的活性;而AKT 特异性激动剂可使eNOS 活性恢复,进而起到保护血管内皮功能的作用。

