尼氟灭酸抑制人脑胶质瘤U87细胞活力、迁移及侵袭*
崔万丽, 石雨淑雅, 蔡欣池, 田 晶△
(吉林医药学院 1生理学教研室,22016级临床医学教改班,吉林吉林132013)
尼氟灭酸(niflumic acid,NFA)是一种常用的解热镇痛药,经常用于痛经、类风湿关节炎和骨关节炎的治疗,通过抑制环氧合酶2(cyclooxygenase-2,COX-2)发挥作用;同时,它也可以特异性阻断氯通道[1],影响细胞的增殖[2]和凋亡[3]等。胶质瘤是颅内最常见的肿瘤,其极强的侵袭性是导致胶质瘤术后复发率高的主要原因之一[4]。报道显示恶性胶质瘤高表达COX-2[5],也有报道胶质瘤的恶性程度与氯通道数量呈正相关[6-8],而NFA 对胶质瘤的作用尚不清楚。本研究观察氯通道阻断剂NFA 对人胶质瘤U87细胞活力、迁移和侵袭的作用,并初步探讨其作用机制,为临床治疗提供参考资料。
材料和方法
1 细胞株、主要试剂和仪器
人胶质瘤U87 细胞株由吉林大学第一医院神经外科提供。NFA和MTT购自Sigma;胰蛋白酶和小牛血清购自Gibco;二甲基亚砜(dimethyl sulfoxide,DMSO)购自 Thermo。NFA 用 DMSO 配制成浓度为0.1 mol/L 的原液备用,于4℃保存,实验时再用培养液稀释至所需浓度。CB150 型CO2培养箱为Binder公司产品;CA92121 型实时无标记细胞分析(realtime cell analysis,RTCA)仪DP 系统为杭州艾森生物有限公司产品。
2 方法
2.1 细胞培养和分组 自液氮罐中取出冻存的U87 细胞,37℃水浴振荡溶解,用含10%小牛血清的DMEM 培养液混匀后置于75 cm2培养瓶中,于37℃、5% CO2及饱和湿度条件下进行培养,隔日换液,隔2~3 d 传代1 次,取生长状态良好处于对数生长期的U87细胞随机分为对照组和不同浓度NFA处理组。
2.2 MTT 法检测U87 细胞活力 取对数生长期的U87 细胞,0.25%胰酶消化后,用含5%小牛血清的DMEM 培养液重悬细胞,调整细胞浓度为5×107/L。将细胞均匀接种于96 孔板中,每孔100 μL,置入37℃、5% CO2细胞培养箱中进行培养。24 h 后加入NFA(终浓度分别为0、25、50、100和200 μmol/L),每个浓度5 个复孔,分别作用12、24 和48 h,每孔再加入MTT溶液20 μL,继续孵育4 h,弃上清后每孔加入DMSO 150 μL,振荡15 min,全自动酶标仪 490 nm 波长处测定各孔吸光度(A)值,并计算细胞相对活力。细胞相对活力(%)=实验组A值/对照组A值×100%。
2.3 RTCA 法检测细胞迁移[9]迁移侵袭检测板下室的孔中加入165 μL 含10%小牛血清的培养基,上室中加入30 μL 无血清培养基,轻拍板四周,使培养基分布均匀,置于37℃、5%CO2细胞培养箱平衡1 h。将测好基线的检测板取出,在上室孔中加入100 μL混合均匀的无血清细胞悬液,使每孔中细胞数目分别为5×104个。检测板置于超净台中室温放置30 min 后,放到培养箱中的RTCA Station 上,系统自动扫描后,间隔15 min 测量细胞指数一次,共检测72 h。细胞迁移曲线由RTCA 仪自动生成,采取12、24、48 和72 h 4 个时点细胞指数的后台数据计算细胞迁移率。细胞迁移率(%)=实验组细胞指数/对照组细胞指数×100%。
2.4 RTCA 法检测细胞侵袭[9]实验前将基质胶从-80℃移至4℃融化。用预冷的无血清培养基按1∶40稀释基质胶,冰上操作,以防基质胶凝固。先在迁移侵袭检测板上室中加入50 μL稀释好的基质胶,再吸出 30 μL 的基质胶,孔中留 20 μL 的基质胶包被检测板上室。放置在37℃中至凝固,凝固时上室置于检测板夹具上,保证悬空不触及电极。下室孔中加入160 μL 含10%小牛血清的DMEM 培养基,在上室放入30 μL 的无血清培养基,将装置置于37℃、5%CO2细胞培养箱平衡1 h。将培养好的细胞取出后,进行消化、离心,无血清培养基配制成需要的细胞浓度。上室孔中加入100 μL 混合均匀的无血清细胞悬液,每孔中细胞数为5×104个。将检测板置于超净台中室温放置30 min 后,放在培养箱中的RTCA Station上,系统自动扫描后,间隔15 min 检测一次细胞指数,共检测72 h。细胞侵袭曲线由RTCA 仪自动生成,采取 12、24、48和72 h 4 个时点细胞指数的后台数据计算细胞侵袭率。细胞侵袭率(%)=实验组细胞指数/对照组细胞指数×100%。
3 统计学处理
采用SPSS 17.0 软件进行统计分析。细胞相对活力、细胞迁移率及细胞侵袭率的数据均呈正态分布,以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05 为差异有统计学意义。
结 果
1 U87细胞的活力
NFA 作用胶质瘤 U87 细胞 12 h 后,与空白对照组比较,各浓度组细胞活力均增强(P<0.05 或P<0.01);与空白对照组比较,NFA 作用 24 h 后,100 和200 μmol/L NFA 组细胞活力显著降低(P<0.05);NFA 作用 48 h 后,50、100和200 μmol/L NFA 组细胞活力均显著降低(P<0.05或P<0.01),并呈现浓度依赖性,见表 1。由于 100和200 μmol/L NFA 组细胞活力受到显著抑制,因此后续研究采用这两个浓度进行干预。
2 各组U87细胞的迁移情况
RTCA 检测结果表明,各组U87 细胞均发生迁移。与空白对照组比较,12 h 时 200 μmol/L NFA 组细胞迁移率就显著降低(P<0.05),24 h 后更加显著(P<0.01),100 μmol/L NFA 组在48 h 后细胞迁移率显著降低(P<0.01),200 μmol/L NFA 组细胞迁移率低于100 μmol/L NFA 组(P<0.01),具有一定的浓度依赖性,见图1及表2。

表1 各组U87细胞活力Table 1.The viability of the U87 cells in various groups(%.Mean±SD. n=5)
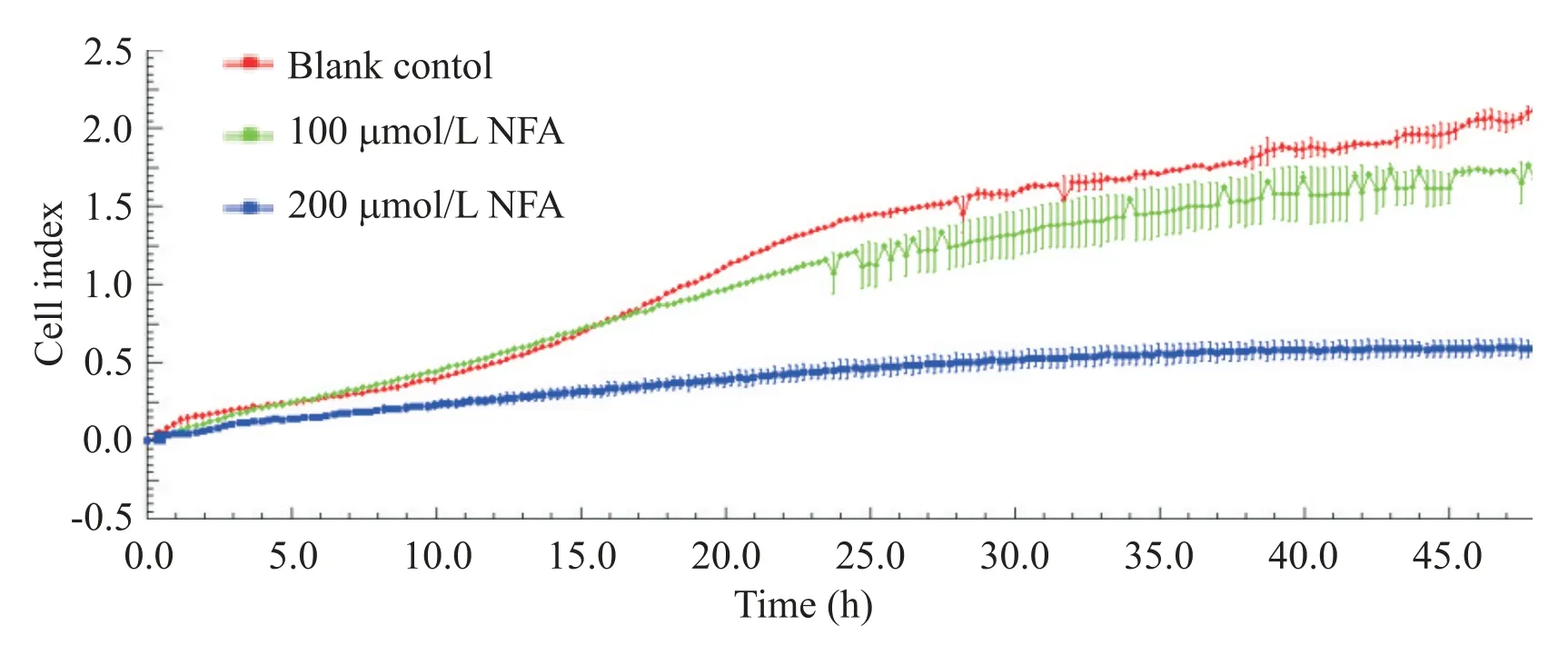
Figure 1.Migration curves of the U87 cells.图1 U87细胞迁移曲线
3 各组U87细胞的侵袭情况
RTCA 结果表明,各组U87 细胞均可以穿过基质胶发生侵袭,与对照组相比,48 h 时 100和200 μmol/L NFA 组细胞侵袭率显著降低(P<0.05 或P<0.01),200 μmol/L NFA 组细胞侵袭率低于 100 μmol/LNFA组(P<0.01),见图2及表3。

Figure 2.Invasion curves of the U87 cells.图2 U87细胞侵袭曲线

表3 各组U87细胞的侵袭率Table 3.Invasive rates of the U87 cells in different groups(%.Mean±SD. n=3)
讨 论
根据组织病理学的特征胶质瘤分为4 级,Ⅰ和Ⅱ级为低级别胶质瘤,这两型分化好,相对良性,5年生存率可达59.9%[10-11];Ⅲ和Ⅳ级为高级别胶质瘤,均为恶性。Ⅳ级胶质瘤又称胶质母细胞瘤,它具有高度增殖性和侵袭性,且易复发、预后差,两年生存率可低至3.3%[10-11]。胶质瘤的侵袭能力强导致其易复发,是影响其预后的主要因素。COX-2 在恶性胶质瘤表达增加并与患者生存期缩短有关[5]。COX-2受表皮生长因子受体信号转导的调控,通过诱导转录调控因子 Id1 增强 GBM 细胞的恶性程度[5]。肿瘤细胞在增殖、迁移和侵袭前都有容积的变化。当细胞处于低渗环境时,位于胞膜上的容积激活性钾通道与氯通道会开放,通过K+和Cl-的外流,带动水的流出,可使细胞体积变小,这一过程称为调节性容积减小(regulatory volume decrease,RVD)。RVD 在细胞增殖、分化、凋亡和迁移等过程中非常重要。在胶质瘤细胞,RVD 功能尤其强大。研究表明,正常脑细胞内Cl-浓度约6~10 mmol/L,由于胶质瘤高表达Na+-K+-2Cl-转运体1 使细胞内Cl-浓度可高达80~100 mmol/L,具有明显的外流趋势[12]。胶质瘤细胞内Cl-或者K+通过离子通道或转运蛋白外流,从而带动水的外流,使细胞容积变小,使胶质瘤能够穿过狭窄的缝隙,发生迁移[12]。
据报道,长期使用非甾体抗炎药可降低结直肠癌、乳腺癌、肺癌、前列腺癌、膀胱癌、卵巢癌、食道癌和胃癌的发病率[13],能诱导多种肿瘤细胞的凋亡并抑制迁移[13]。NFA 作为一种非甾体抗炎药,近年来发现能抑制多种肿瘤细胞的增殖[2]。大多数非甾体抗炎药对COX-1和COX-2有较强的抑制作用。抑制COX-2 可以抑制肿瘤的血管生成并促进凋亡[14]。然而,非甾体抗炎药的抗肿瘤作用可能不仅是通过抑制COX-2 活性来介导的。因为,首先非甾体抗炎药诱导细胞凋亡的浓度明显高于COX-2抑制所需的浓度[15];其次非甾体抗炎药不仅抑制COX-2 表达细胞的生长,而且抑制COX-2 缺陷细胞系的生长[16]。NFA 是COX-2的选择性抑制剂,同时,它也是氯通道的阻断剂,可以特异性地阻断钙激活氯通道、囊性纤维跨膜电导调节体和容量调控氯通道[2]。研究发现多种氯通道阻断剂如NPPB、氯毒素、9-蒽羧酸等都可以抑制肿瘤细胞的增殖[17]。
本研究检测了NFA 对人胶质瘤U87细胞增殖的影响,结果显示NFA在12 h时表现为促进增殖作用,作用24 和48 h 时抑制胶质瘤细胞的增殖。进一步用RTCA 法检测了NFA 对胶质瘤细胞迁移和侵袭的影响,显示100和200 μmol/L NFA 在作用24 h和48 h可以明显地抑制胶质瘤的迁移和侵袭,作用具有时间和剂量依赖性。NFA 对胶质瘤迁移和侵袭的抑制程度大于对细胞增殖的抑制程度,尤其是48 h 更为显著,说明NFA 抑制胶质瘤的迁移和侵袭不是或不仅是通过抑制细胞增殖起作用的。氯通道种类繁多,目前研究倾向于认为,钙激活的氯通道家族中ClC-3参与了胶质瘤细胞的增殖、迁移与侵袭[18]。钙/钙调蛋白依赖的蛋白激酶II(calcium/calmodulin-dependent protein kinase II,CaMKII)可 以激活 ClC-3[18-20]。短期内阻断氯通道,可以使细胞内Ca2+代偿性增多从而促进细胞增殖[21],这可能是NFA 短期作用时促进细胞增殖的原因。胶质瘤细胞缓激肽受体2(bradykinin receptor 2,B2R)的表达量与肿瘤恶性度正相关[21-22]。脑胶质瘤细胞通过血管内皮细胞释放的缓激肽的趋化作用沿血管外壁迁移。抑制氯通道后,缓激肽的趋化作用消失[21-22]。因此推测,缓激肽与B2R 结合,可以引起细胞内Ca2+的增加,通过CaMKII 激活ClC-3 氯电流,从而引起细胞容积变小而发生迁移。NFA 是通过抑制COX-2还是通过阻断ClC-3 抑制细胞增殖、迁移和侵袭,还需要我们进一步研究证实。阻断氯通道可以抑制胶质瘤细胞的增殖、迁移和侵袭,这为胶质瘤的治疗提供了研究方向。

