木犀草素铜配合物的制备及其对DNA的裂解作用研究
臧 昕,王家文,林 悦,杨 昆,李 欢,申贵男,李 婧
(黑龙江八一农垦大学 生命科学技术学院,黑龙江 大庆 163319)
木犀草素(3',4',5,7-Tetrahydroxy Flavone),具有多样的生物化学和药理作用,如抗菌、抗氧化、降血脂及胆固醇等。近期研究发现,金银花、荆芥、菊花等天然中药材中的木犀草素在用作抗病毒药物时,对SARS-CoV-2的主要蛋白酶结合位点具有很高的亲和力[1]。木犀草素在与锌、锰、镁等微量元素形成配合物后,部分生理活性得到明显提升,并具有更加多样的生物特性[2-5]。开发新型木犀草素金属配合物,有利于了解黄酮类化合物与金属的络合形式,研究新型具有生理活性的物质。本实验用木犀草素分别与新戊酸酮、苯甲酸铜进行反应制成铜配合物,分析其化学组成,并研究配合形式及对DNA的裂解能力。
1 实验部分
1.1 实验仪器、药品
样品的红外谱图以KBr为压片材料在Nicolet 380 型红外光谱仪上测得;紫外谱图由Thermo Scientific 紫外分光光度计测得;元素分析在Vario Micro cube上测定,凝胶电泳使用美国BIO-RAD紫外凝胶成像系统进行图谱分析。
琼脂糖购自Spanish公司;pBR322 DNA购自美国Fermentas公司;EB(溴化乙锭)购自北京博奥拓达;木犀草素购自上海贤鼎公司。
1.2 合成步骤
1.2.1 配合物1的合成
木犀草素(4 mmol)充分溶解于10 mL无水乙醇,新戊酸酮(2 mmol)充分溶解于10 mL无水乙醇;将溶液混合并震荡,置于75℃水浴中回流70 min,冷却,过滤,收集沉淀,干燥后即得黑色产物,产率为78.66%。IR(峰值,cm-1):3423 s,1637 m,1590 m,1535 w,1482 s,1350 m,1257 s,809 m。
1.2.2 配合物2的合成
木犀草素(4 mmol)充分溶解于10 mL无水乙醇,苯甲酸酮(2 mmol)充分溶解于10 mL无水乙醇;将溶液混合并震荡,置于75℃水浴中回流70 min,冷却,过滤,收集沉淀,干燥后即得黑色产物,产率为73.35%。IR(峰值,cm-1):3432 s,1630 m,1600 m,1600 s,1534 w,1480 m,1351 m,1256 m,810 m。
1.3 配合物对pBR322 DNA的裂解实验
1.3.1 原料与产物对pBR322 DNA的作用能力
以琼脂糖凝胶电泳法测试木犀草素及其铜配合物对pBR322 DNA的作用效果,并通过美国BIO-RAD紫外凝胶成像系统来分析所得图像。
将木犀草素、新戊酸铜、苯甲酸铜、铜配合物1、铜配合物2充分溶解于 DMSO,调节各样品浓度,使其均为300 μg/mL。向每个EP管中加入1 μL的各样品,接着将6 μL的pH值为7.3的Tris-HCl缓冲溶液加入其中,再滴入1 μL的pBR322 DNA(150 μg/mL),均匀混合,使体积总和为8 μL;同时以1 μL DMSO溶剂代替样品,设置DNA阴性对照组。
将溶液混合均匀,于37℃恒温、避光的环境中水浴反应3 h。待反应时间达到后,将 2 μL的Loading buffer与刚取出的8 μL产物迅速、均匀混合,上样到具有溴化乙锭(1.0 μg/mL)的琼脂糖凝胶板(琼脂糖含量:0.8%)上,在电泳仪中加入配制好的TAE缓冲溶液,在80 V/cm的电压下进行持续电泳。
1.3.2 木犀草素配合物浓度对pBR322 DNA的裂解能力的影响
将配合物1和配合物2的样品,依次稀释为7个质量浓度:300,225 ,150 ,75,37.5 ,18.75,9.38 μg/mL。取1 μL各浓度的样品样品与1μL 的pBR322 DNA(150 μg/mL)作用,操作步骤同上。
2 结果与分析
2.1 木犀草素铜配合物产率分析
将木犀草素与新戊酸酮和苯甲酸铜,分别按照以下6种物质的量比进行反应, 0.5,0.75,1.0,1.5,1.75,2.0,反应中固定木犀草素用量。反应物在乙醇中于75℃恒温水浴中,持续反应70 min,结果如下图1所示。随着物质的量之比不断增加,至比值为1时,两种配合物产率均达到最高,分别为78.66%(配合物1)和73.35%(配合物2),然后反应产率持续下降。因此物质的量之比1∶1为最佳物质的量比。在制备配合物的过程中,其他溶剂如甲醇、乙腈、乙酸乙酯等也用来探索反应,但是实验产品产率均不如在乙醇中好。

图1 不同物质的量之比对产率的影响
2.2 木犀草素铜配合物的化学表征
2.2.1 红外谱图解析
木犀草素与铜配合物1和2的主要红外吸收峰峰值如表1所示。

表1 木犀草素及其铜配合物的主要红外吸收峰归属
与木犀草素相比较,配合物的羰基C=O吸收峰由1655 cm-1移到1637 cm-1和1630 cm-1,分别减少22 cm-1和25 cm-1,说明两配合物中C环上的4-羰基均进行了配位。芳环C=C键由1612 cm-1分别减少至1591 cm-1和1600 cm-1。此外,两配合物于809cm-1和810 cm-1处的特征吸收峰表明均存在金属氧键,证明木犀草素的确与铜离子发生了配位。配合物中双酚羟基C-OH的吸收峰分别下降18 cm-1和17 cm-1,说明双酚结构保存,但由于受配位影响,发生位移。在配合物1中未发现新戊酸根的吸收峰,说明新戊酸根没有参与到配合物的形成,同样苯甲酸根也没有参与配合物的形成。以上分析表明,配合物的结构组成为4-羰基,5-羟基配位铜的配合物。
2.2.2 紫外-可见光谱解析
木犀草素与铜配合物1和2的紫外特征吸收带分布如表2所示。
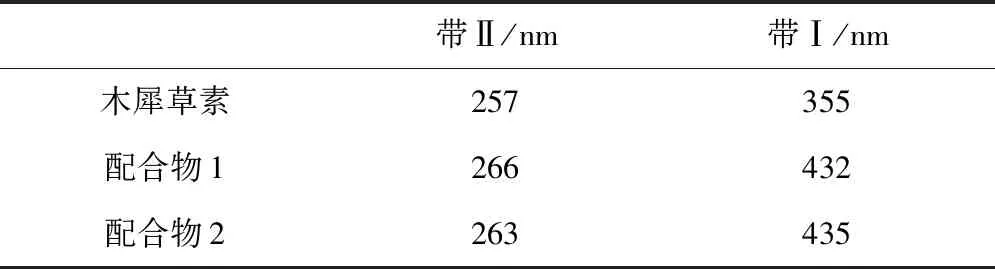
表2 木犀草素及其铜配合物的紫外主要吸收峰波长
将木犀草素和配合物用DMSO溶解,配置成25 μg/mL的溶液,并在200 nm至600 nm光谱区间,在紫外分光光度计上进行紫外光谱扫描。
木犀草素在紫外光谱中出现两个特征吸收峰,位于355 nm处吸收峰为带Ⅰ,是环B的苯甲酰基,位于257 nm处的吸收峰为带Ⅱ,是环A的桂皮酰基[6]。这两处吸收峰均是由于发生ππ→π*跃迁引起[7]。配合物1和2的带Ⅱ的吸收峰依次为266 nm和263 nm,较木犀草素有小幅度红移,带I的最大吸收峰较木犀草素分别红移了80 nm和77 nm。
羟基黄酮类化合物通常有两种配位位点,3'-OH、4'-OH和4-CO、5-OH。文献报道木樨草素多以4-CO、5-OH的形式发生配位[7-9]。在本文铜配合物中木犀草素与铜离子发生配位,配位点也是C环上的4-CO和A环上的5-OH,形成稳定的环状结构,此类情况配位时,4-CO通过共轭,影响到A环和B环两个共振体系能级降低,从而导致两个吸收峰发生红移。
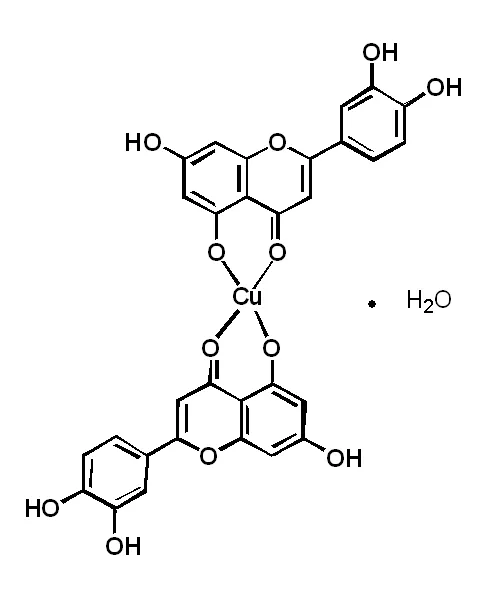
图2 木犀草素铜配合物分子结构
综合上述红外与紫外谱图中分析,考虑到峰顶取点误差,两组数据中吸收峰值的差别可以忽略。因此可以判断配合物1和2在化学结构上相同,且酸根未参与配合物的形成。对配合物进行元素分析得到C:55.78%,H:2.96%;理论值C:55.26%,H:3.09%,推断该配合物的结构式如图2所示,分子中含有水分子。
2.3 木犀草素铜配合物对DNA裂解作用
作为具有抗四环素和氨苄青霉素的基因载体,超螺旋pBR322 DNA常常被用于测试化合物抗菌能力[8]。pBR322 DNA的Form I是超螺旋结构,在与金属作用后会发生解超螺旋现象,形成Form II。本实验中,将反应所用原料(木犀草素、苯甲酸铜、新戊酸酮)与反应所得到的配合物1和配合物2进行对DNA裂解能力比较,如图3所示。木犀草素、苯甲酸铜和新戊酸酮对DNA裂解率分别为4.56%、6.71%、5.13%,基本无裂解能力,而配合物1和配合物2达到了则78.39%和 82.27%,说明木犀草素与Cu2+发生配合后,对pBR322 DNA的裂解能力有着显著提升。此处表明两种方法合成的样品,具有相同的性能,进一步证明配合物结构相同。
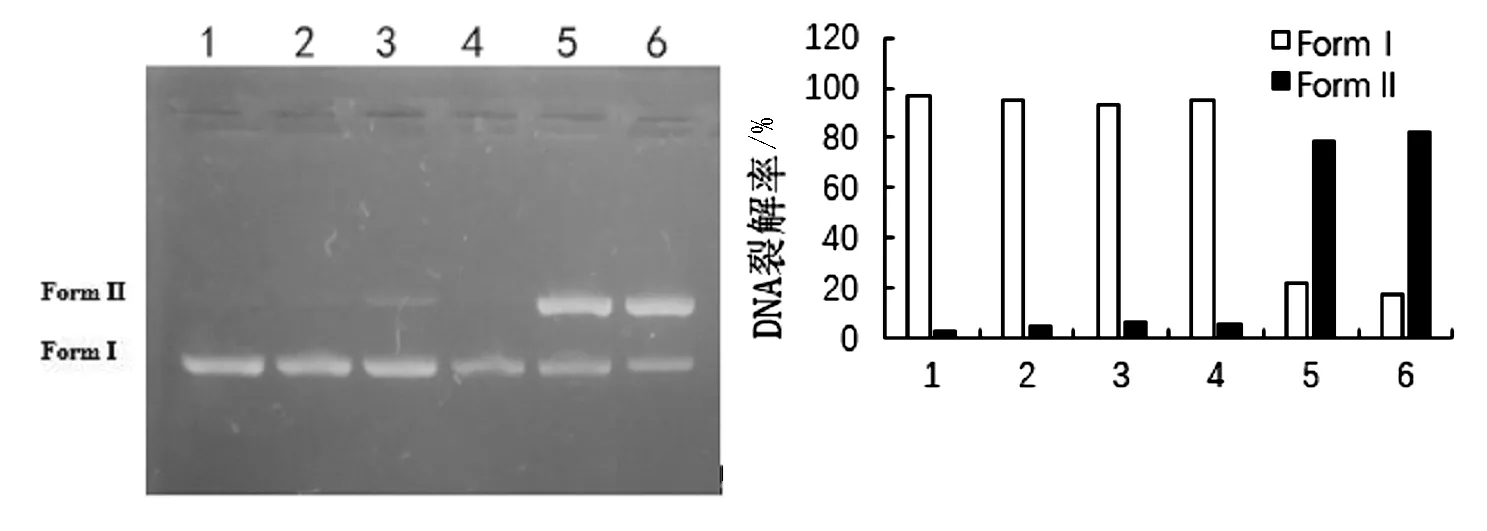
1-Naked DNA;2-木犀草素;3-苯甲酸铜;4-新戊酸酮;5-配合物1;6-配合物2
为了进一步研究配合物的裂解作用,实验选用配合物2测试在不同浓度下对DNA的裂解情况,如图4。在配合物2中,随着浓度的提高,裂解率也有着明显的上升,在75 μg/mL时表现出裂解作用,且在300 μg/mL时,裂解率达到了最高84.16%。
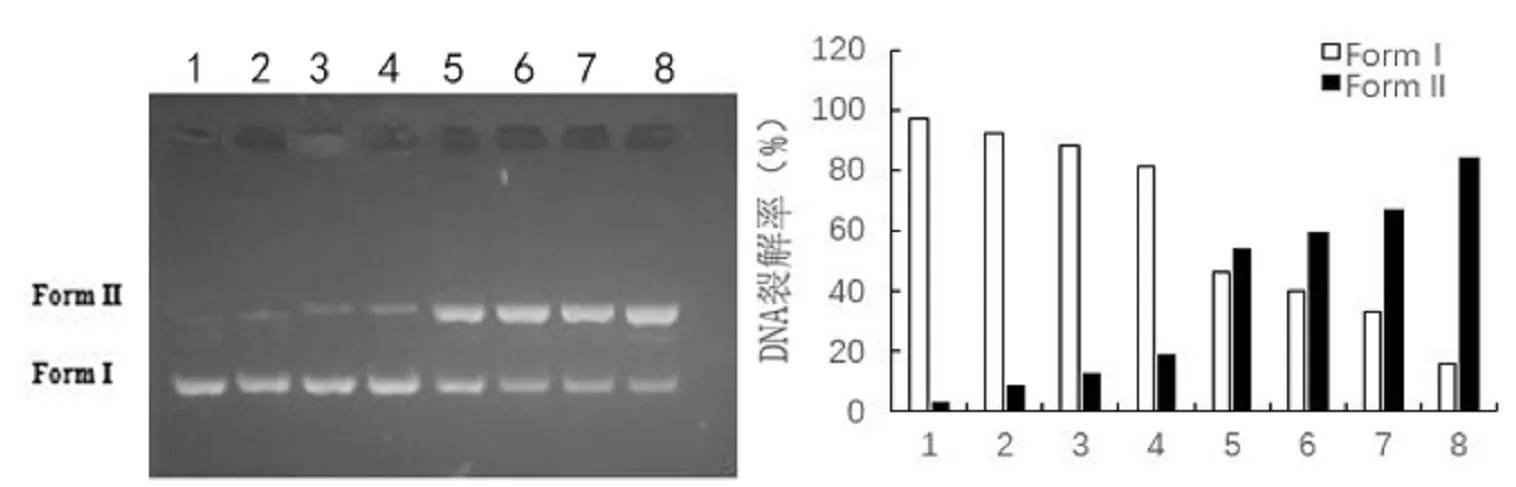
1-DNA;2-DNA+9.38μg/mL;3-DNA+18.75μg/mL;4-DNA+37.5μg/mL;5-DNA+75.0μg/mL;6-DNA+150 μg/mL;7-DNA+225μg/mL;8-DNA+300μg/mL
3 结论
木犀草素金属配合物具有多种生物活性,在本实验中,利用木犀草素与新戊酸铜和苯甲酸铜分别反应生成配合物1和配合物2,利用红外、紫外光谱等方法分析了木犀草素铜配合物的化学组成,并初步推测出在这两种方法下合成的配合物结构相同,木犀草素通过C环上的4-C=O和A环上的5-OH与铜发生配位。此种配位形式在黄酮类化合物金属配位物中较为典型。通过对pBR322 DNA的裂解活性研究表明,原料样品对DNA没有裂解作用,而在生成木犀草素铜配合物后,DNA裂解能力有了明显的提升,并且随着浓度的增大,裂解能力增强。此项研究为后续木犀草素铜配合物的深入研发奠定基础。

