大腹园蛛梨状腺丝重组蛋白的表达纯化与纺丝
易 拓, 朱红年, 孟 清
东华大学化学化工与生物工程学院,上海 201620
天然蛛丝具有独特的力学性能,其机械性能可与钢丝以及凯芙拉纤维媲美;同时还具有良好的生物相容性[1],可作为生物材料应用于生物医学领域,如制造血管支架[2]与人造皮肤支架[3]等。近年来还有研究发现蛛丝还蕴藏着优异的光学特性[4],是可以用来制作超级透镜[4]的新材料。因此,蛛丝已成为天然高分子材料研究中的“热点”。
圆网蜘蛛能分泌生产六种不同的蛛丝纤维和一种粘胶[5],各自有着不同的用途。由于梨状腺丝(pyriform silk)只是附着盘(attachment discs)的一个组份,而且很难将其从蜘蛛体内分离[6],因此,相比于广泛研究的拖丝(dragline),目前鲜有关于天然梨状腺丝的研究报道。附着盘的力学性能特点是具有极高的韧性(tougness),韧性高达150.2~405.2 MJ/m3,但其杨氏模量仅为0.53~1.12 GPa[6]。目前为止,已经报道了A.argentata[7]与A.ventricosus[8]PySp1的全长编码序列还有数种其他蜘蛛的PySp1的部分编码序列[9]。A.ventricosusPySp1编码序列长11 931 bp,编码3 976个氨基酸。其一级结构包含两端的C-terminal与N-terminal;中间的重复区段以及N-linker与C-linker,重复区氨基酸序列包含16个连续的重复单元[8]。除第16个非完全重复单元(177 aa)外,其余重复单元的氨基酸序列(213 aa)几乎完全一致。A.argentataPySp1蛋白共有5 759个氨基酸残基,其重复区由21个重复单元(234 aa)组成[7]。已报道的PySp1全长或部分序列分析显示蛋白的重复区含有PXPX(X为Ala或者Arg)和QQ模块[8]。有研究表明QQ模块的功能可能参与梨状腺丝蛋白在蜘蛛体内的自组装或者聚集[10],以及β-片层结构(β-Sheet)的形成[6]。PXPX模块则被预测倾向形成无规则卷曲(random coil)[9]以赋予蛛丝弹性。
迄今,其余五种天然蛛丝的力学性能都已经被报道,但是尚无天然梨状腺丝的力学性能数据。因此,研究重组梨状腺丝的力学性能可以增进对天然梨状腺丝的力学性能的了解。现在普遍认为蛛丝的力学性能与蛛丝蛋白的重复区模块有关[11,12],所以在本研究中,以A.ventricosusPySp1的一个重复单元(213 aa)为基础,通过无缝克隆技术获得能够表达含有2—3个相同重复单元的重组梨状腺丝蛋白质粒,诱导表达纯化获得重组蛋白,使用湿法纺丝纺成连续的丝状纤维。对制得的纤维进行力学性能测试、FTIR检测以及热重(TG)分析等进行表征。本实验为后续重组梨状腺丝的研究奠定了一定的理论基础。
1 实验材料与方法
1.1 材料
本实验所用重复单元DNA片段源自本实验室筛选得到的A.ventricosusPySp1全长编码DNA(GeneBank: MH376748);实验所用细菌菌株购自北京全式金生物技术有限公司;酶以及相关试剂购自Thermal Fisher Scientific公司(美国);实验相关试剂盒购自生工生物工程(上海)股份有限公司;表达载体由本实验室在商用载体pET-SUMO的基础上进行改造;T载体Blunt-zero购自北京全式金生物技术有限公司;引物由生工生物工程股份有限公司合成。
1.2 质粒的构建与鉴定
以A.ventricosusPySp1重复单元DNA序列为模板,设计2对特异性引物(表1)。DNA片段经BsaI 与Esp3 I酶切后产生的粘性末端可互补配对且不含有内切酶的识别序列,可以实现无缝连接。5′-GCT-3′为PySp1重复单元的第一个氨基酸Ala的密码子;5′-GTA-3′为PySp1重复单元的最后一个氨基酸Val的密码子。在PySp1重复单元序列的5′与3′分别引入Val密码子、Ala密码子,以实现多重复单元的无缝连接(表1),两种密码子均简记为3 bp。PCR产物编号及对应的引物如表2所示。PCR体系为50 μL:Q5 DNA polymerase 0.5 μL;正反向引物各2.5 μL;模板0.5 μL;5×Q5 Reaction Buffer 10 μL;2.5 mmol/L dNTPs 4 μL,用ddH2O补齐至50 μL。反应条件:98 ℃,30 s预变性,98 ℃,10 s变性;60 ℃,30 s 退火;72 ℃,30 s延伸;72 ℃,120 s补平,4 ℃保存。最后对PCR产物进行1%琼脂糖凝胶电泳检测。
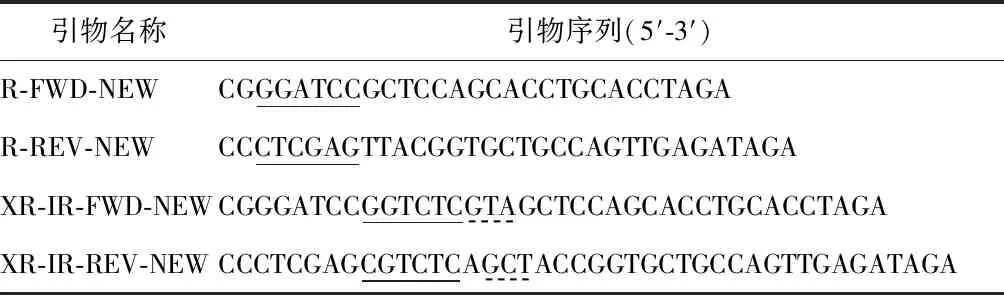
表1 引物序列

表2 PCR产物
BamHⅠ与Esp3Ⅰ酶切R-3bp;BsaⅠ与XhoⅠ酶切3bp-R;BsaⅠ与XhoⅠ酶切3bp-R-3bp;Blunt-zero、plx分别经BamHⅠ与XhoⅠ双酶切。所有连接反应条件为T4 DNA ligase室温连接1小时。热击转化感受态细胞E.coliT1。所有重组片段经PCR产物回收试剂盒回收,质粒提取试剂盒提取质粒。
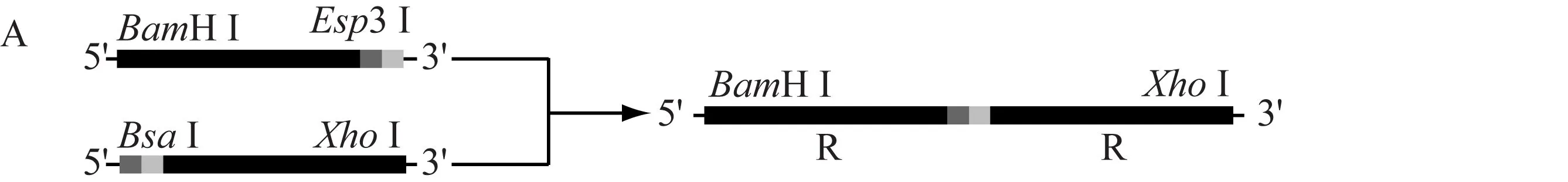
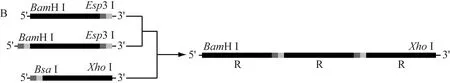
重组DNA片段2R的构建(图1A)。连接R-3bp与3bp-R,得重组片段2R。Blunt-zero与2R连接得到Blunt-zero-2R,转化E.coliT1。提取Blunt-zero-2R,经BamHⅠ与XhoⅠ酶切Blunt-zero-2R,回收2R。plx载体与2R连接获得表达质粒plx-2R,转化E.coliT1。筛选阳性克隆,过夜培养后再提取质粒并测序,4 ℃保存。
重组DNA片段3R的构建(图1B)。连接R-3bp、3bp-R-3bp获得重组片段2R-3bp。Blunt-zero与2R-3bp连接获得Blunt-zero-2R-3bp。转化E.coliT1并过夜培养。提取Blunt-zero-2R-3bp,BamHⅠ与XhoⅠ酶切Blunt-zero-2R-3bp,回收2R-3bp后用Esp3Ⅰ酶切,再与3bp-R连接获得重组片段3R,最后与Blunt-zero连接获得Blunt-zero-3R,转化E.coliT1。过夜培养后提取质粒送测序。BamHⅠ与XhoⅠ酶切Blunt-zero-3R,回收3R后与plx相连获得表达质粒plx-3R,转化E.coliT1,过夜培养后提取质粒并测序。最后用BamHⅠ与XhoⅠ酶切鉴定过渡质粒Blunt-zero-2R、Blunt-zero3R与表达质粒plx-2R、plx-3R。
1.3 重组蛛丝蛋白2R与3R的诱导表达与纯化
将测序正确的plx-2R、plx-3R质粒转化E.coliBL21(DE3)后,涂布于含Amp(100 μg/mL)的LB固体培养基过夜培养,温度为37 ℃。次日挑选单菌落接种至10 mL含Amp (100 μg/mL)的LB培养基中,置于37 ℃恒温摇床中200 r/min过夜培养。再以1∶100的比例将菌液接种到1 L含Amp(100 μg/mL)的LB培养基中,37 ℃恒温摇床培养箱中培养至OD600值为0.6~0.8,加入IPTG使其终浓度为0.3 mmol/L。重组蛋白2R、3R的表达条件为25 ℃,20 h。
4 000 r/min,4 ℃收集诱导后菌液,离心15 min。每升菌体加入50 mL的lysis buffer(20 mmol/L Tris-HCl,100 mmol/L NaCl,pH 8.0)重悬。用高压均质仪(JN-3000 plus,广州聚能生物科技有限公司)120 MPa破碎菌体,重复三次。4 000 r/min,4 ℃离心裂解液15 min,弃上清,收集沉淀。向每升菌液的沉淀中加入50 mL的wash buffer (20 mmol/L Tris-HCl,100 mmol/L NaCl,2 mol/L尿素,pH 8.0)重悬,将重悬液置于冰水浴中进行超声破碎(功率设定为250 W,工作5 s,间隔为8 s,重复30次,每个样品超声破碎1次)。4 ℃,4 000 r/min离心重悬液30 min,弃上清收集沉淀。往每升菌液的沉淀中加入50 mL dissolution buffer (20 mmol/L Tris-HCl,8 mol/L尿素,pH 8.0),置于室温30 min。最后4 ℃、12 000 r/min离心溶液30 min,收集上清。用透析袋(分子截留量为14 000)连续透析72 h,每隔3 h换一次透析液,透析液为超纯水。透析完成后取少量样品进行15% SDS-PAGE电泳与考马斯亮蓝染色以检测样品纯度与分子量。最后冻干蛋白。
1.4 湿法纺丝及力学性能测试
使用六氟异丙醇(HFIP)溶解冻干的蛋白粉,置于磁力搅拌器上20 r/min连续搅拌24 h制成纺丝液,其质量体积比为10%。在开始湿纺前,于30 ℃以10 000 r/min 转速离心纺丝液30 min以去除不溶性杂质。用1 mL的注射器吸取500 μL的纺丝液,LSP01-3A微量注射泵[兰格恒流泵有限公司(上海)]以恒定流速(0.6 mL/h)将纺丝液推入凝固浴中,凝固浴为25 ℃恒温的100%甲醇。用镊子将凝固浴内成型的蛛丝夹出,沿纺丝槽拉伸一段距离后再拉出液面并缠绕于线轴上,期间从低速向高速调整马达转速使丝纤维连续不断地收集在线轴上,最终收集装置的马达转速设定为49 r/min。所获得的丝纤维置于通风橱过夜去除残余的化学试剂。
每种纤维制备50个样品并固定在自制纸质框架上,用高倍率光学显微镜(莱卡)观察纤维样品,选取直径分布均匀且表面光滑的样品,每个样品随机选取三个部位测量平均直径。用T150 universal纳米拉伸仪(UTM, KLA-Tencor Inc., Oak Ridge, USA)进行拉伸测试,测试环境为25 ℃、相对湿度为45%。测试参数设定为拉伸速率10-2s-1。力学性能的杨氏模量、最大应力和应变与韧性由机器自带的软件Nanosuit计算。用OriginPro9.1绘制应力-应变曲线。蛛丝纤维的微观形态与表面微观结构由Phenom Pure desktop SEM(Phenom-world BV, Netherlands)检测。
1.5 显微红外与热重分析
使用FTIR-micro Nicoletn10MX spectrometer(Thermo Fisher Scientific有限公司)检测纤维的二级结构[13],测试过程中维持恒温(20 ℃)干燥的环境。peakFit4.12软件对酰胺Ⅰ带(1 600 cm-1~1 700 cm-1)的红外光谱求二阶导,波峰拟合算法选择GaussAmp,baseline correction算法选择Initial,Final lin,多次拟合使残差值最小(r2≥0.996)。分峰处理参数设定为1 628 cm-1(β-sheet)、1 646.5 cm-1(random coil)、1 659.5 cm-1(α-helix)、1 679.5 cm-1(β-turn)和1 695 cm-1(β-sheet)[14-18]。用Origin9.1对处理后的数据绘图。确定各子峰与各二级结构对应的关系,并根据其积分面积计算出二级结构的百分比含量。
热重分析仪(TG 209 F 1 Libra,NETZSCH)测试丝纤维的热稳定性。测试条件为:氮气保护下,从25 ℃升温至900 ℃,升温速率为10 ℃/min,测试样品质量为5 mg。记录的数据以Excel格式导出,最后用origin 9.1绘制TG、DTG图。
2 实验结果
2.1 PCR产物的鉴定
使用表2中的引物组合扩增出三种PCR产物:3bp-R(667 bp)、3bp-R-3bp(676 bp)与R-3bp(667 bp)。1%琼脂糖凝胶电泳结果(图2)表明目的条带大小与预期大小相一致。
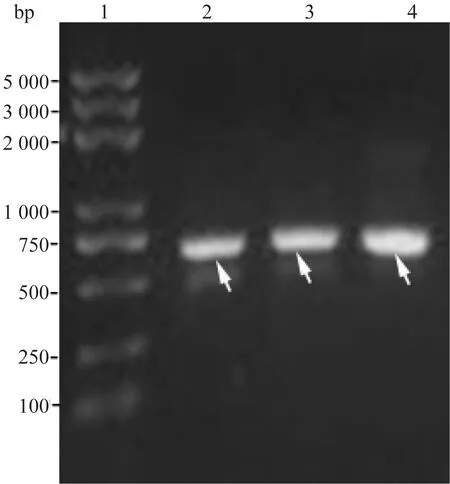
泳道1: DNA marker,泳道2:R-3bp (667 bp), 泳道3:3bp-R-3bp(676 bp),泳道4:3bp-R (667 bp)图2 1%琼脂糖凝胶电泳检测结果
2.2 过渡质粒与表达质粒的鉴定
所有成功构建的阳性克隆经双酶切、1% 琼脂糖凝胶电泳鉴定,结果如图3所示。3A与3B分别为过渡质粒Blunt-zero-2R、Blunt-zero-3R的鉴定图;3C与3D分别为plx-2R、plx-3R的鉴定结果。将不经双酶切处理的质粒设定为阴性对照,与经过双酶切处理的质粒进行电泳鉴定。电泳结果表明重组片段2R、3R成功插入Blunt-zero与plx。测序结果经比对后,与原设计序列一致。
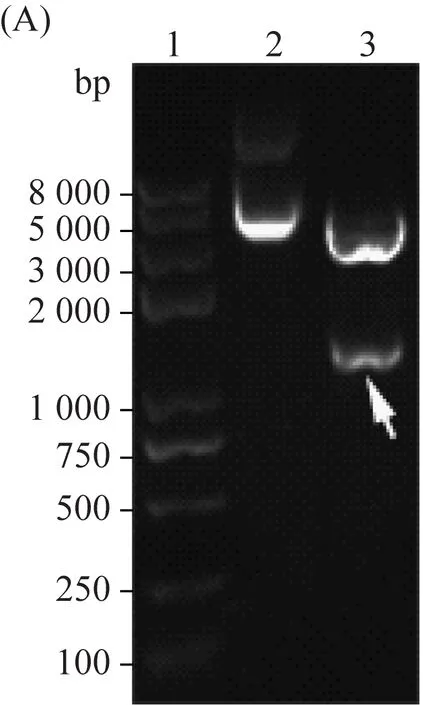
(A)Blunt-zero-2R双酶切鉴定结果(B)与Blunt-zero-3R双酶切鉴定结果(C)plx-2R双酶切鉴定结果(D)plx-3R双酶切鉴定结果 其中:泳道1: DNA marker、泳道2: 质粒未经双酶切的阴性对照、泳道3: 质粒双酶切后的混合产物图3 质粒的双酶切鉴定结果
2.3 重组蛛丝蛋白的表达与纯化
重组蛋白2R与3R的理论分子量见表3。经过蛋白提纯、冻干等步骤后,重组蛋白2R与3R的平均产量为70 mg/L和66 mg/L。15% SDS-PAGE检测重组蛋白(图4A和图4B)。结果显示重组蛋白2R的相对分子量稍大于45 000;3R的相对分子量接近66 200。这种目的蛋白表观分子量比理论分子量偏大的现象并不鲜见,类似现象也出现在其他蛋白的SDS-PAGE结果中,如SUMO[19]、含正电荷氨基酸残基的酰基载体蛋白(ACP)[20]以及其他已报道的重组梨状腺丝蛋白[21]。造成这种现象的可能原因是蛋白内的高脯氨酸含量以及SDS与蛋白的不充分结合[21]。在图4中,诱导前(泳道2)与诱导后(泳道3)对比,表明两种蛋白均在大肠杆菌中表达。上清(泳道4)与沉淀(泳道5)相比,表明两种蛋白均存在于沉淀(包涵体)中,表明这两种蛋白在大肠杆菌内的合成速度较快,以至于不能正确折叠[22]。因此用尿素变性纯化法纯化蛋白。

表3 重组蛛丝蛋白的分子量
2.4 纤维2R与3R的表征
重组蛋白2R与3R溶解于HFIP后可以湿纺成连续的丝状纤维。高倍率光学显微镜观察显示纤维2R和3R的直径分布较均匀,纤维2R表面有不规则凸起,3R的表面较光滑,两者的平均直径分别为11.5 μm、14.4 μm(图5)。
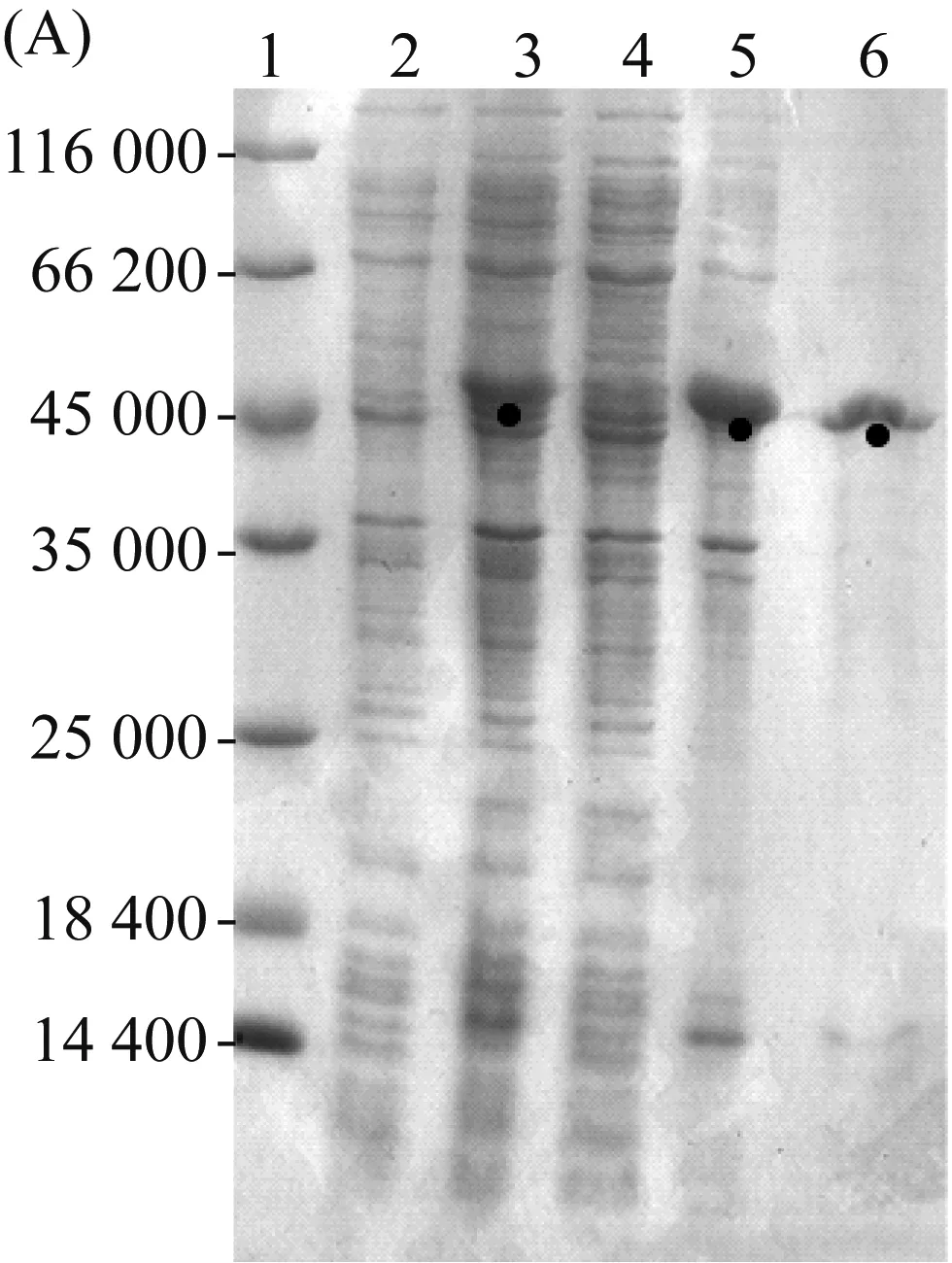
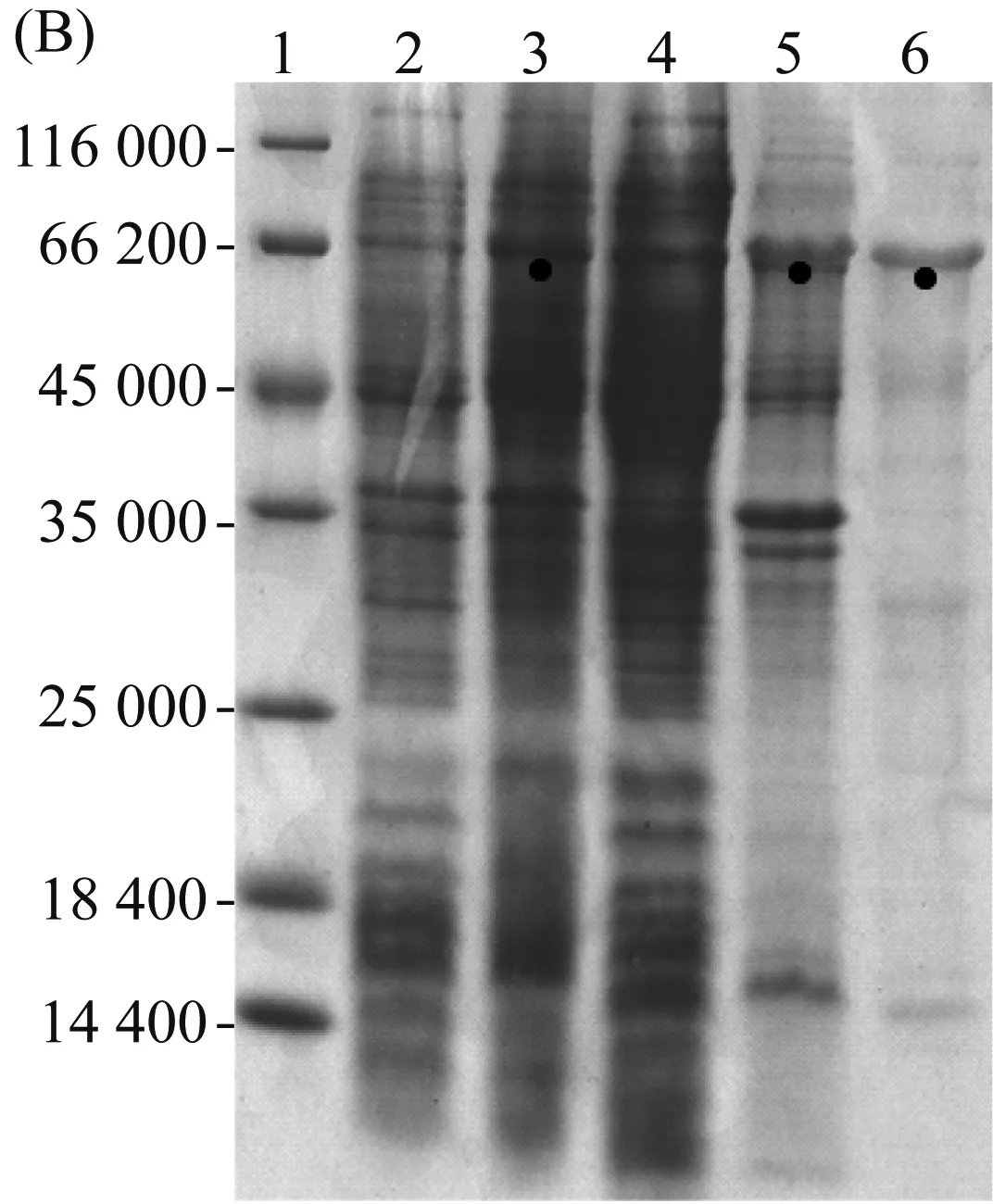
(A) 2R;(B) 3R。其中:泳道1: protein marker; 泳道2: IPTG诱导前细胞裂解液; 泳道3: IPTG诱导后细胞裂解液; 泳道4:细胞裂解液离心后上清; 泳道5:细胞裂解液离心后沉淀; 泳道6: 纯化后的目的蛋白图4 重组蛋白的诱导表达与纯化检测结果


(A)与(B) 分别为SEM图、光学显微镜图图5 丝纤维的光学显微镜与扫描电子显微镜观察结果
UTM测试结果表明(图6与表4),纤维2R与3R都表现出与天然蜘蛛丝类似的应力-应变行为。它们在初始阶段具备抗拉伸的弹性,随着纤维不断地被拉伸,超过屈服点后,纤维发生了塑性变形。纤维2R与3R都具有高延展性,最大断裂应变分别为84%和139%,均高于天然拖丝(25%~35%[23])、次壶腹腺丝(5%)[24]、管状腺丝(20%)[24]与葡状腺丝(80%)[24]。与其他类型的重组梨状腺丝纤维相比,纤维2R与3R具有更好的力学性能。比如,HPy2[21]为不含C-terminal、N-terminal的重组梨状腺丝纤维,其包含两个重复单元,共477个氨基酸残基。纤维2R、3R与HPy2相比,这两种纤维的杨氏模量与延展性均比HPy2的强(表4)。此外,纤维2R与3R同重组葡状腺丝纤维相比也表现出了优异的特点。W2[25]包含两个AcSp1重复单元;W3[26]包含3个AcSp1重复单元。纤维2R与3R的杨氏模量与延展性均比W2、W3的高(表4)。这些力学能的差异一方面源自重组蛛丝蛋白结构的差异[27],另一方面源自纺丝条件的不同[28]。
为了获知纤维2R与3R的二级结构组成,因此采用FTIR分析重组纤维。测试结果表明(图7与表5),纤维2R与3R的二级结构组成基本一致。纤维2R与3R的无规则卷曲(random coil)含量分别为26.57%、25.0%,均高于天然AcSp的18%、 MaSp的12%[29]、与Flag的13%~15%[30]。这可能是因为PySp1蛋白内的(PX)nmotif倾向于形成无规则卷曲[9]。这两种重组纤维的α-helix含量均与天然梨状腺丝的相近[29]。
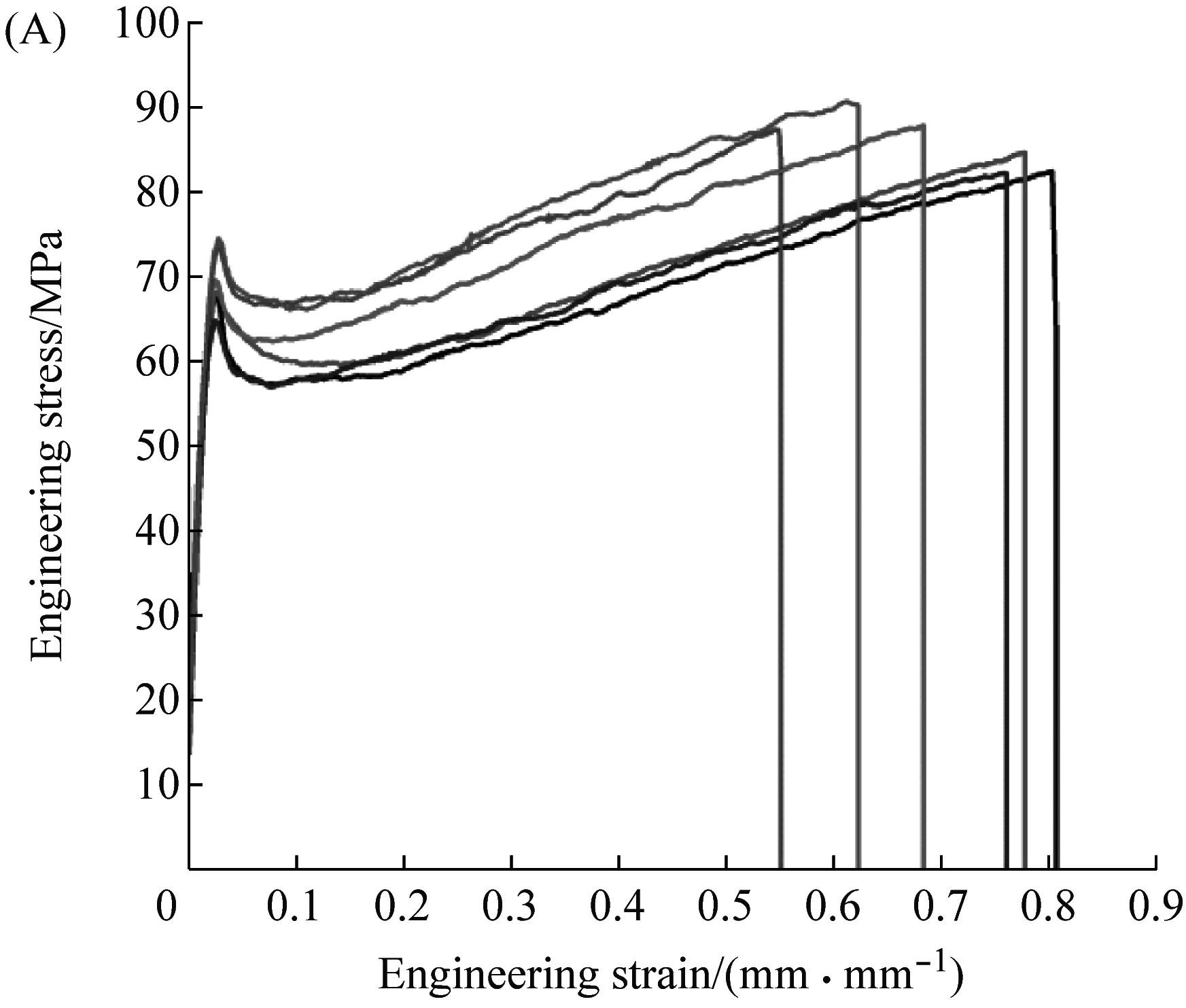
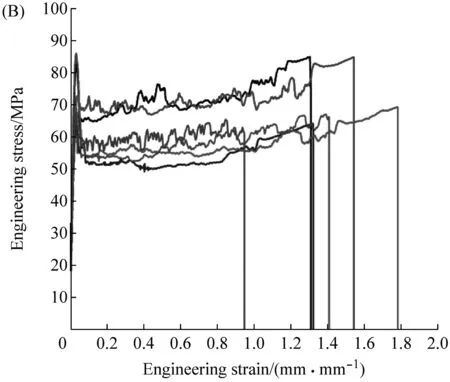
图6 纤维2R(A)与3R(B)的应力-应变曲线汇总图
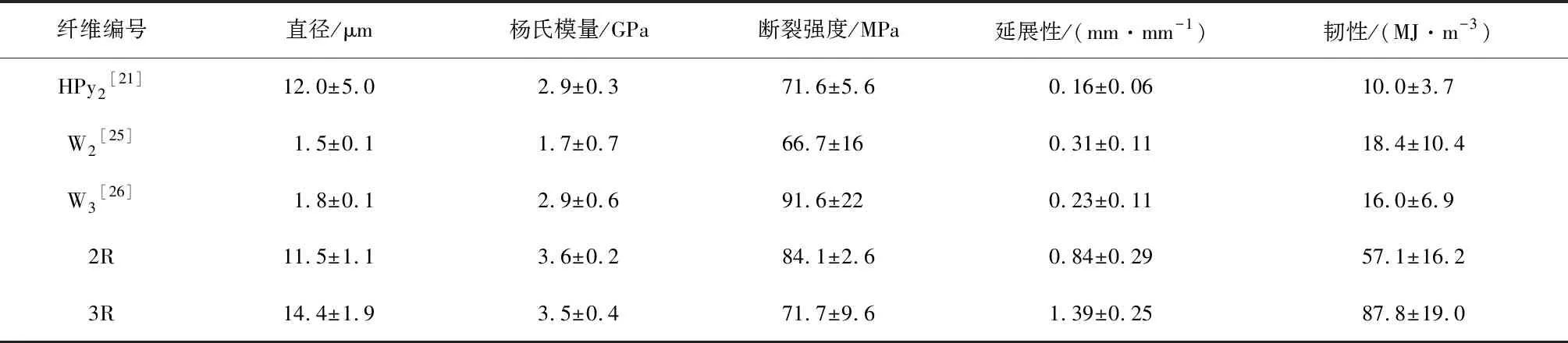
表4 重组蛛丝纤维机械性能汇总表
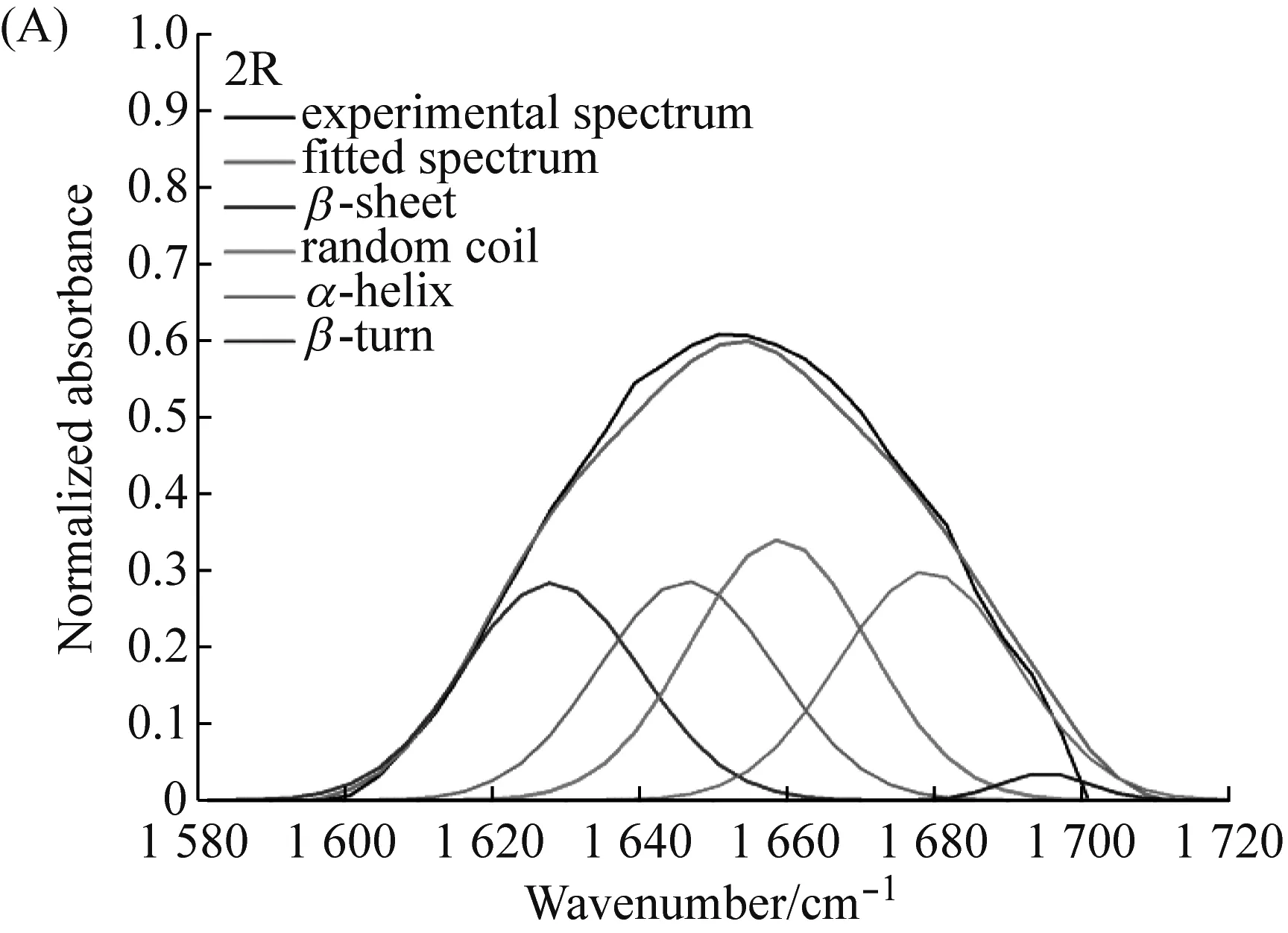
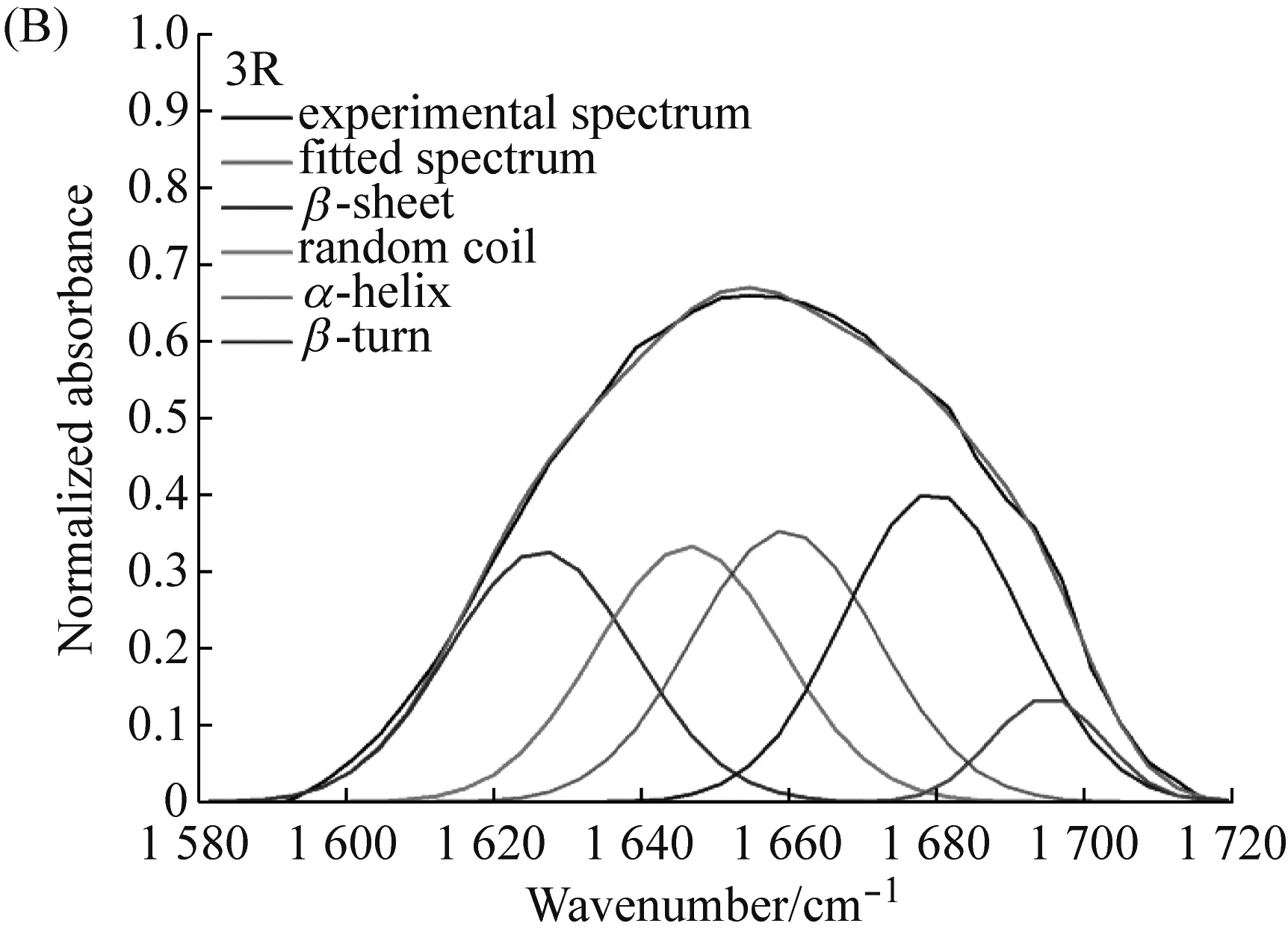
图7 纤维2R与3R的酰胺Ⅰ区FTIR测试分峰拟合示意图

表5 纤维2R与3R的二级结构组成
2.5 纤维2R与3R的热重分析
热重分析(thermal gravity analysis,TGA)是一种分析材料热行为(thermal behavior)的方法。不同的材料在不同的温度范围内表现出热稳定性,表现为质量不会改变、不发生氧化反应等[31]。一旦温度超出这个范围,材料的微观结构会因高温而崩溃。鉴于纤维2R与3R有较理想的机械性能,因此本实验对其进行热行为分析。TGA结果显示,当温度在200 ℃~340 ℃之间时,纤维2R、3R的质量大幅度减少,这与之前其他种类的重组蛛丝的热稳定性的研究一致[32]。在100 ℃之前,这两种纤维的质量均降低约6%左右(图8A),推测是纤维中的水分或者六氟异丙醇由于高温蒸发所致[33]。在100 ℃~200 ℃的区间内,纤维2R与3R的质量没有明显下降。当温度为320 ℃时,此两种纤维的热重损失达到最大,即这一刻纤维降解的速度最快。当温度高于200 ℃时,纤维2R与3R的质量开始持续下降,原因可能是维持纤维晶体区域的氢键网格在200 ℃时已被破坏[34],进而开始热分解(thermal decomposition)。以上结果表明纤维2R、3R的热行为与多数聚合物的类似,能够在≤200 ℃的温度范围内保持稳定[32]。
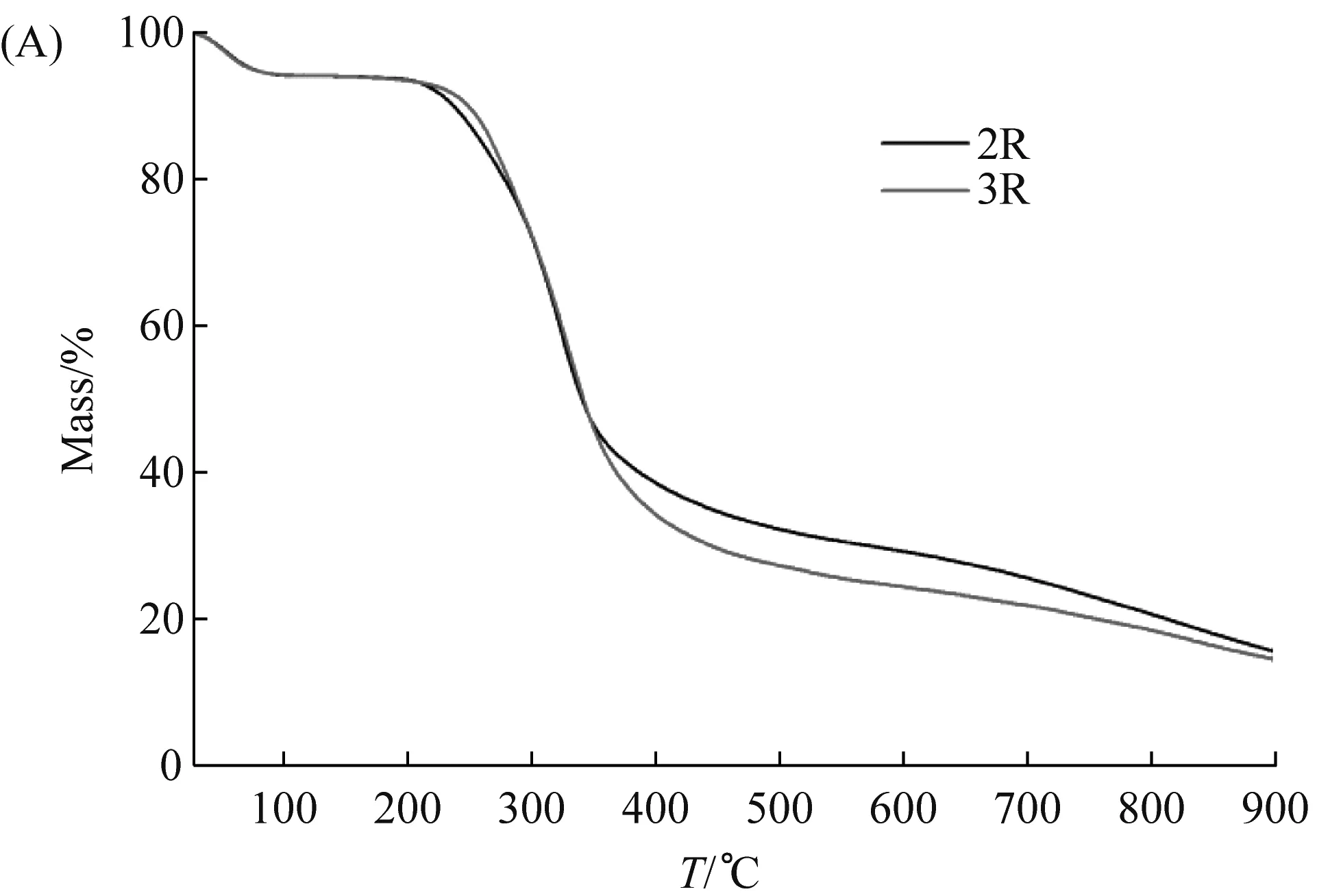
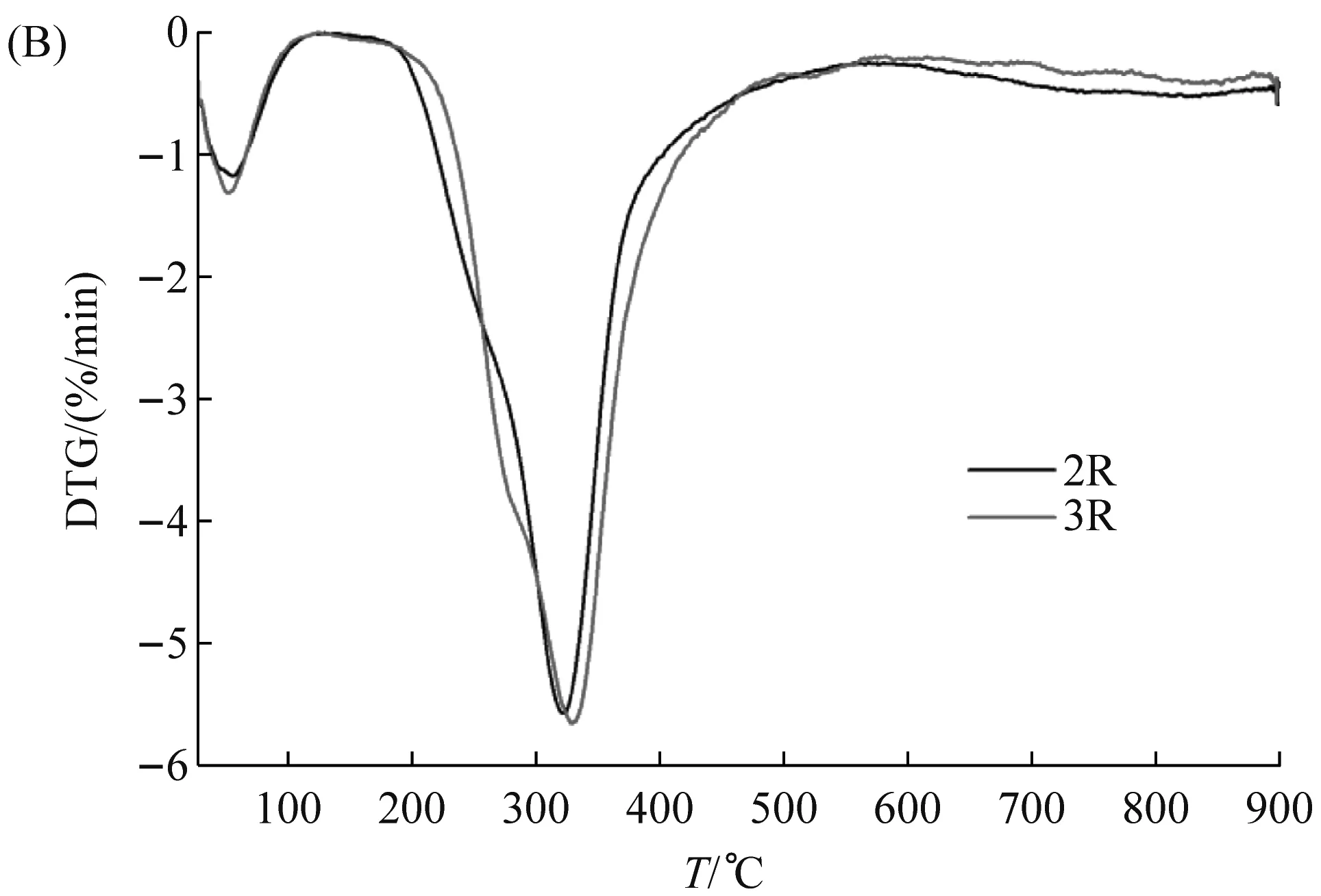
(A)纤维2R与3R的TGA图;(B)纤维2R与3R的DTG图。图8 纤维2R与3R的热重分析图
3 总结
本实验以大腹圆蛛梨状腺丝蛋白的一个重复单元为基础,成功构建了表达质粒,表达纯化获得了重组蛛丝蛋白2R与3R,并使用湿纺方法获得连续的丝状纤维。这些重组丝纤维表现出良好的力学性能,并具有和天然蛛丝纤维相类似的二级结构和与一般聚合物类似的热稳定性。本课题拓展了对重组蛛丝纤维的研究,为后续有关重组A.ventricosusPySp1纤维的研究与应用提供了理论基础。

