细菌生物膜去除效率的定量检测
李 宇, 江 勇, 杨 琳, 谢颖玮
3M中国有限公司, 上海 200233
细菌生物膜是粘附于载体表面,由细菌和自身分泌的胞外基质形成的一种膜结构,其主要成分为胞外多糖蛋白质复合物,能够极大的增强细菌的抗药性和抗免疫能力等[1-3]。因此如何有效地检测生物膜去除效率一直是生物医学界和食品工业领域研究的热点之一[4-6]。目前,针对生物膜去除效率的评价主要通过统计细菌数目的变化来反映[4,5],其局限性是很明显的,即细菌的灭杀效率并不能完全等同于生物膜的去除效率,细菌被杀死并不意味着生物膜被破坏和去除。因此开发一种新的生物膜含量的评价方法,对更直观和科学地表征生物膜危害的防治效果将更具有实践意义和应用价值。
多糖作为生物膜的主要成分之一,对其的研究一直以来备受关注[7-9]。在一定程度上,多糖的存在也能够作为生物膜存在的重要标志。在本研究中,我们通过检测消毒剂作用前后细菌生物膜中多糖含量的变化来反映生物膜的去除效率,从而为发展新的生物膜去除效率检测方法提供参考。
1 材料与方法
1.1 试验材料与设备
紫外可见分光光度计(UV-VIS);电加热板;旋转蒸发仪;安捷伦1100 凝胶渗透色谱仪(GPC);色谱柱(HSPgel 3.0+HSPgel 5.0);CDC生物膜反应器;磁力搅拌器等。
1.2 试剂
三氟乙酸;苯酚;浓硫酸;马铃薯淀粉;3M Avagard9250消毒剂;3M Avagard9206消毒剂等。
1.3 试验方法
1.3.1试验菌准备
在无菌条件下,挑取3~5个生长良好的铜绿假单孢杆菌(ATCC 15442)典型菌落放入100 mL无菌胰酪大豆胨液体培养基(TSB)中(300 mg/L),在(35±2) ℃振荡过夜培养。培养完成后,菌液浓度需达到108CFU/mL,保存备用。
1.3.2生物膜培养
按ASTM E2562的要求搭建生物膜反应器模型[10]。在主反应器中加入无菌TSB(300 mg/L)培养液500 mL。在主反应器中接种1 mL培养好的菌液,打开磁力搅拌器,使主反应器中的培养体系的转速控制在125 r/min,将生物膜反应器放在室温下(21±2) ℃过夜培养24 h。连接20 L TSB(100 mg/L)补液桶,以(11.7±0.2) mL/min的流速向主反应器补充新鲜培养液,同时打开主反应器的排液管,使多余的培养液流出反应器。补液培养过程持续24 h后,关闭所有反应器,取出生长好的生物膜片备用。
1.3.3消毒剂杀菌试验
用20 mL无菌水清洗培养好的生物膜片,去除残留在表面的游离细菌。随后将清洗好的生物膜片放入50 mL离心管中,加入4 mL消毒剂,作用3 min后,立即向50 mL离心管中加入36 mL中和剂进行中和,充分振荡超声后,取菌悬液以10倍梯度稀释进行活菌计数。
1.3.4水解方法及水解效率评估方法
取1片生长良好的生物膜片放入20 mL生理盐水中,充分的振荡洗脱后制成20 mL生物膜悬液,加入4 mol/L 三氟乙酸溶液10 mL[11],在110 ℃下加热4 h进行水解,然后在旋转蒸发仪上浓缩至快干,获得样品浓缩液。
水解效率的评估主要通过安捷伦凝胶渗透色谱仪(GPC)来进行。对于水解前样品,直接取1 mL样品溶液,用0.45 μm滤膜过滤于样品瓶中,进行凝胶渗透色谱(GPC)测试。对于水解后样品,取1 mL样品浓缩液,缓慢滴加三乙胺调节溶液pH至7.0左右,然后同样用0.45 μm滤膜过滤于样品瓶中,进行GPC测试。GPC测试条件为:流动相为水,选用的色谱柱为HSPgel3.0 + HSPgel5.0 (6.0×150 mm),柱温40 ℃,流速控制为1.0 mL/min,进样量为2.0 μL,运行时间为20 min。
1.3.5多糖水解后的单糖含量测定方法
分别取500 μL生物膜样品浓缩液和马铃薯标准品浓缩液于4 mL样品瓶中,加入 500 μL 5%(质量分数)苯酚溶液,混合均匀后加入2.5 mL 浓硫酸,待溶液冷却至室温后,取溶液200 μL于96位孔板中,通过紫外可见分光光度计,于490 nm波长处测定溶液的吸光度[12]。结合马铃薯淀粉标准品获得的标准曲线,计算得到水解后的单糖含量。
2 结果与分析
2.1 杀菌效率
使用两种不同的消毒剂(3M Avagard9250和3M Avagard9206)进行杀菌处理,处理前后菌液浓度的变化以及计算得到的相应杀菌效率如表1所示。每种消毒剂重复三次实验,可以发现,两种消毒剂的杀菌效率都达到了99%以上,呈现出较好的杀菌效果,如以此杀菌效率作为生物膜的去除效率,则说明生物膜已经在很大程度上被破坏并去除。
2.2 生物膜定量检测
2.2.1水解结果
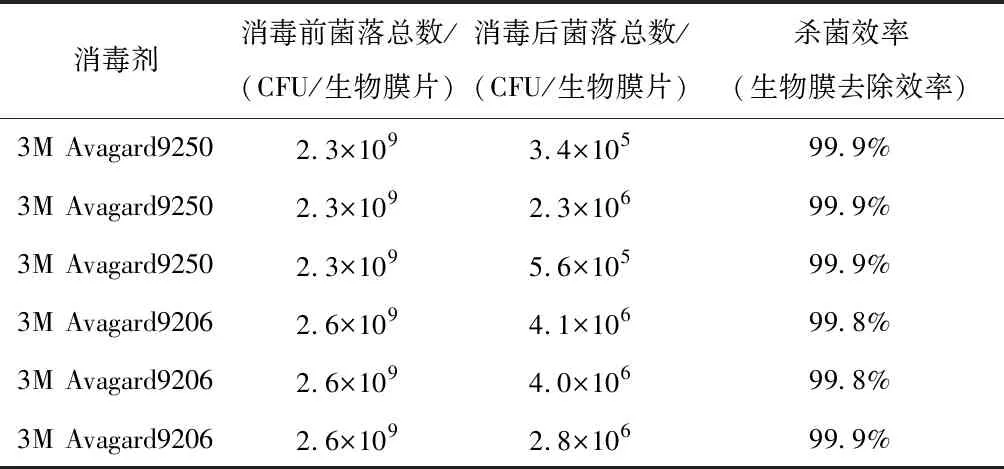
表1 消毒剂杀菌效果表
马铃薯淀粉溶液水解前后的GPC谱图如图1和图2所示。同时随机选取一组生物膜样品,其水解前后的GPC谱图如图3和图4所示。可以发现,对于马铃薯淀粉和生物膜样品,水解前GPC图谱中仅有分子量大的物质存在(保留时间短),水解后,分子量大的化合物消失,而具有小分子量的物质(保留时间长)出现,说明了水解过程的完全,生物膜和马铃薯淀粉中的多糖等大分子物质被水解为单糖等小分子物质,获得了预期的水解效果,为多糖的定量分析提供了依据和可行性。
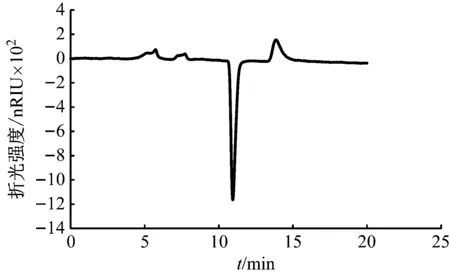
图1 马铃薯淀粉溶液水解前GPC图谱
2.2.2多糖定量标准曲线的建立
称取马铃薯淀粉对照品5 mg(精确至0.000 1g),置10 mL容量瓶,加水溶解,稀释至刻度。 分别移取此马铃薯溶液0 mL、0.4 mL、1.0 mL和2.0 mL,置10 mL样品瓶中,用水稀释至刻度。按照1.3.4中水解方法对马铃薯稀释液进行水解浓缩。
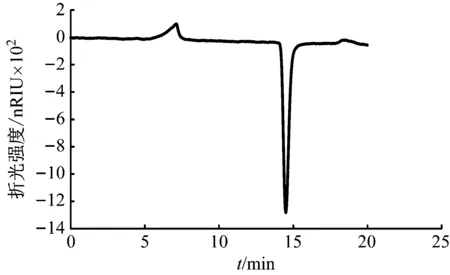
图3 生物膜样品水解前GPC图谱
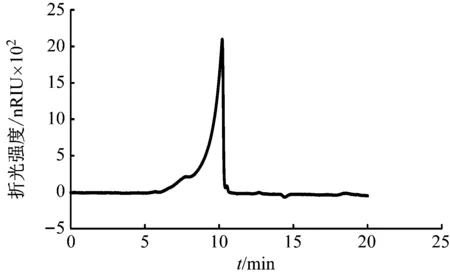
图4 生物膜样品水解后GPC图谱
水解完成后,通过紫外可见分光光度计测定各马铃薯稀释液的吸光度, 以马铃薯溶液浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,如图5所示,将依据此标准曲线对生物膜中的多糖含量进行定量。
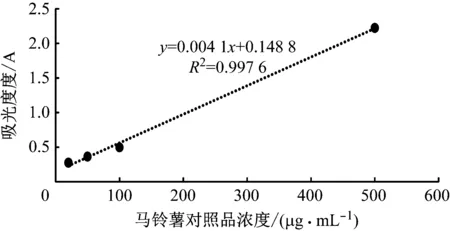
图5 马铃薯淀粉标准曲线
2.2.3多糖含量测定结果
将生物膜样品分成A,B 两组,每组包含三个培养良好的生物膜片,每组中各选取一个生物膜片作为参考样,分别对其进行水解并测定其吸光度。A组其余两个生物膜片通过3M Avagard9250消毒剂进行杀菌,同时B组其余两个生物膜片则通过3M Avagard9206消毒剂进行灭菌,然后将所有消毒剂处理过的样品分别进行水解,测定其吸光度。结合标准曲线,通过计算我们得到了两组生物膜样品中的多糖含量,以及消毒剂作用前后多糖含量的变化,从而更为直观地展示了生物膜含量的变化以及据此计算得到生物膜的去除效率,结果如表2所示。通过对比传统数菌方法(表1)与本研究中的方法,可以发现,以多糖含量的变化计算得到的生物膜去除效率远低于传统数菌方法,说明即使细菌被充分灭杀,生物膜依然能够较大程度地保留。
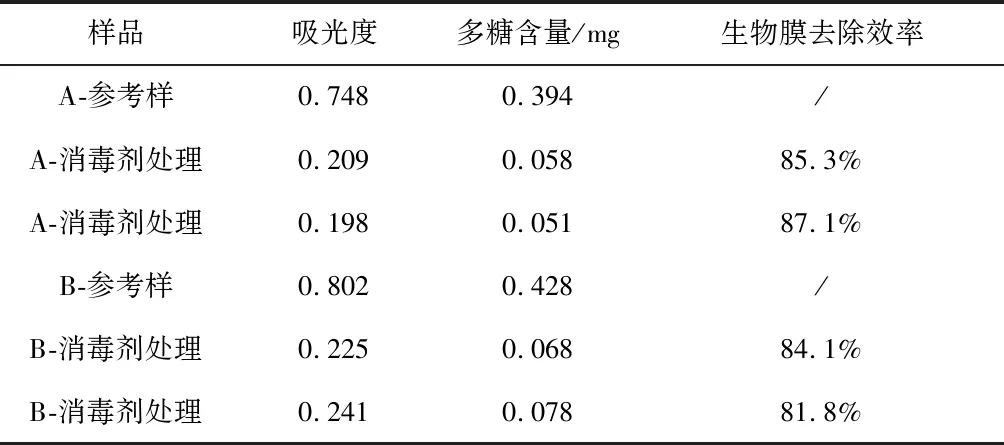
表2 消毒剂作用前后多糖含量变化表
3 结论
本研究通过检测消毒剂作用前后生物膜中多糖含量的变化来反映生物膜的去除效率,并与传统的数菌方法进行了对比,发现以细菌的灭杀效率来反映生物膜的去除效率是不完善的,生物膜作为细菌的载体,通过消毒剂很难将其彻底去除,生物膜的去除以及去除效率的检测都需要更为有效的手段来完成。

