骨膜蛋白对高糖诱导的H9c2心肌细胞凋亡的作用研究
孙晓慧 乌宇亮 杨莉 贺静
710201 西安,长庆油田职工医院心血管内科(孙晓慧、杨莉、贺静);710061 西安交通大学第一附属医院心血管内科(乌宇亮)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病的一种独立并发症[1]。目前研究认为,DCM的发病机制可能与代谢紊乱、心肌细胞肥大与凋亡、心肌纤维化和微血管病变等有关,其中细胞凋亡在DCM发病中起重要作用[2]。骨膜蛋白(periostin,POSTN)主要在成骨细胞和其衍生细胞中表达,刺激成骨细胞分化、增殖和粘附。POSTN在各种炎症反应、心血管系统疾病及肿瘤病理过程中表达显著升高[3]。Guan等[4]报道,POSTN在糖尿病大鼠心肌组织中表达显著上升,在DCM的病变进程中发挥重要功能。但POSTN对DCM的心肌细胞凋亡有何影响仍未可知。在本研究中,我们通过高糖诱导H9c2心肌细胞,探讨POSTN对其细胞活性和细胞凋亡的影响,并初步探讨其作用机制,旨在为DCM的病因机制研究提供理论依据,寻求新的治疗靶点。
1 材料与方法
1.1 主要材料和试剂
H9c2细胞系由中国科学院细胞库提供;DMEM培养基购自美国Gibco公司;胎牛血清(fetal bovine serum,FBS)购自美国HyClone公司;Lipofectamine 3000和TRIzol试剂购自美国Invitrogen公司;反转录试剂盒和实时荧光定量PCR检测试剂盒均购自日本TaKaRa公司;CCK-8细胞活力检测试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒、TUNEL凋亡检测试剂盒购自南京建成生物有限公司;细胞裂解液、PMSF和BCA蛋白定量试剂盒购自上海碧云天生物有限公司;PVDF膜购自美国Millipore公司;兔源POSTN、Bcl-2、Bax、cleaved Caspase-3及GAPDH等一抗购自美国Abcam公司,羊抗兔二抗购自北京中杉金桥生物技术有限公司。双荧光素酶报告基因检测试剂盒购自美国Promega公司。POSTN siRNAs及其阴性对照siRNA-NC、let-7c mimic及其阴性对照mimic-NC由上海吉玛制药技术有限公司合成。pGL3-POSTN 3’-UTR、pGL3-POSTN 3’-UTR mut、pcDNA3.1-POSTN质粒(pcDNA3.1空载质粒作为阴性对照)由上海生工生物工程股份有限公司构建。
1.2 研究方法
1.2.1 细胞培养及处理 H9c2细胞置于含10% FBS、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基中,于5%CO2、37℃的条件下培养,待细胞生长至约80%~90%的融合状态时传代或铺孔进行实验。SiRNAs、质粒及mimics的转染根据Lipofectamine 3000的操作说明书进行。高糖处理:用33 mmol/L葡萄糖作用于H9c2细胞24 h。
1.2.2 细胞分组 将H9c2细胞按系统随机法分为control组(正常培养的H9c2细胞),HG组(33 mmol/L葡萄糖处理24 h的H9c2细胞),si-POSTN+HG组(转染si-POSTN 24 h后,33 mmol/L葡萄糖处理24 h的H9c2细胞),si-NC+HG组(转染si-NC 24 h后,33 mmol/L葡萄糖处理24 h的H9c2细胞),pcDNA3.1-POSTN+HG组(转染pcDNA3.1-POSTN 24 h后,33 mmol/L葡萄糖处理24 h的H9c2细胞)和pcDNA3.1+HG组(转染pcDNA3.1 24 h后,33 mmol/L葡萄糖处理24 h的H9c2细胞),pcDNA3.1-POSTN组(单独转染pcDNA3.1-POSTN质粒48 h的H9c2细胞)和pcDNA3.1组(单独转染pcDNA3.1空载质粒48 h的H9c2细胞),mimic-NC组(单独转染mimic-NC 48 h的H9c2细胞)和let-7c mimic组(单独转染let-7c mimic 48 h的H9c2细胞)。
1.2.3 RT-PCR Trizol试剂提取各孔细胞RNA,根据反转录试剂盒说明书反转为cDNA,然后用实时荧光定量PCR检测试剂盒检测POSTN的mRNA或let-7c水平,分别以GAPDH或U6作为内参。反应条件:预变性95℃,10 min;变性95℃,30 s;退火58℃,30 s;延伸72℃,30 s;40个循环。采用2-ΔΔCt法比较POSTN mRNA或let-7c的相对变化。
1.2.4 Western blot 细胞裂解液与PMSF的混合液(100∶1)裂解细胞15 min,离心收集上清,BCA法测定蛋白质含量。将等量的蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,加入POSTN (1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶1 000)、cleaved Caspase-3(1∶1 000)及GAPDH(1∶1 000)等一抗,4℃孵育过夜后加相应二抗(1∶10 000),室温孵育1 h。用Odyssey红外激光成像系统进行扫描,以GAPDH为内参定量各条带的灰度值。
1.2.5 CCK-8法检测细胞活性 96孔培养板处理的细胞,弃去上清液,用PBS冲洗3次,于每孔中加入90 μl DMEM和10 μl CCK-8溶液,将培养板放置于培养箱内孵育4 h,在酶标仪上读取450 nm处的吸光度(A)值。细胞存活率(%)=处理组(A)/对照组(A)×100%。
1.2.6 流式细胞仪术检测细胞凋亡 96孔培养板处理的细胞,弃去上清液,用不含EDTA的胰蛋白酶消化,经PBS洗涤、离心后,弃上清液。每孔加入500 μl结合缓冲液重悬细胞,之后加入10 μl Annexin V-FITC,5 μl PI,避光室温孵育15 min,流式细胞仪检测细胞凋亡。
1.2.7 TUNEL检测细胞凋亡 按照TUNEL细胞凋亡检测试剂盒说明书进行。
1.2.8 双荧光素酶报告基因检测 将pGL3-POSTN 3’-UTR和pGL3-POSTN 3’-UTR mut质粒与let-7c mimic或mimic-NC,连同pRL-TK载体共转染到H9c2细胞中。转染48 h后,收集细胞,按照双荧光素酶报告基因检测试剂盒说明书检测荧光素酶活性。
1.3 统计学方法

2 结果
2.1 抑制POSTN表达提高H9c2心肌细胞活性
与HG组或si-NC+HG组比较,转染si-POSTN显著降低了高糖诱导的POSTN mRNA表达(1.56±0.21比4.52±0.51或4.95±0.58,均为P<0.05);与HG组比较,si-POSTN+HG组的POSTN蛋白相对表达明显降低(1.34±0.19比3.40±0.41,P<0.05);与control组比较,HG组或si-NC+HG组的细胞活性显著降低(58.25%±6.90%或53.64%±6.42%比105.79%±12.1%,均为P<0.05);与HG组或si-NC+HG组比较,si-POSTN+HG组的细胞活性(77.34%±8.28%)显著提高(均为P<0.05),见图1。

A:RT-PCR检测POSTN mRNA水平;B:Western blot检测POSTN蛋白表达;C:CCK-8法检测细胞活性。与control组比较,aP<0.05;与HG组或si-NC+HG组比较,bP<0.05图1 抑制POSTN表达提高H9c2心肌细胞活性
2.2 抑制POSTN表达降低高糖诱导的H9c2心肌细胞凋亡
流式细胞仪术检测细胞凋亡,与control组比较,HG组或si-NC+HG组的细胞凋亡率显著上升(31.43%±3.98%或33.24%±4.01%比1.12%±0.11%,均为P<0.05),与HG组或si-NC+HG组比较,si-POSTN+HG组的细胞凋亡率(17.95%±2.23%)显著降低(均为P<0.05)。进一步在H9c2细胞中单独过表达POSTN,发现与control组或pcDNA3.1组比较,pcDNA3.1-POSTN组的细胞凋亡率显著升高(10.24%±1.55%比1.23%±0.15%或2.56%±0.34%,均为P<0.05),见图2。
2.3 抑制POSTN影响凋亡相关蛋白的表达
Western blot检测细胞凋亡相关蛋白,与control组比较,HG组或si-NC+HG组中Bcl-2蛋白表达降低(0.53±0.07或0.48±0.06比1.00±0.14),Bax蛋白表达显著升高(3.02±0.38或3.36±0.40比1.00±0.15),cleaved Caspase-3蛋白表达也显著升高(3.57±0.44或3.68±0.45比1.00±0.14)(均为P<0.05)。与HG组或si-NC+HG组比较,si-POSTN+HG组中Bcl-2(0.81±0.10)蛋白表达升高,而Bax(1.82±0.21)和cleaved Caspase-3(1.95±0.24)蛋白表达下调(均为P<0.05),见图3。
2.4 抑制或过表达POSTN影响高糖诱导的H9c2心肌细胞凋亡
TUNEL检测细胞凋亡,与control组(6.00%±1.32%)比较,HG组(42.54%±2.60%)、si-NC+HG组(45.43%±4.90%)和pcDNA3.1+HG组(39.23%±5.62%)的细胞凋亡率均显著提高(均为P<0.05),并且数值相近;与HG组或si-NC+HG组比较,si-POSTN+HG组(18.42%±2.15%)的细胞凋亡率显著降低(均为P<0.05);而与HG组或pcDNA3.1+HG组比较,pcDNA3.1-POSTN+HG组(66.33%±4.34%)的细胞凋亡率显著上升(均为P<0.05),见图4。
2.5 POSTN是let-7c的一个靶基因
通过软件预测,POSTN的3’-UTR区含有let-7c的结合位点。通过双荧光素酶报告基因检测发现,与mimic-NC转染比较,let-7c mimic转染显著降低pGL3-POSTN 3’-UTR质粒的荧光素酶活性(P<0.05),而对pGL3-POSTN 3’-UTR mut质粒的荧光素酶活性无显著影响。与control组或mimic-NC组比较,let-7c mimic转染显著下调POSTN mRNA表达(0.33±0.05比1.00±0.14或1.05±0.16,均为P<0.05),POSTN蛋白表达也显著下降(0.40±0.08比1.00±0.13或0.99±0.14,均为P<0.05)。同时,与control组比较,高糖处理显著降低了let-7c在H9c2细胞中的表达(0.32±0.05比1.05±0.12,P<0.05),见图5。

A、B:流式细胞仪术检测H9c2细胞凋亡并行统计;C:RT-PCR检测POSTN mRNA水平;D:Western blot检测POSTN蛋白表达;E、F:流式细胞仪术检测H9c2细胞凋亡并行统计。与control组比较,aP<0.05;与HG组或si-NC+HG组比较,bP<0.05;与control组或pcDNA3.1组比较,cP<0.05图2 抑制POSTN表达降低高糖诱导的H9c2心肌细胞凋亡

与control组比较,aP<0.05;与HG组或si-NC+HG组比较,bP<0.05图3 抑制POSTN影响凋亡相关蛋白的表达
3 讨论
本研究通过建立高糖诱导的H9c2心肌细胞损伤模型,发现33 mmol/L葡萄糖处理H9c2细胞24 h能够显著抑制细胞活性并增加细胞凋亡,与此前的报道[5]一致。而且还发现,高糖处理显著上调了H9c2细胞中POSTN的表达,提示POSTN可能参与调控高糖诱导的细胞凋亡。因此,我们进一步通过转染POSTN的siRNAs抑制其表达或转染pcDNA3.1-POSTN质粒使其过表达,以明确POSTN对高糖诱导的细胞活性和细胞凋亡的生物学作用。
Shimoyama等[6]研究表明,POSTN在结肠炎相关的结肠癌中,能够通过诱导细胞凋亡来抑制肿瘤生长。袁东等[7]研究表明,POSTN在氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱导的人主动脉内皮细胞系中表达上调,而抑制POSTN后能够降低ox-LDL诱导的细胞凋亡。王雪丽等[8]研究表明,POSTN在瘢痕疙瘩间充质干细胞(keloid mesenchymal stem cells,KMLSCs)中的表达明显高于正常皮肤干细胞,而沉默其表达后可诱导KMLSCs凋亡并降低增殖能力。在本研究中,我们发现抑制POSTN表达后,显著降低了高糖诱导的H9c2细胞凋亡率,并提高了细胞活性,而过表达POSTN后,高糖诱导的H9c2细胞凋亡率进一步上升,表明POSTN对高糖诱导的心肌细胞凋亡调控也具有重要意义。
DCM中心肌细胞凋亡的机制比较复杂,其中线粒体介导的凋亡途径具有重要的意义。Bcl-2定位于线粒体外膜并参与调节线粒体膜完整性,能够抑制促凋亡蛋白的作用。而当促凋亡因子Bax激活时,刺激细胞色素C和其他凋亡线粒体蛋白释放到细胞质中以触发细胞凋亡。Caspase-3被认为是细胞凋亡过程中的终末剪切酶,由细胞色素C激活的Caspase-9激活后直接引起细胞凋亡,是细胞凋亡的关键执行者。因此,我们检测了Bcl-2、Bax和cleaved Caspase-3的表达水平,发现抑制POSTN表达后,显著抑制了高糖诱导的Bcl-2下调,同时抑制了Bax和cleaved Caspase-3的上调,表明POSTN能够通过线粒体凋亡途径来调控高糖诱导的心肌细胞凋亡。
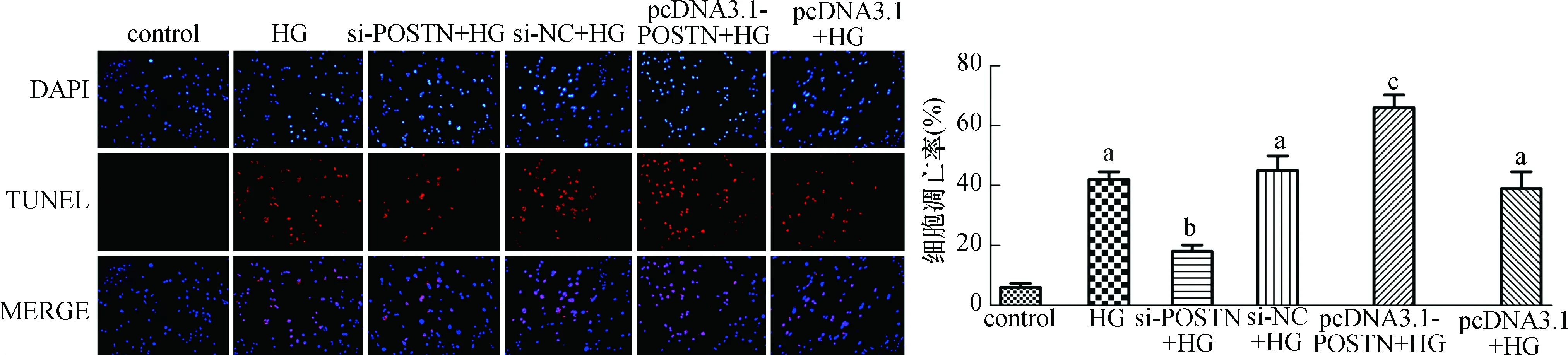
与control组比较,aP<0.05;与HG组或si-NC+HG组比较,bP<0.05;与HG组或pcDNA3.1+HG组比较,cP<0. 05图4 抑制或过表达POSTN影响高糖诱导的H9c2心肌细胞凋亡(×200)

A:双荧光素酶报告基因检测试剂盒检测荧光素酶活性;B:RT-PCR检测POSTN mRNA水平;C:Western blot检测POSTN蛋白表达;D:RT-PCR检测let-7c水平。与mimic-NC比较,aP<0.05;与control组或mimic-NC组比较,bP<0.05;与control组比较,cP<0.05图5 POSTN是let-7c的一个靶基因
我们进一步探讨了POSTN的可能调控分子。近年来的研究表明,微小RNAs(microRNAs,miRNAs)是一类重要的负向基因调控因子[9]。作为高度保守的单链非编码RNAs,miRNAs通过与其靶基因mRNA的3’-UTR结合而抑制该基因的转录或翻译,可调节多种疾病(包括DCM)中的细胞生长、分化和凋亡[10]。通过软件预测发现,let-7c与POSTN的3’-UTR之间具有互补序列。经过双荧光素酶报告基因检测证实了二者之间的直接靶向关系,且let-7c过表达显著抑制POSTN的表达,提示let-7c是POSTN的一个调控者。Let-7c属于let-7家族,在癌症[11]、心脏病[12]及糖尿病相关的动脉粥样硬化[13]的发展进程中均发挥重要作用,但在DCM中的作用还不清楚。我们检测了let-7c在高糖诱导的H9c2细胞中的表达,发现高糖处理显著降低了let-7c水平,与POSTN的高表达相反,提示在高糖诱导的H9c2细胞中let-7c可能通过调控POSTN的表达来调控细胞凋亡。但let-7c在DCM中的作用仍需进一步实验研究。
综上所述,POSTN在高糖诱导的心肌细胞中表达上调,抑制POSTN表达能够降低高糖诱导的线粒体凋亡途径依赖的细胞凋亡,提高细胞活性,而POSTN过表达能够加剧高糖诱导的细胞凋亡,且POSTN的表达和功能与let-7c的调控有关。本研究为理解DCM中心肌细胞凋亡机制提供了新的依据,但仅从细胞模型出发对POSTN的功能进行了研究,在今后的研究中应进一步从动物模型出发,以为DCM的临床防治提供实验基础。
利益冲突:无
——一道江苏高考题的奥秘解读和拓展