第70例:临床表现心悸、胸闷
方理刚
100730 中国医学科学院 北京协和医学院 北京协和医院心内科
患者女性,54岁,因“间断心悸、胸闷5年,加重10个月”于2012年8月16日入院。患者于2007年1月无诱因出现间断心悸、胸闷,活动后明显,每次发作2~8 min自行缓解,心电图示心房扑动,2∶1及4∶1传导,用胺碘酮后可转为窦性心律。2008年再发心悸,伴一过性黑矇,外院诊断为“房性心动过速、心房扑动、心房颤动”,拟行射频消融术,经食道超声心动图(TEE)示左房多处团块,考虑为附壁血栓,取消射频消融,予维拉帕米及华法林抗凝治疗。此后心悸仍有发作,每3个月当地医院复查TEE,左房团块无变化。2009年2月停华法林,此后病情平稳,可爬4层楼。2011年10月再次出现胸闷、气短,当地医院诊断“Ⅰ度房室传导阻滞”,停维拉帕米,予单硝酸异山梨酯治疗。2012年3月因“肺炎”出现胸闷、气短,并出现尿量减少、双下肢水肿,夜间不能平卧,外院超声心动图提示肺动脉收缩压90 mmHg,CT血管造影(CTA):冠状动脉无异常,双房增大,心包少量积液,左房内血栓形成,心肌病不除外,右侧胸腔积液,肺动脉增粗,右肺炎症伴部分肺不张。予利尿治疗后症状改善。
分析患者临床主要表现为房性心律失常,以及逐渐加重的全心衰竭。快室率心律失常可引起心力衰竭,包括射血分数保留(舒张性)的心力衰竭,以及心动过速性心肌病引起的射血分数减低(收缩性)的心力衰竭。患者多种快速房性心律失常反复发作,射频消融是最佳方案,但此患者因诊断左心房血栓而不能实施本操作。后患者因肺炎诱发严重心力衰竭,外院CTA提示双房增大、心肌病可能,表明患者可能存在基础心脏病,需行超声心动图进一步明确心室大小、左室射血分数及左房血栓情况。患者无持续性心房颤动/心房扑动,左心房内出现多发血栓可能性小。此外从重度肺动脉高血压的角度,需明确相关原因,如是否存在肺栓塞等血管病以及严重左心系统疾病。
患者既往无高血压、糖尿病、甲状腺功能亢进等病史。2005年1月腰背痛,外院曾诊断“骨癌”,接受钴60放疗1程。2006年7月CT示“T7-L1椎体前软组织影”,CT引导下活检,检出物为“蜡样”质软不脆白色软组织物,病理诊断“腹膜后纤维化”。2007年1月接受泼尼松60 mg/d治疗,逐渐减量至5 mg/d维持,同时静脉环磷酰胺治疗。2012年7月本院免疫科专科会诊认为特发性腹膜后纤维化证据不足。患者无烟酒嗜好。入院查体:血压108/66 mmHg,氧饱和度96%,颈静脉无怒张,P2>A2,双肺未闻及啰音,早搏1~2 bpm,二、三尖瓣区可闻及3/6级收缩期杂音。下肢不肿。
分析腹膜后纤维化是一种隐匿性起病的罕见病,多为特发性,也可能继发于其他原因,最初表现为主动脉炎,并引发主动脉周围纤维炎症反应。患者的椎体前软组织穿刺病理改变可能与放疗有关,放疗可引起继发性腹膜后纤维化。值得注意的是纵膈或胸部放疗,放疗可引起心血管损害,包括心包、瓣膜、冠状动脉、心肌及传导系统等均可受累[1]。患者有椎体放疗的病史,因此需要考虑本例心脏病变与放疗有关。
患者经胸超声心动图(TTE)复查示全心轻度增大(左室前后径56 mm,左房上下径54 mm,左右径39 mm),左室射血分数71%,主肺动脉增宽,二尖瓣后叶短小,左房内多发中等回声团块,位于房间隔下部、二尖瓣瓣环上方、左房顶部及侧壁,左室流入道狭窄,二尖瓣大量反流,三尖瓣中等量反流,估测肺动脉收缩压84 mmHg,下腔静脉21 mm(图1)。TEE(图2)所见同TTE。心电图示Ⅰ度房室传导阻滞,PR间期280 ms,室早二联律。血Ig亚类、补体(-)、抗ANA抗体(-)、类风湿因子(-)、免疫球蛋白、血沉正常,促甲状腺素(TSH)4.99 μIU/ml。血常规、肝肾功能、血脂正常,B型利钠肽209 ng/L。B超:双下肢动静脉(-),肝囊肿、左肾囊肿;肺动脉CT造影(CTPA):无肺栓塞改变,后纵膈、椎体前方、降主动脉右侧、食管右后方软组织影,延伸至肝门平面,包绕腹主动脉。血钾3.8 mmol/L,高敏C反应蛋白正常,血脂未见升高,D-二聚体0.34 mg/L,抗中性粒细胞胞浆抗体(-),抗心磷脂抗体IgG(-),抗β2糖蛋白1-IgG(-)。本院会诊外院穿刺组织病理:增生及玻璃样变的纤维组织。
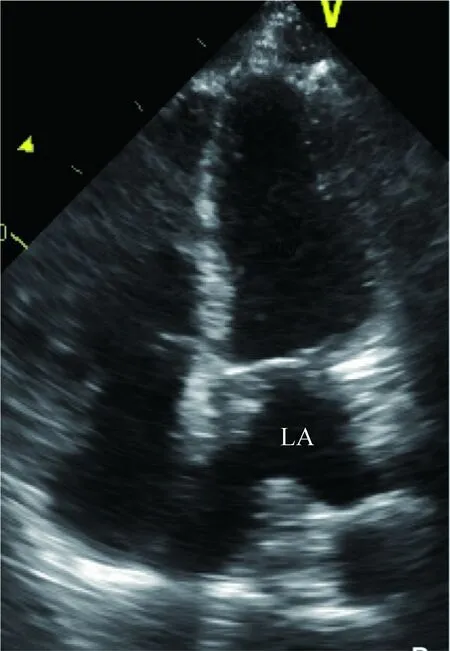
LA:左心房图1 经胸超声心动图心尖四腔切面示左房内有多个大小不等占位
分析本例需要与以下疾病鉴别:(1)左房肿瘤多为黏液瘤,黏液瘤多有蒂附着于房间隔,并有较大活动度,与本例左房多处固定的团块不符;(2)左房恶性肿瘤需进一步除外,但从时间上不太支持;(3)左房夹层或血肿,患者无创伤史、心内膜炎、有创心腔内操作等病史,心房夹层或血肿多呈中低回声,可有血流与心房腔相通,而本例心房占位呈实质性局部不规则形态;(4)Ig亚类正常,不存在IgG4相关疾病;(5)风湿性瓣膜病特征为瓣膜游离缘粘连,引起二尖瓣狭窄或关闭不全,本例的瓣叶联合处无瓣膜粘连表现,而狭窄部位在流入道起始部,而非瓣口,且左房内多发占位、房壁明显增厚不能以风湿性心脏病解释;(6)辅助检查除外了抗磷脂抗体综合征等一些自身免疫病;(7)D-二聚体和CTPA表明无肺栓塞。患者的心脏异常改变出现在放疗后,根据超声心动图结果,考虑放疗损害了二尖瓣及附属结构(瓣环)、左房,引起重度二尖瓣反流及流入道狭窄,同时实际左房容积因占位影响而减少,最终导致左房压力升高、重度肺高血压和全心衰竭,尤其在快速性房性心律时更易诱发心力衰竭。左房内占位范围广,较固定,不符合血栓的特点,且抗凝治疗无效。因此考虑左房占位性改变系放疗引起。利尿能暂时缓解心力衰竭,患者有心外科手术适应证。
患者于体外循环下行心外科手术。术中所见:左房顶增厚,最厚处12 mm,质地韧,环绕二尖瓣瓣环一圈也可见左房壁增厚,左室流入道明显增厚,二尖瓣前叶及三尖瓣增厚,二尖瓣后叶几乎完全贴于左室后壁无活动度,行二尖瓣生物瓣置换术、三尖瓣成形术及左房扩大成形术。左房内膜病理示退变的纤维组织伴玻璃样变,内见较多浆细胞和淋巴细胞浸润。术后肺动脉收缩压明显下降,为45 mmHg。术后10个月随访时无症状。
分析超声所见和心外科手术所见基本一致,病理提示左房内占位组织为纤维化组织,放疗引起如此严重的左心房纤维化罕见,文献报道很少,本例中放疗也引起了二尖瓣及其瓣环、三尖瓣受损。本例心律失常(Ⅰ度房室传导阻滞)及房性心律失常考虑也与放疗有关联。手术治疗后,患者血流动力学和症状明显改善。放疗引起心脏损害的机制涉及内皮损伤、氧化应激、细胞凋亡和坏死以及微小RNA等作用。研究认为放疗早期引起瓣膜挛缩,较长时间后瓣膜纤维化、增厚、钙化和狭窄,以及瓣下结构异常。放疗相关瓣膜病发生率为6%~15%,二尖瓣及主动脉瓣最常见,可能与左心压力高有关系。放疗后瓣膜病平均诊断时间10~20年。淋巴瘤纵膈放疗后6年,32%的患者存在无症状瓣膜病。霍奇金淋巴瘤放疗后30年瓣膜病发生率为20%,放疗后瓣膜病与放疗剂量相关。心脏接受放疗35 Gy以上剂量的患者,81%存在瓣膜功能异常和纤维化,多数放疗相关瓣膜病患者平均放疗剂量为46 Gy。一项包含1 852例接受放疗的淋巴瘤患者的队列研究显示,30年后放疗相关的瓣膜病的风险按放疗剂量<30 Gy、31~35 Gy、36~40 Gy、>40 Gy分别为3%、6%、9%和12%[2]。
本例提示,放疗可引起严重的心脏并发症,当一位患者同时存在瓣膜、心肌等多种心脏结构损害伴或不伴心律失常时,需要详细询问肿瘤治疗病史,警惕放疗相关的心血管病。左房内占位需要鉴别左房肿瘤、左房血栓、夹层和IgG4相关疾病等。
利益冲突:无