云南兔儿风的化学成分研究
吴蕾 李金杰 钟祥健 周娜 王欣 林鹏程
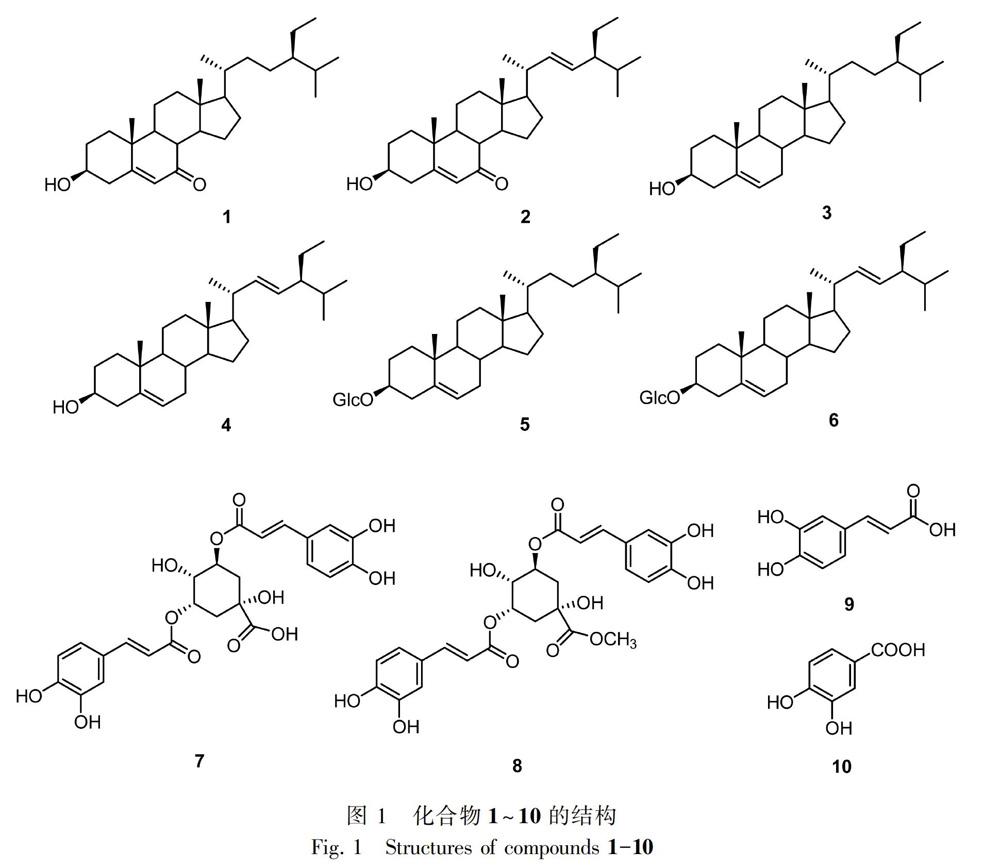
摘 要:为研究我国特有植物云南兔儿风的化学成分,该文采用常压正相硅胶色谱、凝胶色谱、低压氰基液相色谱和反相高压液相色谱等方法,对其乙醇提取物进行分离纯化并进行结构鉴定。结果表明:首次从云南兔儿风中分离并鉴定了10个化合物,包括6个甾体类、3个苯丙酸类和1个酚酸类,分别为3β-羟基豆甾-5-烯-7-酮(1)、3β-羟基豆甾-5,22-二烯-7-酮(2)、β-谷甾醇(3)、豆甾醇(4)、β-胡萝卜苷(5)、豆甾醇-3-O-葡萄糖苷(6)、3,5-O-二咖啡酰奎尼酸(7)、3,5-O-二咖啡酰奎尼酸甲酯(8)、咖啡酸(9)、原儿茶酸(10)。其中,化合物2和8是在兔儿风属中首次发现,所有化合物都是从云南兔儿风中首次发现。以上化合物的发现丰富了云南兔儿风的化学成分,为其合理、有效的应用提供了理论依据。
关键词:云南兔儿风,分离纯化,结构鉴定
中图分类号:Q946.8
文獻标识码:A
文章编号:1000-3142(2020)09-1375-06
Abstract:In order to study the chemical constituents,the ethanol extract of Ainsliaea yunnanensis was isolated and purified by the normal pressure silica column chromatography,Sephadex LH-20,the low pressure cyano chromatography and preparative high pressure liquid chromatography. Ten compounds were isolated and identified as 3β-hydroxystigmast-5-en-7-one(1),3β-hydroxystigmast-5,22-dien-7-one(2),β-sitosterol(3),stigmasterol(4),β-daucosterol(5),stigmasterol glucoside(6),3,5-O-dicaffeoylquinic acid(7),3,5-O-dicaffeoylquinic acid methyl ester(8),caffeic acid(9),protocatechuic acid(10). All compounds are isolated from this plant for the first time,and compounds 2 and 8 are isolated from this genus for the first time. The discovery of the compounds may enrich the chemical constituents of A. yunnanensis and provide a theoretical basis for its rational and effective application.
Key words:Ainsliaea yunnanensis,separation and purification,structure identification
云南兔儿风(Ainsliaea yunnanensis),又叫铜脚灵仙、燕麦灵,为菊科(Asteraceae)兔儿风属(Ainsliaea)植物,主要分布在我国云南、贵州等地,是我国特有的植物。在民间,它常被用于医治跌打挫伤、骨折和风湿筋骨痛等(王蓉等,2013)。据报道,云南兔儿风与其他中药联合使用可祛风活络镇痛、治疗类风湿性关节炎,还可制成祛湿镇痛的药酒(蓝子花,2006a,b;万超,2015);现代药理学研究发现,云南兔儿风与其他中药混合还可治疗胃炎、胃溃疡、胃肠道出血(王蓉等,2013),其乙醇粗提物还具有很好的抗肿瘤和抗炎活性(Li et al.,2016)。可见,云南兔儿风确实具有很好的药理活性,但其起作用的化学成分并不明确,同时,云南兔儿风的化学成分主要是倍半萜和三萜类化合物,而其他类型的化合物报道较少(Li et al.,2016;Wu et al.,2016;Fang et al.,2017)。
为明确云南兔儿风的药效物质基础及更全面地了解云南兔儿风的化学成分,笔者对其乙醇提取物中具有较好活性的乙酸乙酯部位进行了系统研究,运用各种色谱方法及结合波谱学技术从中发现了10个在该种中未报道过的结构(图1),分别为3β-羟基豆甾-5-烯-7-酮(1)、3β-羟基豆甾-5,22-二烯-7-酮(2)、β-谷甾醇(3)、豆甾醇(4)、β-胡萝卜苷(5)、豆甾醇-3-O-葡萄糖苷(6)、3,5-O-二咖啡酰奎尼酸(7)、3,5-O-二咖啡酰奎尼酸甲酯(8)、咖啡酸(9)、原儿茶酸(10),其中,化合物2和8是在兔儿风属中首次发现。
1 材料与仪器
材料:实验所用的药材于2009年11月采自云南省楚雄市大桃县,由中国科学院昆明植物研究所卢金梅副研究员鉴定为兔儿风属(Ainsliaea)植物云南兔儿风(Ainsliaea yunnanensis);标本(编号为20091105)存放于北京联合大学应用文理学院实验楼802室。
仪器:Inova 500核磁共振仪(美国Varian公司);Q Exactive Plus超高分辨率液质联用仪(美国Thermo公司);高压液相色谱仪(美国Waters公司);CombiFlash EZ全自动低压/中压制备液相色谱仪(美国ISCO公司);纯水机(美国Pall公司);Buchi旋转蒸发仪(瑞士Buchi公司);TRU-SWEEPTM D型紫外灯(美国Crest公司);超声波清洗仪(美国Crest公司);Sephadex LH-20型葡聚糖凝胶(瑞典Pharmacia公司);160 ~ 200目柱色谱硅胶和GF254型薄层色谱硅胶 (中国青岛海洋化工厂);分析纯溶剂(中国北京化学试剂厂);色谱级溶剂(美国Fisher公司);质谱级溶剂(美国Thermo公司)。
2 提取与分离
干燥的云南兔儿风茎叶10.0 kg,粉碎后,过40目筛,依次用不同浓度的乙醇溶液(95%、80%和70%)进行超声提取,每次提取120 min,将三次提取液合并后浓缩得到浸膏。将所得浸膏分散于蒸馏水中,然后用有机溶剂进行萃取,得到石油醚相、乙酸乙酯相和正丁醇相。
将乙酸乙酯相(102.5 g)过正相硅胶柱,用不同比例的氯仿-甲醇梯度洗脱,最终得到7个组分Fr.Y-1-Fr.Y-7。根据薄层板情况,将Fr.Y-1组分进行凝胶柱色谱分离,用石油醚-氯仿-甲醇(1∶1∶0.2)洗脱,得到6个组分Fr.Y-1-1-Fr.Y-1-6,其中Fr.Y-1-2中有白色沉淀析出,过滤得沉淀,将沉淀部分用制备型高压液相(甲醇-水 100∶0)进行纯化,得到化合物3(43.2 mg)和4(36.5 mg);Fr.Y-1-3组分采用低压氰基液相色谱反复纯化后,用制备型高压液相(甲醇-水95∶5)进行纯化,得到化合物1(17.2 mg)和2(13.5 mg);Fr.Y-2组分有白色沉淀析出,过滤得沉淀,将沉淀用制备型高压液相(甲醇-水 100∶0)进行制备,得到化合物5(83.2 mg)和6(80.5 mg);Fr.Y-2组分母液部分进行凝胶柱色谱分离,用氯仿-甲醇(1∶0.5)洗脱,
得到8个组分Fr.Y-2-1-Fr.Y-2-8,然后将Fr.Y-2-5组分采用低压氰基液相色谱反复纯化后,用制备型高压液相(甲醇-水40∶60)进行制备,得到化合物9(23.2 mg)和10(21.5 mg);Fr.Y-3组分反复上凝胶柱色谱纯化,用氯仿-甲醇(1∶0.5)洗脱,得到10个组分Fr.Y-3-1-Fr.Y-3-10,Fr.Y-3-9组分用制备型高压液相(甲醇-水 48∶52)进行制备,得到化合物7(13.8 mg)和8(15.7 mg)。
3 结构鉴定
化合物1 白色粉末状。HR-ESI-MS m/z:429.3723 [M+H]+(计算相对分子质量C29H49O2,429.3727);分子式C29H48O2。1H-NMR(500 MHz,CDCl3) δ:5.69(1H,s,H-6),3.67(1H,m,H-3),1.20(3H,s,H-19),0.93(3H,d,J=7.5 Hz,H-21),0.85(3H,t,J=7.5 Hz,H-29),0.83(3H,d,J=7.0 Hz,H-26),0.81(3H,d,J=7.0 Hz,H-27),0.68(3H,s,H-18);13C-NMR(125 MHz,CDCl3) δ:36.5(C-1),31.4(C-2),70.7(C-3),42.0(C-4),165.2(C-5),126.3(C-6),202.4(C-7),45.6(C-8),50.1(C-9),38.9(C-10),21.4(C-11),38.4(C-12),43.3(C-13),50.1(C-14),26.5(C-15),28.7(C-16),54.9(C-17),12.1(C-18),17.5(C-19),36.2(C-20),19.1(C-21),34.1(C-22),26.3(C-23),46.0(C-24),29.3(C-25),19.9(C-26),19.2(C-27),23.2(C-28),12.1(C-29)。以上数据与文献(尚小雅等,2008)报道的3β-羟基豆甾-5-烯-7-酮的数据一致。
化合物2 白色粉末状。HR-ESI-MS m/z:427.3567 [M+H]+(计算相对分子质量 C29H47O2,427.3571);分子式C29H46O2。1H-NMR(500 MHz,CDCl3) δ:5.69(1H,s,H-6),5.17(1H,dd,J=15.0,8.5 Hz,Ha-22),5.03(1H,dd,J=15.0,8.5 Hz,Ha-23),3.67(1H,m,H-3),1.20(3H,s,H-19),1.02(3H,d,J=7.0 Hz,H-21),0.85(3H,t,J=7.5 Hz,H-29),0.81(3H,d,J=7.0 Hz,H-26),0.79(3H,d,J=7.0 Hz,H-27),0.68(3H,s,H-18);13C-NMR(125 MHz,CDCl3) δ:36.5(C-1),31.4(C-2),70.7(C-3),42.0(C-4),165.2(C-5),126.3(C-6),202.3(C-7),45.6(C-8),50.1(C-9),38.7(C-10),21.2(C-11),38.4(C-12),43.1(C-13),50.2(C-14),26.6(C-15),29.2(C-16),54.8(C-17),12.4(C-18),17.5(C-19),40.4(C-20),19.2(C-21),138.2(C-22),129.7(C-23),51.4(C-24),32.0(C-25),21.6(C-26),21.4(C-27),25.5(C-28),12.4(C-29)。以上数据与文献(尚小雅等,2008)报道的3β-羟基豆甾-5,22-二烯-7-酮的数据一致。
化合物3 白色粉末状。HR-ESI-MS m/z:413.3775 [M-H]-(计算相对分子质量 C29H49O,413.3778);分子式C29H50O。1H-NMR(500 MHz,CDCl3) δ:5.34(1H,m,H-6),3.52(1H,m,H-3),1.03(3H,s,H-19),1.01(3H,d,J=7.0 Hz,H-21),0.85(3H,t,J=6.5 Hz,H-29),0.82(3H,d,J=7.0 Hz,H-26),0.80(3H,d,J=7.0 Hz,H-27),0.70(3H,s,H-18);13C-NMR(125 MHz,CDCl3) δ:37.3(C-1),31.7(C-2),71.8(C-3),42.3(C-4),140.8(C-5),121.7(C-6),31.9(C-7),32.0(C-8),50.1(C-9),36.5(C-10),21.1(C-11),39.8(C-12),42.3(C-13),56.8(C-14),24.3(C-15),29.2(C-16),56.1(C-17),11.8(C-18),19.4(C-19),37.3(C-20),21.2(C-21),23.1(C-22),26.1(C-23),45.9(C-24),34.0(C-25),19.0(C-26),21.1(C-27),24.3(C-28),12.0(C-29)。以上數据与文献(吴希等,2008)报道的β-谷甾醇的数据一致。
化合物4 白色粉末状。HR-ESI-MS m/z:413.3776 [M+H]+(计算相对分子质量 C29H49O,413.3778);分子式C29H48O。1H-NMR(500 MHz,CDCl3) δ:5.35(1H,m,H-6),5.15(1H,dd,J=15.0,8.5 Hz,Ha-22),5.02(1H,dd,J=15.0,8.5 Hz,Ha-23),3.52(1H,m,H-3),1.03(3H,s,H-19),1.01(3H,d,J=7.0 Hz,H-21),0.85(3H,t,J=6.5 Hz,H-29),0.82(3H,d,J=7.0 Hz,H-26),0.80(3H,d,J=7.0 Hz,H-27),0.70(3H,s,H-18);13C-NMR(125 MHz,CDCl3) δ:37.3(C-1),31.7(C-2),71.8(C-3),42.3(C-4),140.8(C-5),121.7(C-6),31.9(C-7),32.0(C-8),50.2(C-9),36.5(C-10),21.1(C-11),39.7(C-12),42.2(C-13),56.9(C-14),24.4(C-15),28.9(C-16),56.0(C-17),12.0(C-18),19.4(C-19),40.5(C-20),21.2(C-21),138.3(C-22),129.3(C-23),51.2(C-24),32.0(C-25),19.0(C-26),21.1(C-27),25.4(C-28),12.2(C-29)。以上数据与文献(吴希等,2008)报道的豆甾醇的数据一致。
化合物5 白色粉末状。HR-ESI-MS m/z:599.4274 [M+Na]+(计算相对分子质量C35H60O6Na,599.4282);分子式C35H60O6。1H-NMR(500 MHz,pyr) δ:5.37(1H,br s,H-6),5.09(1H,m,H-1′),4.45(1H,m,H-3),1.01(3H,d,J=7.0 Hz,H-21),0.95(3H,s,H-19),0.91(3H,t,J=6.5 Hz,H-29),0.89(3H,d,J=7.0 Hz,H-26),0.88(3H,d,J=7.0 Hz,H-27),0.67(3H,s,H-18);13C-NMR(125 MHz ,pyr) δ:39.8(C-1),29.9(C-2),79.0(C-3),40.4(C-4),141.4(C-5),122.4(C-6),34.7(C-7),30.8(C-8),50.8(C-9),25.2(C-10),20.5(C-11),26.8(C-12),43.0(C-13),57.3(C-14),23.9(C-15),29.9(C-16),56.7(C-17),12.5(C-18),19.7(C-19),37.4(C-20),19.7(C-21),36.9(C-22),38.0(C-23),46.5(C-24),29.1(C-25),19.5(C-26),20.0(C-27),21.8(C-28),12.7(C-29),103.1(C-1′),75.8(C-2′),79.1(C-3′),72.1(C-4′),78.6(C-5′),63.3(C-6′)。以上数据与文献(黄斌等,2018)报道的β-胡萝卜苷的数据基本一致。
化合物6 白色粉末状。HR-ESI-MS m/z:597.4120 [M+Na]+(计算相对分子质量 C35H58O6Na,597.4126);分子式C35H58O6。1H-NMR(500 MHz,pyr) δ:5.37(1H,br s,H-6),5.22(1H,dd,J=8.0,16.0 Hz,H-22),5.10(1H,m,H-1′),5.08(1H,dd,J=8.0,16.0 Hz,H-23),1.10(3H,d,J=7.0 Hz,H-21),0.95(3H,s,H-19),0.94(3H,t,J=6.5 Hz,H-29),0.90(3H,d,J=7.0 Hz,H-26),0.88(3H,d,J=7.0 Hz,H-27),0.69(3H,s,H-18);13C-NMR(125 MHz,pyr) δ:37.9(C-1),30.7(C-2),79.1(C-3),39.8(C-4),141.4(C-5),122.4(C-6),32.6(C-7),32.7(C-8),51.9(C-9),37.4(C-10),22.0(C-11),41.3(C-12),42.8(C-13),56.5(C-14),25.0(C-15),29.8(C-16),57.4(C-17),13.0(C-18),19.9(C-19),40.3(C-20),21.8(C-21),139.3(C-22),129.9(C-23),50.8(C-24),32.5(C-25),19.7(C-26),21.7(C-27),26.2(C-28),12.6(C-29),103.0(C-1′),75.8(C-2′),79.0(C-3′),72.1(C-4′),78.5(C-5′),63.3(C-6′)。以上數据与文献(潘兰等,2015)报道的豆甾醇-3-O-葡萄糖苷的数据基本一致。
化合物7 淡黄色油状。HR-ESI-MS m/z:515.1191 [M-H]-(计算相对分子质量 C25H23O12,515.1184);分子式C25H24O12。1H-NMR(500 MHz,CD3OD) δ:7.55(1H,d,J = 16.0 Hz,H-7′),7.52(1H,d,J = 16.0 Hz,H-7″),7.02(2H,t,J=1.5 Hz,H-2′,H-2″),6.93(2H,m,H-6′,H-6″),6.74(2H,d,J = 8.0 Hz,H-5′,H-5″),6.31(1H,d,J = 16.0 Hz,H-8′),6.22(1H,d,J = 16.0 Hz,H-8″),5.39(1H,m,H-5),5.34(1H,m,H-3),3.94(1H,m,H-4),2.00-2.30(4H,m,H-2,H-6);13C-NMR(125 MHz,CD3OD) δ:72.5(C-1),36.0(C-2),70.6(C-3),74.7(C-4),72.1(C-5),37.6(C-6),177.4(C-7),127.9(C-1′),115.1(C-2′),147.3(C-3′),149.6(C-4′),115.5(C-5′),123.1(C-6′),147.1(C-7′),116.4(C-8′),168.9(C-9′),127.8(C-1″),115.1(C-2″),146.8(C-3″),149.5(C-4″),116.4(C-5″),123.0(C-6″),146.8(C-7″),115.2(C-8″),168.3(C-9″)。以上数据结合化合物8的数据及与文献(元超等,2019)对比,故鉴定化合物为3,5-O-二咖啡酰奎尼酸。
化合物8 淡黄色油状。HR-ESI-MS m/z:529.1347 [M-H]-(计算相对分子质量 C26H25O12,529.1341);分子式C26H26O12。1H-NMR(500 MHz,CD3OD) δ:7.59(1H,d,J = 16.0 Hz,H-7′),7.51(1H,d, J = 16.0 Hz,H-7″),7.02(2H,t,J=1.5 Hz,H-2′,H-2″),6.93(2H,m,H-6′,H-6″),6.76(2H,d,J = 8.0 Hz,H-5′,H-5″),6.31(1H,d,J = 15.0 Hz,H-8′),6.19(1H,d, J = 15.0 Hz,H-8″),5.36(1H,m,H-5),5.28(1H,m,H-3),3.95(1H,m,H-4),3.65(1H,s,OMe-7),2.14/2.28(4H,m,H-2,H-6);13C-NMR(125 MHz,CD3OD) δ:72.2(C-1),35.6(C-2),69.7(C-3),74.6(C-4),72.0(C-5),36.7(C-6),175.6(C-7),127.8(C-1′),115.2(C-2′),147.4(C-3′),149.7(C-4′),115.4(C-5′),123.1(C-6′),147.1(C-7′),116.5(C-8′),168.8(C-9′),127.6(C-1″),114.8(C-2″),146.8(C-3″),149.5(C-4″),116.5(C-5″),123.0(C-6″),146.8(C-7″),115.3(C-8″),167.9(C-9″),53.0(OMe-7)。以上数据与文献(元超等,2019)报道的3,5-O-二咖啡酰奎尼酸甲酯的数据基本一致。
化合物9 淡黄色粉末状。HR-ESI-MS m/z:179.0348 [M-H]-(计算相对分子质量 C9H7O4,179.0339);分子式C9H8O4。1H-NMR(500 MHz,DMSO) δ:7.40(1H,d,J=15.0 Hz,H-7),7.02(1H,s,H-2),6.96(1H,d,J=10.0 Hz,H-6),6.75(1H,d,J=10.0 Hz,H-5),6.17(1H,d,J=15.0 Hz,H-8);13C-NMR(125 MHz,DMSO) δ:125.7(C-1),114.7(C-2),144.7(C-3),148.2(C-4),115.2(C-5),121.2(C-6),145.6(C-7),115.8(C-8),168.0(C-9)。以上数据与文献(付鸣等,2019)报道的咖啡酸的数据基本一致。
化合物10 淡黄色粉末状。HR-ESI-MS m/z:153.0193 [M-H]-(计算相对分子质量 C7H5O4,153.0182);分子式C7H6O4。1H-NMR(500 MHz,CD3OD) δ:7.34(2H,m,H-2,H-6),6.70(1H,d,J=10.0 Hz,H-5);13C-NMR(125 MHz,CD3OD) δ:123.0(C-1),117.7(C-2),146.0(C-3),151.5(C-4),115.7(C-5),123.9(C-6),170.2(C-7)。以上数据与文献(张艳军等,2017)报道的原儿茶酸的数据基本一致。
4 讨论与结论
本研究从云南兔儿风的干燥茎叶中共分离得到10个化合物,包括6个甾体类、3个苯丙酸类和1个酚酸类,全部是从该种中首次分离得到,这些化合物的发现丰富了云南兔儿风的化学成分和种类。通过查阅文献发现,部分化合物具有一定的抗肿瘤和抗炎活性。化合物3和4对人肝癌細胞SMMC-7721的增殖具有抑制作用,并能诱导该细胞的凋亡(李庆勇等,2012);同时,化合物3和4具有抗急性结肠炎活性,能缓解由葡聚糖酸钠(DSS)引起的小鼠结肠炎的症状(冯思敏等,2018);另外,化合物3与阿司匹林联合使用,可减轻其副作用所产生的胃粘膜损伤,使阿司匹林的抗炎作用增强(肖志彬等,2016);化合物9和10能显著降低炎症细胞所产生的TNF-α及IL-6(林珠灿,2014);化合物10现在临床被用于治疗慢性气管炎。以上研究发现云南兔儿风具有抗肿瘤和抗炎活性,这些化合物的发现为其药理学应用提供了理论依据。
参考文献:
FANG X,XU XK,WANG GW,et al.,2017. Guaianolide sesquiterpenoids from Ainsliaea yunnanensis [J]. Phytochemistry(Elsevier),139:47-55.
FENG SM,NING K,SHAO P,et al.,2018. Research on the β-sitosterol and stigmasterol therapeutic effect of acute colitis in mice [J]. J Chin Cere Oils Assos,33(12):80-86. [冯思敏,宁可,邵平,等,2018. β-谷甾醇和豆甾醇对小鼠急性结肠炎的治疗作用研究 [J]. 中国粮油学报,33(12):80-86.]
FU M,PAN D,XU Z,et al.,2019. Chemical constituents from Arisaema ammrense [J]. J Chin Med Mat,42(8):1793-1795. [付鸣,潘多,许枬,等,2019. 东北天南星的化学成分研究 [J]. 中药材,42(8):1793-1795.]
HUANG B,JIN C,HE YQ,et al.,2018. Chemical constituents of Punica granatum flower [J]. Chin J Exper Trad Med Form,24(1):79-82. [黄斌,金晨,何玉琴,等,2018. 石榴花的化学成分分离鉴定 [J]. 中国实验方剂学杂志,24(1):79-82.]
LAN ZH,2006a. Activating analgesics from Ainsliaea yunnanensis [P]. China:1813903A. [蓝子花,2006a. 一种燕麦灵活络镇痛药 [P]. 中国:1813903A.]
LAN ZH,2006b. The invention relates to a red onion wood clearing damp analgesic liquor [P]. China:1813986A. [蓝子花,2006b. 一种红葱木祛湿镇痛药酒 [P]. 中国:1813986A.]
LI JJ,ZHANG B,LIU HL,et al.,2016. Triterpenoids from Ainsliaea yunnanensis Franch. and their biological activities [J]. Molecules,21:1481-1488.
LI QY,JIANG CF,ZHANG L,et al.,2012. Apoptosis-inducing effect of β-sitosterol and stigmasterol on human liver cancer SMMC-7721 cells [J]. Lishizhen Med Mat Med Res,23(5):1173-1175. [李庆勇,姜春菲,张黎,等,2012. β-谷甾醇、豆甾醇诱导人肝癌细胞SMMC-7721凋亡 [J]. 时珍国医国药,23(5):1173-1175.]
LIN ZC,2014. Studies on hemostatic and anti-inflammatory effective substances of Sedum aizoon L. and its quality evaluation [D]. Nanjing:Nanjing University of Chinese Medicine:95-96. [林珠灿,2014. 景天三七止血、抗炎物质基础与质量评价的研究 [D]. 南京:南京中医药大学:95-96.]
PAN L,JIA XY,SHI MH,et al.,2015. Studies on the chemical constituents of cultived Cichorium glandulosum Boiss. et Huet [J]. J Xinjiang Med Univ,38(9):1088-1090. [潘兰,贾新岳,石明辉,等,2015. 维药毛菊苣化学成分研究 [J]. 新疆医科大学学报,38(9):1088-1090.]
SHANG XY,WANG RL,YIN SQ,et al.,2008. Steroids from Monascus purpureus metabolite [J]. Chin J Chin Mat Med,34(14):1809-1811. [尚小雅,王若兰,尹素琴,等,2008. 紫红曲代谢产物中的甾体成分 [J]. 中国中药杂志,34(14):1809-1811.]
WAN C,2015. Traditional chinese medicine for the treatment of rheumatoid arthritis and preparation methods [P]. China:105125978 A. [万超,2015. 一种用于治疗类风湿性关节炎的中药制剂及制备方法 [P]. 中国:105125978A.]
WANG R,SUN Z,WANG AL,et al.,2013. GC-MS analysis of low polar components from Ainsliaea yunnanensis [J]. J Chin Med Mat,36(1):61-64. [王蓉,孙珍,王阿利,等,2013. 云南兔儿风小极性成分GC-MS分析 [J]. 中药材,36(1):61-64.]
WU X,XIA HL,HUANG LH,et al.,2008. Study on the chemical constituents of Rhizoma cyperi [J]. J Chin Med Mat,31(7):990-993. [吴希,夏厚林,黄立华,等,2008. 香附化学成分研究 [J]. 中药材,31(7):990-993.]
WU XL,XIONG XJ,LU WQ,et al.,2016. New sesquiterpenenoids from Ainsliaea yunnanensis [J]. Molecules,21(8): 1031-1043.
XIAO ZB,LIU XL,CHENG RQ,et al.,2016. Influence of β-sitosterol on gastric mucosal side effect induced by aspirin and its pharmacological functions [J]. Chin J Exper Trad Med Form,22(1):148-152. [肖志彬,劉小雷,成日青,等,2016. β-谷甾醇对阿司匹林致胃黏膜损伤副作用及其药理作用的影响 [J]. 中国实验方剂学杂志,22(1):148-152.]
YUAN C,WANG HF,HU X,et al.,2019. Chlorogenic acid constituents from Blumea balsamifera(L.) DC. [J]. Chin J Trop Crops,40(6):1176-1180. [元超,王鸿发,胡璇,等,2019. 艾纳香中绿原酸类化学成分研究 [J]. 热带作物学报,40(6):1176-1180.]
ZHANG YJ,NIU H,ZHOU DX,et al.,2017. Chemical constituents of Mallotus conspurcatus [J]. Chin Trad Herb Drugs,48(11):2172-2176. [张艳军,聂辉,周德雄,等,2017. 桂野桐化学成分的研究 [J]. 中草药,48(11):2172-2176.]
(责任编辑 何永艳)

