华石斛化学成分研究Ⅱ
蔡彩虹 谭彩银 陈惠琴 王昊 梅文莉 宋希强 戴好富
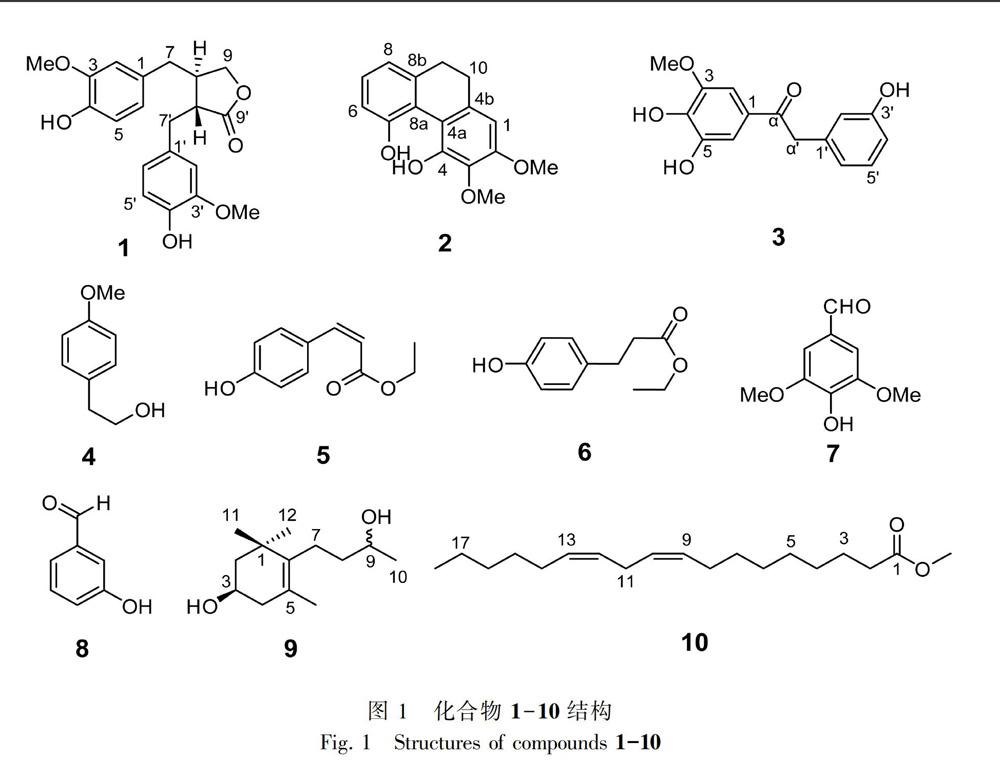

摘 要:海南特有植物华石斛(Dendrobium sinense)的化学成分和药理活性研究报道较少。为了深入研究华石斛的化学成分,该研究采用MCI小孔树脂柱色谱、硅胶柱色谱和Sephadex LH-20柱色谱等多种现代分离纯化技术,从其全草乙醇提取物的乙酸乙酯部位中分离纯化了10个化合物。结果表明:对分离纯化得到的10个化合物鉴定为罗汉松脂素(1)、4,5-二羟基-2,3-二甲氧基-9,10-二氢菲(2)、华石斛素C(3)、对甲氧基苯乙醇(4)、顺式对羟基肉桂酸乙酯(5)、对羟基苯丙酸乙酯(6)、丁香醛 (7)、3-羟基苯甲醛(8)、3,9-dihydroxy-megastigma-5-ene(9)和 (9Z,12Z)-9,12-二烯十八碳酸甲酯(10)。其中,首次从华石斛中分离得到的有化合物1、4-6、8-10。通过体外抑制乙酰胆碱酯酶活性实验发现,化合物2、4和化合物 9能够使乙酰胆碱酯酶活力下降。
关键词:华石斛,化学成分,乙酰胆碱脂酶抑制活性
中图分类号:Q946
文献标识码:A
文章编号:1000-3142(2020)09-1368-07
Abstract:As the Hainan endemic plant,Dendrobium sinense was reported rarely about their chemical constituents and pharmacological activities. In order to comprehensively study the chemical constituents of this species,various column chromatography including MCI,silica gel and Sephadex LH-20 were conducted,through which ten compounds were isolated from the ethyl acetate fraction of ethanol extraction of the whole herb. On the basis of the physical data and spectral analysis,the structures were identified as matairesinol (1),4,5-dihydroxy-2,3-dimethoxy-9,10-dihydrophenanthrene (2),dendrosinen C (3),4-methoxy-phenylethanol (4),eis-p-hydroxyl ethyl cinnamate (5),p-hydroxyphenylpropionic ethyl ester (6),syringaldehyde (7),3-hydroxybenzaldehyde (8),3,9-dihydroxy-megastigma-5-ene (9) and (9Z,12Z)-methyl octadeca-9,12-dienoate (10). Compounds 1,4-6,8-10 were obtained from this plant for the first time. The bioactivity results indicated that compounds 2,4 and 9 showed a certain acetylcholinesterase inhibitory activity.
Key words:Dendrobium sinense,chemical constituents,acetylcholinesterase (AChE) inhibitory activity
在中國,兰科(Orchidaceae)石斛属(Dendro-bium)植物的药用价值最早记载于《神农本草经》,被誉为“药中之上品”。20世纪30年代日本研究者发现了石斛碱,自此,国内外研究者陆续发现石斛属植物的化学成分主要有生物碱类、芪类、多糖类和倍半萜类化合物(王东晖等,2019)。近年来,国内外学者通过科学研究发现石斛能够清除羟基自由基、DPPH和ABTS自由基,抗氧化作用很强(魏明等,2016;唐静月等,2017);能够作为醛糖还原酶抑制剂,为治疗糖尿病性白内障提供新的方向(Wu et al.,2017);能够抑制白血病、肺癌H460、膀胱癌EJ和结肠癌Caco-2等细胞的增值,具有显著的抗肿瘤作用(朱启彧等,2013;Charoenrungruang et al.,2014;葛晓军等,2015)。此外,石斛在抗凝血、抗血栓、增强免疫力、抗突变和抗炎等方面还具有较好作用(徐悦等,2019)。
石斛属植物华石斛(Dendrobium sinense)在中国仅产海南(谭彩银等,2017),自然分布于海南保亭、琼中、乐东和白沙等中西部海拔1 000 m以上地区。由于华石斛种子自然萌发率低,对生长条件要求高,因此资源稀少,目前很少有关于华石斛的化学成分研究报道。本课题组科研人员前期研究从华石斛全草中分离得到了菲类、联苄类和木脂素类等44个化合物,并且发现菲类和联苄类化合物对3种肿瘤细胞(人肝癌细胞BEL-7402、人慢性髓原白血病细胞K562和人胃癌细胞SGC-7901)具有毒杀作用,能抑制金黄色葡萄球菌和白色念珠菌的生长,还具有乙酰胆碱酯酶抑制活性(陈秀娟,2013;Chen et al.,2013,2014;谭彩银等,2017)。本研究在前人工作基础上深入研究华石斛的化学成分,采用MCI小孔树脂柱色谱、硅胶柱色谱、Sephadex LH-20柱色谱等多种现代分离纯化技术从华石斛乙醇提取物的乙酸乙酯部分中共分离鉴定了10个化合物,首次从华石斛中分离得到的化合物有7个,其中3个化合物能够降低乙酰胆碱酯酶的活力,该发现为乙酰胆碱酯酶抑制剂的研究提供更多的化学结构基础。
1 材料与方法
1.1 材料
所用植物材料华石斛由海南大学林学院海南省热带特色花木资源生物学重点实验室提供,宋希强教授于2015年11月在海南霸王岭采集得到。
1.2 仪器和试剂
德国Bruker公司超导核磁共振波谱仪(AV-500型),TMS为内标;日本东京理化小型旋转蒸发仪(N-1300V-W,2L);日本東京理化大型旋转蒸发仪(N-4000,20L);美国Thermo Fisher酶标仪(Multiskan FC);德国Bruker公司质谱仪(amaZon SL);梅特勒-托利多国际贸易(上海)有限公司万分之一天平(ME204)。小孔吸附树脂(MCI)填充材料和十八烷基硅烷键合硅胶填料(ODS,20 ~ 45SymbolmA@m)购自日本 Fuji公司;200~300目和60~80目的柱层析硅胶G以及薄层层析硅胶板(GF254,10 mm × 50 mm)购自青岛海洋化工有限公司;工业乙醇以及分析纯有机溶剂(氯仿、甲醇、乙腈等)购自广州化学试剂厂;不同规格的色谱柱、圆底烧瓶和三角瓶等玻璃实验用品购自北京欣维尔玻璃仪器有限公司。其他药品(碘化硫代乙酰胆碱、乙酰胆碱酯酶、 二硫代二硝基苯甲酸DNTB和他克林
tacrine)为西格玛奥德里奇(上海)贸易有限公司提供。
1.3 提取和分离
阴干华石斛全草粉碎后(3.8 kg)加入95%工业乙醇,经加热回流提取得到乙醇提取物,然后分散于水中分别用石油醚、乙酸乙酯和正丁醇萃取,浓缩后,乙酸乙酯部分(80.2 g)经200~300目减压硅胶柱色谱,以石油醚-乙酸乙酯(9∶1 ~ 1∶9,V/V)混合溶剂为流动相进行梯度洗脱,收集洗脱液,通过薄层色谱(TLC)分析然后合并相同流分,得到8个组分(Fr.1-Fr.8)。
Fr.2(13.5 g)先通过,经十八烷基硅烷键合硅胶(ODS)柱,用甲醇-水(9∶1~1∶9,V/V)混合溶剂为流动相进行洗脱,每次洗脱体积约1.5 L,通过薄层色谱(TLC)分析然后合并相同流分,得到12个亚组份(Fr.2-1-Fr.2-12)。Fr.2-1-Fr.2-12分别取Fr.2-1(49.0 mg)、Fr.2-2(256.0 mg)、Fr.2-4(124.0 mg)和Fr.2-12(210.0 mg)经多次正相硅胶柱色谱(不同体积比的石油醚-乙酸乙酯为流动相)、Sephadex LH-20(纯甲醇、纯氯仿和氯仿-甲醇混合溶剂为流动相)凝胶柱色谱以及ODS柱色谱(不同体积比的甲醇-水为流动相),Fr.2-1分离得到化合物10(8.3 mg),Fr.2-2分离得到化合物5(20.5 mg)和6(7.7 mg),Fr.2-4分离得到化合物7(10.1 mg)和8(10.1 mg),Fr.2-12分离得到化合物9(6.0 mg)和4(14.2 mg)。同样,Fr.4(3.2 g)和Fr.7(8.2 g)通过相同的分离手段得到化合物3(56.5 mg)、2(6.7 mg)和1(14.0 mg)。
2 结果与分析
2.1 结构鉴定
化合物1 白色粉末,ESI-MS m/z:[M + Na]+ 381.3,分子式C20H22O6。1H-NMR (CD3OD,500 MHz):δH 6.71 (1H,d,J = 8.0 Hz,H-5′),6.68 (1H,d, J = 8.0 Hz,H-5),6.65 (1H,d,J = 1.9 Hz,H-2′),6.56 (1H,dd,J = 8.0,1.9 Hz,H-6′),6.52 (1H,br s,H-2),6.47 (1H,br d,J = 8.0 Hz,H-6),4.10 (1H,m,H-9a),3.86 (1H,m,H-9b),3.76 (3H,s,3-OMe),3.75 (3H,s,3′-OMe),2.85 (1H,dd,J = 13.9,5.4 Hz,H-7′a),2.77 (1H,dd,J = 13.9,7.1 Hz,H-7′b),2.60 (1H,m,H-8′),2.45 (3H,m,H-7,8); 13C-NMR (CD3OD,125 MHz):δC 130.8 (s,C-1),113.2 (d,C-2),148.9 (s,C-3),146.2 (s,C-4),116.1 (d,C-5),122.2 (d,C-6),38.8 (t,C-7),42.5 (d,C-8),72.9 (t,C-9),131.4 (s,C-1′),113.8 (d,C-2′),148.9 (s,C-3′),146.1 (s,C-4′),116.1 (d,C-5′),123.0 (d,C-6′),35.3 (t,C-7′),47.6 (d,C-8′),181.6 (s,C-9′),56.3 (q,3-OMe),56.3 (q,3′-OMe)。结合文献(Hodaj et al.,2017)比对,鉴定化合物1为罗汉松脂素。
化合物2 浅黄色粉末,ESI-MS m/z:[M + Na]+ 295.2,分子式C16H16O4。1H-NMR (CDCl3,500 MHz):δH 7.15 (1H,t,J = 8.2 Hz,H-7),6.97 (1H,d, J = 8.2 Hz,H-6),6.87 (1H,d,J = 8.2 Hz,H-8),6.55 (1H,s,H-1),3.97 (3H,s,3-OMe),3.92 (3H,s,2-OMe),2.72 (2H,m,H-9),2.68 (2H,m,H-10); 13C-NMR (CDCl3,125 MHz):δC 105.2 (d,C-1),146.3 (s,C-2),136.9 (s,C-3),140.4 (s,C-4),118.9 (s,C-4a),132.0 (s,C-4b),153.4 (s,C-5),118.1 (d,C-6),128.2 (d,C-7),119.8 (d,C-8),120.2 (s,C-8a),140.5 (s,C-8b),31.1 (t,C-9,10) 56.1 (q,2-OMe),61.4 (q,3-OMe)。结合文献(Wollenweber et al.,1992)比对,鉴定化合物2为4,5-二羟基-2,3-二甲氧基-9,10-二氢菲。
化合物3 白色粉末,ESI-MS m/z:[M + Na]+ 297.3,分子式C15H14O5。1H-NMR (CDCl3,500 MHz):δH 7.18 (1H,d, J = 2.1 Hz,H-2),7.16 (1H,d,J = 2.0 Hz,H-6),7.08 (1H,t,J = 7.4 Hz,H-5′),6.76 (1H,br s,H-2′),6.76 (1H,d,J = 7.6 Hz,H-6′),6.65 (1H,dd,J = 7.4,1.4 Hz,H-4′),4.18 (2H,s,H-a′),3.88 (3H,s,3-OMe); 13C-NMR (CDCl3,125 MHz):δC 128.5 (s,C-1),111.8 (d,C-2),145.2 (s,C-3),142.6 (s,C-4),148.9 (s,C-5),107.9 (d,C-6),138.3 (s,C-1′),117.2 (d,C-2′),158.7 (s,C-3′),114.7 (d,C-4′),130.6 (d,C-5′),121.6 (d,C-6′),199.1 (s,C-α),46.2 (t,C-α′),56.8 (q,3-OMe)。结合文献(Chen et al.,2014)比对,鉴定化合物3为华石斛素C。
化合物4 白色粉末,ESI-MS m/z:[M + Na]+ 175.2,分子式C9H12O2。1H-NMR (CDCl3,500 MHz):δH 7.18 (2H,d,J = 8.5 Hz,H-4,8),6.86 (1H,d,J = 8.4 Hz,H-5,7),3.53 (2H,t, J = 7.5 Hz,H-1),2.75 (2H,t,J = 7.4 Hz,H-2); 13C-NMR (CDCl3,125 MHz):δC 63.8 (t,C-1),38.9 (t,C-2),138.9 (s,C-3),129.5 (d,C-4,8),115.4 (d,C-5),156.5 (s,C-6),115.4 (d,C-7),55.6 (q,6-OMe)。结合文献(张树琳,2018)比对,鉴定该化合物4为对甲氧基苯乙醇。
化合物5 白色粉末,ESI-MS m/z:[M - H]- 191.2,分子式C11H12O3。1H-NMR (CDCl3,500 MHz):δH 7.63 (2H,d,J = 8.2 Hz,H-2,6),6.86 (1H,d,J = 12.8 Hz,H-7),6.81 (2H,d,J = 8.2 Hz,H-3,5),5.82 (1H,d,J =12.8 Hz,H-8),4.19 (2H,q,J = 7.1 Hz,H-10),1.28 (3H,t,J = 7.1 Hz,H-11); 13C-NMR (CDCl3,125 MHz):δC 127.5 (s,C-1),132.5 (d,C-2,6),115.1 (d,C-3,5),156.8 (s,C-4),143.4 (d,C-7),117.4 (d,C-8),166.8 (s,C-9),60.6 (t,C-10),14.5 (q,C-11)。结合文献(杜文鹏等,2015)比对,鉴定化合5为顺式对羟基肉桂酸乙酯。
化合物6 无色油状,ESI-MS m/z:[M - H]- 193.2,分子式C11H14O3。1H-NMR (CD3OD,500 MHz):δH 7.01 (2H,d,J = 8.3 Hz,H-2,6),6.69 (2H,d,J = 8.3 Hz,H-3,5),4.09 (2H,q,J = 7.1 Hz,H-10),2.81 (2H,t,J = 7.5 Hz,H-8),2.56 (2H,t,J = 7.5 Hz,H-7),1.20 (3H,t,J = 7.1 Hz,H-11); 13C-NMR (CD3OD,125 MHz):δC 132.7 (s,C-1),130.2 (d,C-2,6),116.2 (d,C-3,5),156.7 (s,C-4),37.3 (t,C-7),31.2 (t,C-8),175.0 (s,C-9),61.5 (t,C-10),14.5 (q,C-11)。結合文献(田佳,2002)比对,鉴定化合物6为对羟基苯丙酸乙酯。
化合物7 无色油状,ESI-MS m/z:[M - H]- 181.1,分子式C9H10O4。1H-NMR (CD3OD,500 MHz):δH 9.74 (1H,s,CHO),7.21 (2H,br s,H-2,6),3.91 (6H,s,3,5-OMe); 13C-NMR (CD3OD,125 MHz):δC 129.2 (s,C-1),108.2 (d,C-2,6),149.6 (s,C-3,5),143.6 (s,C-4),193.0 (d,C-7),56.8 (q,3,5-OMe)。结合文献(申旭霁等,2009)比对,鉴定化合物7为丁香醛。
化合物8 无色油状,ESI-MS m/z:[M - H]- 121.1,分子式C7H6O2。1H-NMR (C5D5N,500 MHz):δH 12.22 (1H,s,3-OH),10.09 (1H,s,H-7),7.76 (1H,s,H-2),7.50 (1H,d,J = 7.1 Hz,H-4),7.44 (1H,t,J = 7.1 Hz,H-5),7.41 (1H,d,J = 7.1 Hz,H-6); 13C-NMR (C5D5N,125 MHz):δC 139.1 (s,C-1),116.1 (d,C-2),160.0 (s,C-3),121.9 (d,C-4),130.6 (d,C-5),123.0 (d,C-6),193.1 (d,C-7)。结合文献(黄永富,2006)比对,鉴定化合物8为3-羟基苯甲醛。
化合物9 无色油状,ESI-MS m/z:[M + Na]+ 235.3,分子式C13H24O2。1H-NMR (CD3OD,500 MHz):δH 3.85 (1H,m,H-3),3.70 (1H,m,H-9),2.20 (2H,m,H-4a,7a),1.92 (2H,m,H-4b,7b) 1.69 (1H,m,H-2a),1.64 (3H,s,H-13),1.49 (2H,m,H-8),1.38 (1H,dd,J = 11.0,12.2 Hz,H-2b),1.17 (3H,d,J = 6.2 Hz,H-10),1.05 (3H,s,H-12),1.04 (3H,s,H-11); 13C-NMR (CD3OD,125 MHz):δC 38.8 (s,C-1),49.2 (t,C-2),65.6 (d,C-3),42.9 (t,C-4),125.4 (s,C-5),138.3 (s,C-6),25.6 (t,C-7),40.7 (t,C-8),69.2 (d,C-9),23.3 (q,C-10),28.9 (q,C-11),30.3 (q,C-12),20.0 (q,C-13)。结合文献(杨勇勋等,2013)比对,鉴定化合物9为3,9-dihydroxy-megastigma-5-ene。
化合物10 黄色油状,ESI-MS m/z:[M + H] + 295.3,分子式C19H34O2。1H-NMR (DMSO-d6,500 MHz):δH 5.31 (4H,m,H-9,10,12,13),3.57 (3H,s,H-OCH3),2.73 (2H,t,J = 6.4 Hz,H-11),2.28 (2H,t,J = 7.4 Hz,H-2),2.00 (4H,m,H-8,14),1.50 (2H,m,H-3),1.18-1.35 (14H,m,H-4,5,6,7,15,16,17),0.85 (3H,t,J = 6.9 Hz,H-18); 13C-NMR (DMSO-d6,125 MHz):δC 173.3 (s,C-1),33.3 (t,C-2),24.4 (t,C-3),28.4-29.0 (t,C-4,5,6,7,15),26.6 (t,C-8,14),129.7 (s,C-9,13),127.8 (s,C-10,12),30.9 (t,C-16),22.1 (t,C-17),13.9 (q,C-18),51.1 (q,C-OCH3)。結合文献(习峰敏,2013)比对,鉴定化合物10为(9Z,12Z)-9,12-二烯十八碳酸甲酯。
2.2 活性测试
将从华石斛中分离得到的化合物1-10使用Ellman法(Ellman et al.,1961;Yang et al.,2014)测试其对乙酰胆碱酯酶活力的影响,测试样品终浓度为50 μg·mL-1 。实验分析数据为3次实验的平均值±标准差,P<0.05表示差异显著。实验结果表明,化合物2、4和9对乙酰胆碱酯酶的活力有不同程度的影响(表1)。
3 讨论与结论
迄今,由于华石斛资源稀缺,关于华石斛化学成分的研究还有很大空白,本研究在前人工作基础上从华石斛乙醇提取物的乙酸乙酯部分中分离得到10个化合物,其中化合物2为菲类,化合物3为联苄类,首次从华石斛中分离得到7个化合物。据报道菲类和联苄类化合物是兰科植物中的主要活性成分,具有非常好的药理作用,如抗血小板凝集、细胞毒、抗菌、抗氧化、抗炎等,在医药和农药等方面均具有广泛的开发前景(秦泽敏等,2019)。
本研究通过酶活性抑制测试结果表明,化合物2、4和9能够降低乙酰胆碱酯酶的活力。另外,在对华石斛化学成分进行研究的前期工作中,从华石斛中分离得到4个化合物:2′,4′-二羟基查尔酮、2,7-二羟基-3,4,6-三甲氧基-9,10-二氢菲、(E)-松柏醛和十二元内环酯,也能够抑制乙酰胆碱酯酶的活性,综上研究结果说明华石斛在挖掘乙酰胆碱酯酶抑制剂的研究中具有较好的开发潜力。
参考文献:
CHAROENRUNGRUANG S,CHANVORACHOTE P,SRITULARAK B,et al.,2014. Gigantol,a bibenzyl from Dendrobium draconis,inhibits the migratory behavior of non-small cell lung cancer cells [J]. J Nat Prod,77(6):1359-1366.
CHEN XJ,2013.Chemical components and bioactivities of Dendrobium sinense (Orchidaceae),an endeimic species in Hainan Island [D]. Hainan:Hainan University:20-41. [陈秀娟,2013. 华石斛化学成分及其生物活性研究 [D]. 海南:海南大学:20-41.]
CHEN XJ,MEI WL,CAI CH,et al.,2014. Four new bibenzyl derivatives from Dendrobium sinense [J]. Phytochem Lett,9:107-112.
CHEN XJ,MEI WL,ZUO WJ,et al.,2013. A new antibacterial phenanthrenequinone from Dendrobium sinense [J]. J Asian Nat Prod Res,15(1):67-70.
DU WP,XU P,LIU B,et al.,2015. Chemical constituents from shoots of Phyllostachys edulis (Ⅰ) [J]. Chin Trad Herb Drugs,46(3):334-338. [杜文鹏,徐彭,刘波,等,2015. 毛竹笋化学成分研究(Ⅰ) [J]. 中草药,46(3):334-338.]
ELLMAN GL,COURTNEY KD,JR AV,et al.,1961. A new and rapid colorimetric determination of acetylcholinesterase activity [J]. Biochem Pharmacol,7(2):88-95.
GE XJ,ZHENG LM,WANG YL,et al.,2015. Study on effect of Dendrobium nobile polysaccharides on expression of WT1 gene in myeloid leukemia cells [J]. Chongqing Med,44(10):1305-1310. [葛晓军,郑丽梅,王永伦,等,2015. 金钗石斛多糖对髓系白血病细胞WT1基因表达的影响 [J]. 重庆医学,44(10):1305-1310.]
HODAJ E,TSIFTSOGLOU O,ABAZI S,et al.,2017. Lignans and indole alkaloids from the seeds of Centaurea vlachorum Hartvig (Asteraceae),growing wild in Albania and their biological activity [J]. Nat Prod Res,31(10):1195-1200.
HUANG YF,2006. Studies on the secondary metabolites of 6 kinds of marine microorganisms [D]. Shenyang:Shenyang Pharmaceutical University:40-45. [黄永富,2006. 六种海洋微生物次级代谢产物的研究 [D]. 沈阳:沈阳药科大学:40-45]
QIN ZM,ZHU XY,FU H,et al.,2019. Study on chemical constituents of Dendrobium Stuposum [J]. Chin J Ethnomed Ethnopharm,28(2):19-22. [秦澤敏,朱秀英,付欢,等,2019. 叉唇石斛的化学成分研究 [J]. 中国民族民间医药,28(2):19-22.]
SHEN XJ,GE RL,WANG JH,2009. Chemical constituents from Choerospondias axillaris (Roxb.) Burtt et Hill [J]. J Henan Univ (Med Sci),28(3):196-199. [申旭霁,格日力,王金辉,2009. 广枣的化学成分 [J]. 河南大学学报(医学版),28(3):196-199.]
TAN CY,MEI WL,ZHAO YX,et al.,2017. Chemical Constituents from Dendrobium sinense [J]. J Tropical Subtrop Bot,25(2):189-194. [谭彩银,梅文莉,赵友兴,等,2019. 华石斛化学成分研究 [J]. 热带亚热带植物学报,25(2):189-194.]
TANG JY,YAN MQ,QI FF,et al.,2017. Study on optimum extraction of toral flavones in Dendrobium officinale flower and its antioxidant activity in vitro [J]. J Zhejiang Chin Med Univ,41(3):235-242. [唐静月,颜美秋,齐芳芳,等,2017. 铁皮石斛花总黄酮提取工艺优化及体外抗氧化活性研究 [J]. 浙江中医药大学学报,41(3):235-242.]
TIAN J,2002. Study on the material foundation of medicinal effecttiveness and action mechanism of traditonal chinese medicine [D]. Shenyang:Shenyang Pharmaceutical University:35. [田佳,2002. 复方中药药效物质基础研究 [D]. 沈阳:沈阳药科大学:35.]
WANG DH,FAN B,SUN J,et al.,2019. Research progress on chemical components of plants of Dendrobium Sw. [J]. Food Nutr Chin,25(3):12-18. [王东晖,范蓓,孙晶,等,2019. 石斛属植物化学成分的研究进展 [J]. 中国食物与营养,25(3):12-18.]
WEI M,LIU YY,CAI WR,et al.,2016. Optimization on ultrasonic-assisted extraction of polyphenols from Dendrobium huoshanense and its antioxidant activity [J]. Food Mach,32(7):136-140. [魏明,刘艳艳,蔡为荣,等,2016. 霍山石斛多酚超声波辅助提取工艺优化及其抗氧化活性研究 [J]. 食品与机械,32(7):136-140.]
WOLLENWEBER E,DORR M,STELZER R,et al.,1992. Lipophilic phenolics from the leaves of Empetrum nigrum — chemical structures and exudate localization [J]. Bot Acta,105(4):300-305.
WU J,LI X,WAN W,et al.,2017. Gigantol from Dendrobium chrysotoxum Lindl. binds and inhibits aldose reductase gene to exert its anti-cataract activity:An in vitro mechanistic study [J]. J Ethnopharmacol,198:255-261.
XI FM,2013. Studies on the chemical constituents of Eclipta prostrata (L.) and antihyperglycemic activity [D]. Shanghai:The Second Military Medical University:55-56. [习峰敏,2013. 墨旱莲化学成分及其降血糖活性研究 [D]. 上海:第二军医大学:55-56.]
XU Y,LIU HC,LI X,2019. Research progress in chemical composition,fingerprint and pharmacological activity of Dendrobii caulis [J]. Chin J Inform TCM,26(2):129-132. [徐悦,刘宏程,李鲜,2019. 石斛化学成分、指纹图谱及药理活性研究进展 [J]. 中国中医药信息杂志,26(2):129-132.]
YANG DL,WANG H,GUO ZK,et al.,2014. Fragrant agarofuran and eremophilane sesquiterpenes in agarwood ‘Qi-Nan from Aquilaria sinensis [J]. Phytochem Lett,8:121-125.
YANG YX,YAN YM,TAO M,et al.,2013. Chemical constituents from leaves of Rhododendron rubiginosum var. rubiginosum [J]. Chin J Chin Mat Med,38(6):839-843. [楊勇勋,晏永明,陶明,等,2013. 红棕杜鹃(原变种)叶的化学成分研究 [J]. 中国中药杂志,38(6):839-843.]
ZHANG SL,2018. Study on thechemical constituents and antitumor activity of Clerodendrum japonicum and Lysimachia fortune [D]. Guilin:Guangxi Normal University:54. [张树琳,2018. 赪桐和星宿菜的化学成分及其抗肿瘤活性研究 [D]. 桂林:广西师范大学:54. ]
ZHU QY,2010. The antitumor potential and molecular mechanisms of erianin in human bladder cancer cells [D]. Chengdu:Southwest Jiaotong University:27-28. [朱启彧,2010. 毛兰素诱导膀胱癌细胞凋亡及其分子机制 [D]. 成都:西南交通大学:27-28.]
(责任编辑 何永艳)

