以降钙素原水平指导慢阻肺急性加重患者抗感染治疗的研究*
李 祥,蓝晓红,雷文婧,陈 颖,许 锐,陈曙东,臧菊香,周永刚**
东部战区总医院秦淮医疗区 1 药学科;2 神经内科,南京210002
慢性阻塞性肺疾病 (COPD) 急性加重(AECOPD) 最常见诱因是呼吸道感染,78%的患者有明确的病毒或细菌感染依据[1],其它非感染性诱因包括吸烟、空气污染、吸入过敏原、外科手术、应用镇静药物、气胸、胸腔积液、充血性心力衰竭、心律不齐以及肺栓塞等。在众多的诱因中,如何鉴别细菌感染,目前临床主要依据《AECOPD 诊治专家共识(2014 年修订版)》以感染相关的临床症状为主的识别方法。而相关研究显示[2],血清降钙素原(PCT)是广泛认可且应用的一种高效炎症标志物,较传统的白细胞(WBC)、C 反应蛋白(CRP)具有更高的敏感性和特异性[3]。本文通过PCT 水平与“共识”推荐的症状评估方法为主导的抗感染治疗策略的比较,旨在为临床AECOPD 患者合理使用抗菌药物提供依据。
1 资料与方法
1.1 入组标准
(1)既往确诊为COPD,入院最近一次肺功能分级为中~重度患者;(2)符合COPD 急性加重的表现(以呼吸道症状加重为特征的临床事件,其症状变化程度超过日常变化范围);(3) 排除近期胸部手术、甲状腺髓样细胞癌、其他呼吸系统疾病及心源性呼吸困难的患者。
1.2 一般资料
选取2016 年7 月~2019 年6 月因AECOPD 住院治疗的患者113 例。经医院医学伦理委员会审核批准,且入选患者已签署知情同意书。
将113 例患者按就诊顺序编号,并根据随机数字表法分为对照组(专家共识[1]指导组)60 例和治疗组(PCT 水平指导组)53 例。两组性别、年龄、体质指数、近期肺功能分级(主要评价指标为第1 秒用力呼气容积占预计值的百分比,即FEV1 占预计值%)等基本资料比较,差异无统计学意义(P>0.05)。见表1。
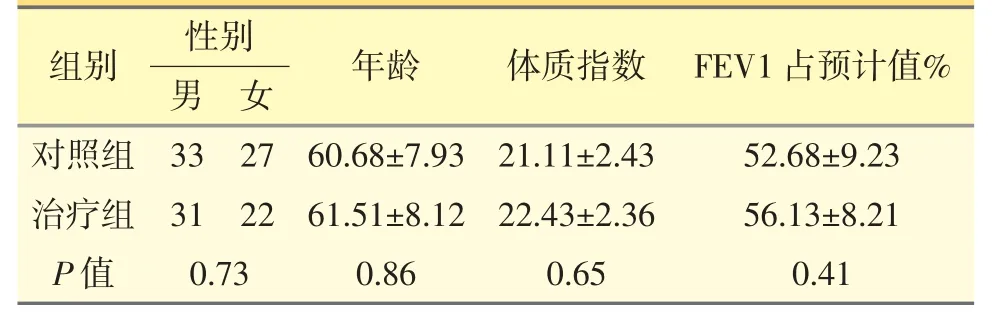
表1 患者一般情况比较
1.3 治疗方案
对照组根据《AECOPD 诊治专家共识》推荐,符合以下三点之一,即采用相应的抗菌药物治疗:①在AECOPD 时,以下3 种症状同时出现:呼吸困难加重、痰量增加、痰液变脓性;②患者仅出现以上3种症状中的2 种、但包括痰液变脓性这一症状;③严重的急性加重,需要有创或无创机械通气[2]。临床症状稳定72 h 后停用抗菌药物。
治疗组根据PCT 不同水平启动抗感染治疗,PCT≥0.25 μg·L-1,行经验性抗感染;入院PCT<0.10 μg·L-1,不给予抗菌药物;患者发病时间<6 h 时PCT<0.10 μg·L-1或入院时发病时间未明,PCT<0.25 μg·L-1患者,予以观察,次日续测PCT,若PCT≥0.25 μg·L-1,行抗感染。治疗组患者分别于治疗开始后第1、4、7、10 天检测血清PCT 浓度。对于入院时已经应用抗菌药物的患者,PCT<0.25 μg·L-1时停用已经使用的抗菌药物;其他患者与基线值比较,PCT 质量浓度下降>80%,停用抗菌药物[4]。
1.4 观察指标
以抗菌药物使用率、抗菌药物使用时间、住院时间作为观察指标。
1.5 血清PCT 测定
空腹采取静脉血3mL,3000r·min-1离心10 min,分离血清,立即用双向侧流免疫法测定,仪器为Relia 降钙素原监测仪(深圳瑞莱生物工程公司),严格按操作规程操作。
1.6 统计学处理
采用SPSS13.0 软件进行统计分析,计量资料以均值±标准差()表示,多组间比较采用方差分析;计数资料以相对数表示,采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 治疗情况
对照组60 例中未使用抗菌药物7 例,使用抗菌药物53 例,其中抗菌药物使用时间≥14 d 的4例(1 例住院期间并发心衰,3 例动脉血气分析示Ⅱ型呼衰),具体使用时间分别为14、16、17、21 d。治疗组未使用抗菌药物11 例,全程监测PCT 均<0.10 μg·L-1;使用抗菌药物42 例(入院时血清PCT≥0.25 μg·L-1共27 例,PCT<0.25 μg·L-1共26 例,次日续测PCT≥0.25 μg·L-1共15 例),其中抗菌药物使用时间≥14 d 的5 例(1 例住院期间并发心衰、3例动脉血气分析示Ⅱ型呼衰、1 例出现脓毒血症),具体使用时间分别为15、15、17、19、26 d。见表2。
两组均根据临床症状予以相同常规治疗,包括吸氧(控制性氧疗1~2 L·min-1)、静脉化痰(氨溴索/溴己新)、口服止咳(棕色合剂/苏黄止咳胶囊)、吸入扩充支气管(沙丁胺醇/特布他林+异丙托溴胺+布地奈德/倍氯米松雾化吸入)、口服/静脉抗炎(泼尼松/泼尼松龙/甲泼尼龙)等。
2.2 两组抗菌药物使用率、抗菌药物平均使用时间、平均住院时间比较
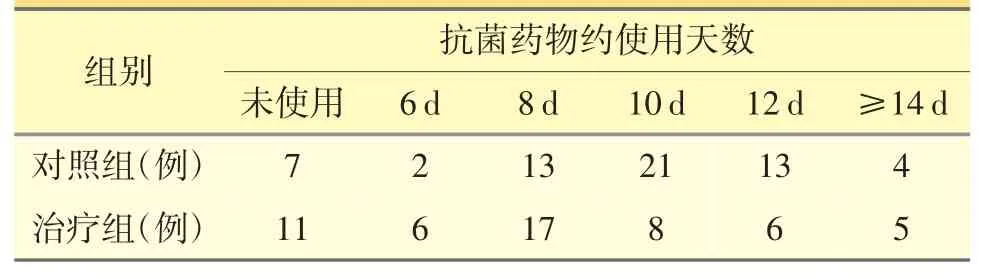
表2 两组抗菌药物使用时间
治疗组抗菌药物使用率、抗菌药物平均使用时间、平均住院时间均较对照组显著降低(P<0.05),见表3。
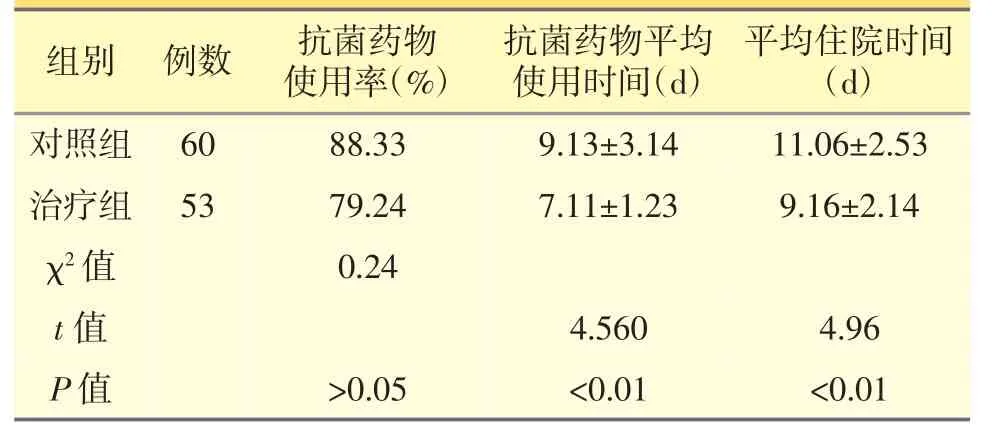
表3 两组抗菌药物使用率、抗菌药物平均使用时间、平均住院时间比较
3 讨论
感染是AECOPD 的重要诱因之一[5]。长期以来,国内对AECOPD 患者抗菌药物的使用率高达70%~85%[6],多为经验性用药,且治疗周期长,极大增加了细菌耐药及二重感染的风险。在倡导合理使用抗菌药物、延缓细菌耐药的背景下,传统的给药策略面临着挑战。一般的感染鉴别方法,应用于AECOPD患者存在较大弊端。主要原因:①患者多为老年人,机体反应能力较差,常伴免疫功能低下,在急性加重期即使存在细菌感染,其体温、血象等感染相关实验室指标变化也不明显;②COPD 作为慢性支气管炎发展到一定阶段的产物,影像学对于陈旧感染病灶和新发感染病灶的甄别特异性不强;③细菌培养因其较低的检出率和较长的检测时限,远远不能满足临床的实际需要,经验性抗感染治疗是实际工作的常态。
因此,目前《AECOPD 诊治专家共识(2014 年修订版)》 推荐基于症状为导向的经验性抗感染治疗策略,在一定程度上提升了抗菌药物合理使用水平;但呼吸困难、咳嗽等症状并不是感染的特异性症状,用于此类患者感染的判断可能存在一定偏差。探寻敏感标志物,对于AECOPD 诱因的早期鉴别、指导临床合理用药具有重要意义。
PCT 是降钙素前肽糖蛋白,是在发生细菌感染时释放到血液的可溶性蛋白质[7]。正常状态下PCT在血清中的浓度较低,约为0.1 μg·L-1,机体发生细菌感染2~3 h 后PCT 即可开始升高,6~12 h 可达到峰值[8-12],且明显高于病毒、非典型病原体(军团菌除外)和结核菌导致的感染[13]。Shimetani N 等[14]在PCT和CRP 判断细菌感染的研究中发现,PCT 是敏感性、特异性最佳的标志物,在早期诊断、判断预后等方面优于CRP。同时PCT 的血清浓度可能与微生物入侵的严重程度相关,目前已被作为细菌感染疾病的早期诊断、严重程度评价、预后判断和指导抗菌药物应用的重要指标[15]。
考虑到PCT 血清浓度与细菌感染发生的关系,本研究在入组时,对于发病时间<6h 内PCT<0.10μg·L-1的患者次日予以监测。结果显示,有15 例住院第二天血清PCT 水平≥0.25 μg·L-1。因此,在起病初期以及在住院期间病情发生变化时,应予持续监测PCT,以免耽误感染的治疗。
在PCT 判断细菌感染的折点选取上,主要综合以下研究结果。在呼吸系统感染中,PCT<0.25 μg·L-1的患者中细菌感染的可能性较低[4]。刘盛盛等[16]研究显示:PCT≥0.25 μg·L-1开始抗感染治疗,PCT 组比常规组抗菌药物使用率降低19.8%,PCT 组抗菌药物使用时间、住院费用均明显低于常规组(P<0.05)。因此,本研究以血清PCT≥0.25 μg·L-1为抗菌药物是否使用的判断折点。在排除其它可能导致血清PCT 升高的因素之后(如外科手术和创伤、器官移植、肾功能不全、肿瘤、血液病、自身免疫性疾病、胰腺炎等[4]),本次研究显示:治疗组与对照组比较,抗菌药物使用率无显著性差异(P>0.05),因此,临床可借鉴“共识”推荐的对于感染经验性判断来把握初始抗感染的适应证,临床实际可操作性强,这对于一部分感染病情危重患者的即刻治疗具有重要意义。
在指导抗菌药物使用疗程方面,感染控制后PCT会很快降至正常,是停用抗菌药物的参考指标[17]。本研究采用住院期间持续监测的方式,对于入院时已经服用抗菌药物的患者,PCT<0.25 μg·L-1时停用已经使用的抗菌药物;其他患者与基线值比较,PCT 质量浓度下降>80%,停用抗菌药物[4]。本研究显示,治疗组抗菌药物平均使用时间、平均住院时间均较对照组显著降低(P<0.05),与简榕等[18]根据血清PCT水平进行AECOPD 的抗菌药物管理时、可缩短抗菌药物使用时间的结论一致;在平均住院时间比较上,与马丽等[19]的研究结论相一致。
还有研究显示,革兰阴性菌(G-)感染患者血清PCT 水平显著高于革兰阳性菌(G+)感染,可能与G-菌在诱导全身性炎症反应时,可同时诱导内毒素释放,而后者又是PCT 产生的刺激因子相关[20,21]。近来国内一项大型多中心研究也显示,在884 例AECOPD 患者中,有331 例从痰液培养获得细菌124株(37.4%),其中78.8%为G-,最为常见的是铜绿假单胞菌和肺炎克雷伯菌,其次为流感嗜血杆菌;15%为G+[2]。本研究表明,治疗组PCT≥0.25 μg·L-1患者G-菌检出率为79.2%(42/53),与上述研究结论相似。因此,在经验性抗感染药物选择上宜侧重于抗G-药物。
本研究主要以中、重度AECOPD 患者作为研究对象,综合以上结论显示:PCT 水平可用于指导中、重度AECOPD 患者抗感染治疗,特别是在抗感染治疗疗程的把握上,具有较强优势;但此结论是否适用于轻度以及极重度AECOPD 患者,需要进一步研究。

