LC-MS/MS 法测定注射剂中来自生产管路中的PFOA 和PFOS 的迁移量
张晓芸,张建茹,崔 萍,昝艳楠,曹庆丰,丁逸梅,*
1 南京工业大学江苏省药物研究所,南京 210009;2 南京工业大学药学院,南京211816
注射剂生产管路常选用材质为聚四氟乙烯,其具有耐酸、耐碱及高度的化学稳定性[1],聚四氟乙烯在聚合生产时添加全氟辛酸(PFOA)等含氟类化合物,含氟系列产品经化学或生物降解最终产生全氟辛基磺酸(PFOS)。PFOA 和PFOS 具有多种毒性,包括生殖毒性、诱变毒性、发育毒性和神经毒性,且在生物体内储蓄难以代谢。在注射液制备工艺中当注射液流经聚四氟乙烯管路或密封件时,PFOA 和PFOS 可能会被溶出迁移至注射液中,且药液与管路的接触面积、接触时间较难评估,因此直接考察注射液药品中PFOA 和PFOS 的迁移量尤为重要。
PFOA 和PFOS 的检测手段目前有如下几种:
②GC/MS 法:PFOA 和PFOS 为强酸性,挥发性较小,吕刚等[9]以乙酰氯为衍生化试剂得到PFOA甲酯和全氟葵酸(PFDA)甲酯测定PFOA;魏琳琳[10],用碳基固体酸作衍生化试剂,N,N’-二环己基碳二亚胺(DCC)为脱水剂,生成PFOA 甲酯。夏静芬等[11]以2,4-二氟苯胺为衍生剂,N,N’-二环己基碳二亚胺(DCC)为脱水剂与全氟羧酸类(PFCAs)形成酰胺衍生产物;张颖等[12],以四丁基氢氧化铵为衍生化试剂,超声辅助与PFOA 生成铵盐。
③LCMS 或LCMS/MS 法: 高效液相串联质谱法是目前最为广泛应用的检测PFOA 和PFOS 的定量分析方法。在食品及食品包装材料[13,14]、生物组织[15,16]、药品[17]中关于PFOA 和PFOS 的报道较多。
欧盟及美国FDA 明文规定材料及食品包装材料中PFOA 和PFOS 的使用限量,但我国现行法规暂未明文规定PFOA 和PFOS 在药品中的限量。本文依据一般遗传毒性致癌物的SCT 值,即PFOA 和PFOS 在药品中每日摄入总量设定宜低于1.5 μg。
本实验使用LC-MS/MS 法测定注射剂中来自药品生产管路的PFOA 和PFOS 含量,通过标准加入法能够消除注射剂复杂基体效应对PFOA 和PFOS 测定的影响,得到有效数据,从而准确、简便、快速地测定PFOA 和PFOS 的迁移量。
1 仪器与药品、试剂
1.1 仪器
Waters Quattro Micro 三重四极杆质谱仪,Waters 2695 液相色谱仪(沃特斯中国有限公司),含在线真空脱气机、四元梯度泵、恒温自动进样器、柱温箱、电喷雾离子源(ESI);Masslynx4.0 数据分析系统;XP105DR 十万分之一电子天平(美国Mettler 公司)。
1.2 药品与试剂
注射用甲磺酸萘莫司他 (规格10 mg,批号:2181202、2181203、2 181204;规格50 mg,批号:2181205、2181206、2190101);吸入用乙酰半胱氨酸溶液(规格3 mL∶0.3 g,批号:170801、170802、170901);注射用特利加压素无菌稀释剂 (规格5 mL ∶45 mg,批号:191101、191102、191103);注射用氨磷汀(规格0.5g,批号:S200107、S200110、S200114A、S200114B、S200114C);PFOA 对照品 (Sigma-Aldrich 公司,纯度95%,批号:WXBD1156V);PFOS 对照品(Dr.Ehrenstorfer 公司,批号:1015577)。甲醇(Merck 公司,色谱纯);乙酸铵(Sigma-Aldrich 公司);水为重蒸水。
2 方法与结果
2.1 LC-MS 条件
2.1.1 色谱条件 色谱柱:十八烷基硅烷键合硅胶为填充柱(Kromasil C8,100A 150mm×4.6mm,5μm);流动相:0.01 mol·mL-1乙酸铵-乙腈(50∶50);流速:1.0 mL·min-1,分流进样;柱温:40 ℃;进样量:20 μL。
王荣(1984.05-),女,上海,国家建筑信息模型(BIM)产业技术创新战略联盟助理研究员/经济师,南京工业大学经济与管理学院工程管理专业在职硕士研究生,研究方向:建筑产业现代化,工程建设标准化、建筑信息模型BIM。
2.1.2 质谱条件 电喷雾离子源(ESI),负离子模式检测;毛细管电压:3.0kV;锥孔电压:30V;源温:120℃;脱溶剂区温度:350℃,碰撞气(氩气);压力:1.0×10-4mbar;脱溶剂气流速:400 L·h-1;气帘气流速:50 L·h-1。
2.2 溶液配制
PFOA 对照品溶液: 取PFOA 对照品10 mg,精密称定,置100 mL 量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成每1 mL 含PFOA 100 μg 的储备液;精密量取该溶液1.0 mL,置50mL 量瓶中,用甲醇稀释至刻度,摇匀,制成1 mL 含PFOA 2 μg 的溶液。
PFOS 对照品溶液:取PFOS 对照品10 mg,精密称定,置100 mL 量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成每1 mL 含PFOS 100 μg 的储备液;精密量取该溶液1.0 mL,置50 mL 量瓶中,用甲醇稀释至刻度,摇匀,制成1 mL 含PFOS 2 μg 的溶液。
PFOA 与PFOS 混合对照品溶液: 精密量取PFOA 2 μg·mL-1的对照品溶液、PFOS 2 μg·mL-1的对照品溶液各1.0 mL,置200 mL 量瓶中,用甲醇稀释至刻度,摇匀,制成每1 mL 含PFOA 与PFOS 的500 ng 混合对照品溶液。
①标准曲线法: 分别精确量取PFOA 和PFOS混合对照品溶液(0.5、1.0、2.0、3.0、5.0 mL)置50 mL量瓶中,使用甲醇稀释至刻度,摇匀。此标准溶液系列I 中的PFOA 和PFOS 质量浓度分别为5、10、20、30、50 ng·mL-1。
②标准加入法:A.注射冻干粉末:此标准溶液系列I 中的PFOA 和PFOS 质量浓度分别为5、10、20、30、50 ng·mL-1;取注射用冻干粉末1 瓶,分别精密加入标准曲线溶液5 mL,混合均匀,过滤,此标准溶液系列Ⅱ中的PFOA 和PFOS 质量浓度分别为5、10、20、30、50 ng·mL-1。B.注射液:分别精确量取PFOA和PFOS 混合对照品溶液(0.5、1.0、2.0、3.0、5.0 mL)置50 mL 量瓶中,分别加入注射液5 支,使用甲醇稀释至刻度,摇匀。此标准溶液系列Ⅲ中的PFOA 和PFOS 质量浓度分别为5、10、20、30、50 ng·mL-1。空白溶液:取注射用冻干粉末或者注射液,用甲醇稀释至一定倍数,摇匀,作为空白溶液(必要时使用有机尼龙膜过滤)。
2.3 专属性试验
精密量取“2.2”中PFOA 与PFOS 混合对照品溶液、空白溶液各20 μL,注入液相色谱仪测定,结果见图1、图2,由图2 可见,空白溶液对测定无干扰。
2.4 线性及灵敏度试验
将配制好的标准曲线法标准溶液和标准加入法标准溶液,在同样的LC/MS 条件下测定,从而获得PFOA 和PFOS 两种线性。回归方程、相关系数见表1。
结果两种方法的PFOA 和PFOS 工作曲线的相关系数均大于0.999 0。说明标准曲线法和标准加入法的PFOA 和PFOS 浓度与响应均呈线性关系。
在同样的LC/MS 检测条件下,比较标准加入和未加入样品基体的检测限和定量限,见表2。由于样品的基体不同,PFOA 和PFOS 在ESI 源中的响应被抑制或者增敏,其程度与注射剂的基体有关。
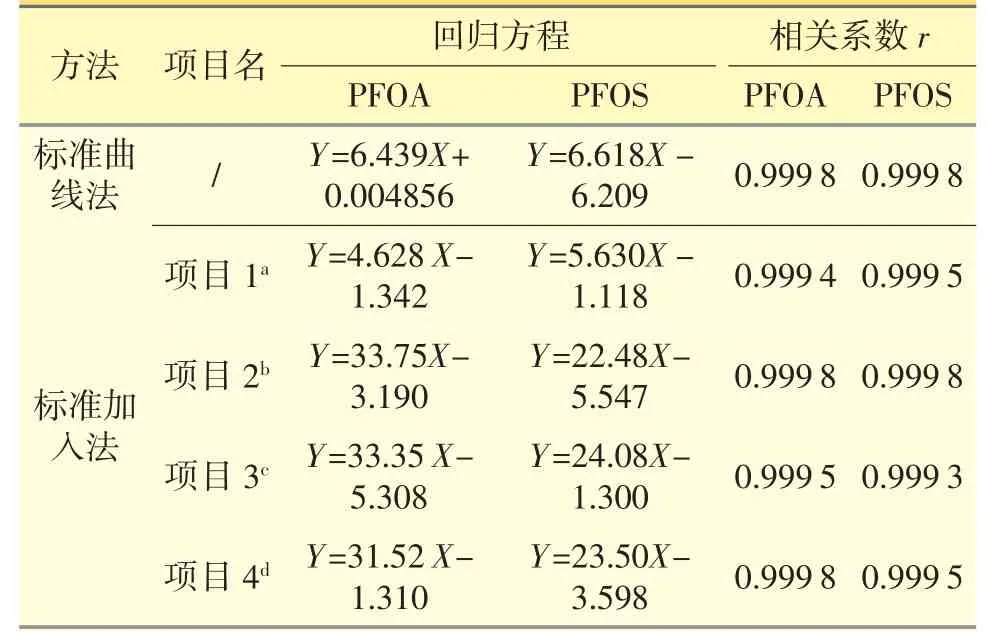
表1 PFOA 和PFOS 回归方程与相关系数
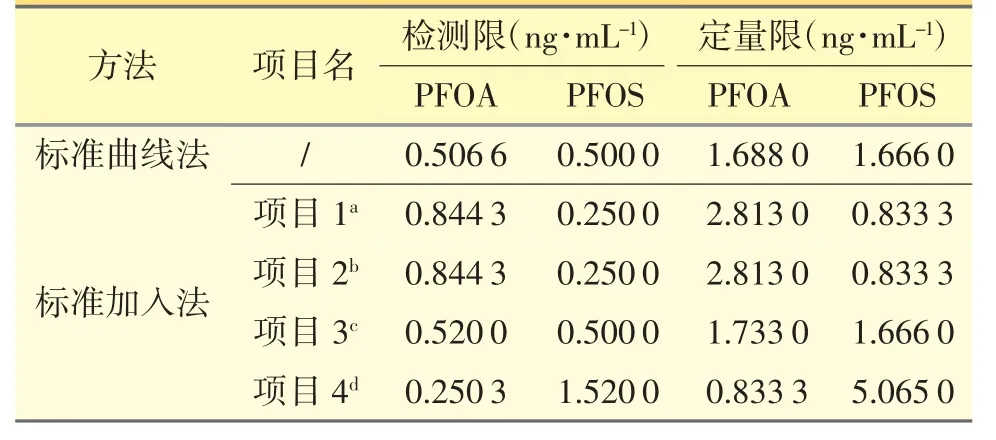
表2 PFOA 和PFOS 的检测限和定量限
2.5 回收率试验
2.5.1 注射冻干粉末 精密量取PFOA 和PFOS 混合对照品溶液适量,用甲醇稀释制成每1 mL 中分别含PFOA 和PFOS(5、20、30 ng·mL-1)的溶液;取注射用冻干粉1 瓶,精密加入溶液5 mL,混合均匀,过滤。
2.5.2 注射液 分别精确量取PFOA 和PFOS 混合对照品溶液(0.5、2.0、3.0mL)置50mL 量瓶中,分别加入注射液5 支,使用甲醇稀释至刻度,摇匀。制备成PFOA和PFOS 质量浓度分别为5、20、30 ng·mL-1的溶液。
分别采用标准曲线法和标准加入法,进行回收率试验,结果见表3、表4。
使用标准曲线法PFOA 回收率在60%附近,PFOS的回收率在180%附近,RSD 均小于10%,说明PFOA和PFOS 受样品基体的干扰,但平行性较好;使用标准加入法,PFOA 和PFOS 的回收率均在80%~120%,RSD 均小于10%,得到了有效数据,说明标准加入法能够消除样品基体对PFOA 和PFOS 测定的干扰。
为了验证本试验的设想,选取5 个不同规格的注射剂品种,分别采用标准加入法进行回收率试验,均得到良好的数据,结果见表5。PFOA 回收率在93.49%~110.9%,PFOS 的回收率在 87.57%~101.6%,RSD 均小于10%,结果符合验证要求。
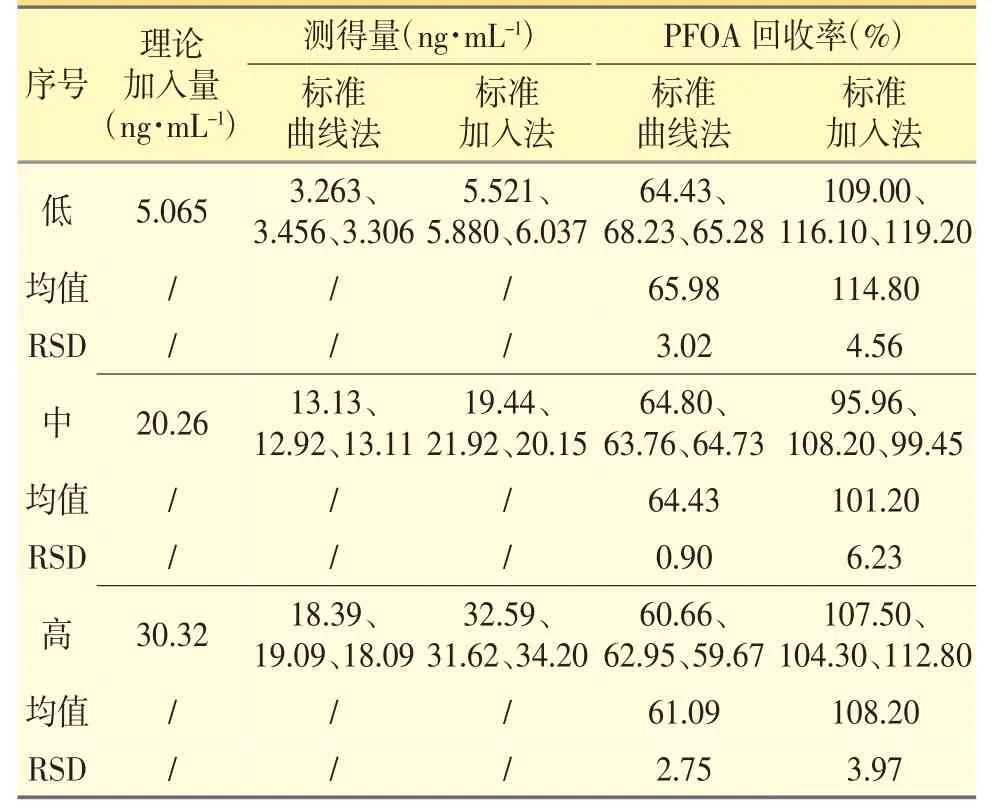
表3 PFOA 回收率试验
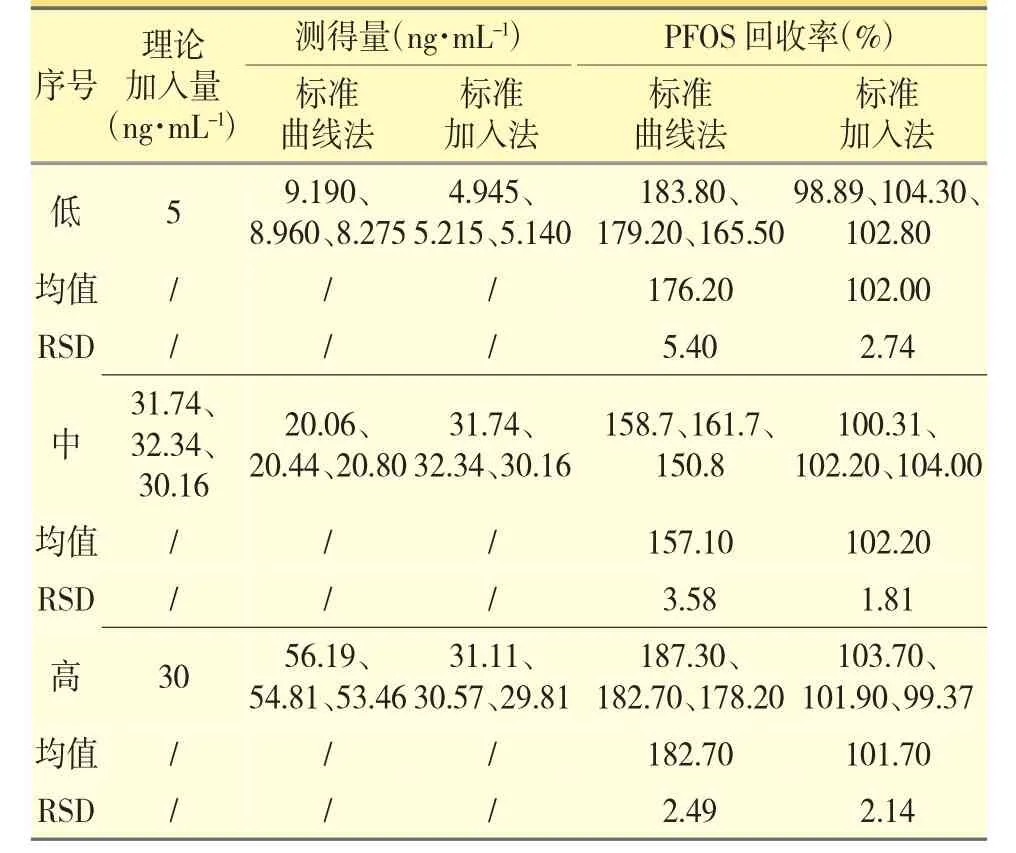
表4 PFOS 回收率试验
2.6 样品测定及结果
采用标准加入法测定4 个项目下来自生产管路中迁移的PFOA 和PFOS 的含量,结果均未检出。
3 讨论
3.1 定量离子的选择
PFOA 和PFOS 选用m/z 368.9783 作为PFOA的检测离子;PFOS 选用m/z 498.9298 作为PFOS 的检测离子[17]。
3.2 样品前处理筛选
在注射剂中,PFOA 和PFOS 限度为1.5 μg·d-1,样品可供稀释的倍数限于5 倍或者10 倍,样品溶液中有机物含量较高,干扰PFOA 和PFOS 的检测。选择合适的样品前处理排除干扰,是实验解决问题的关键点。文献报道样品前处理主要有4 种:①固相萃取[18],成本高,回收率低;②液液萃取[19],基本采用甲基叔丁基醚为萃取溶剂,操作繁琐,但能够得到较好的回收率。③索氏提取[20],应用于土壤、食品、生物样品等,常用的溶剂包括:乙酸乙酯、甲基叔丁基醚、二氯甲烷以及甲醇;④柱前衍生化[2-12],周期较长,操作繁琐。
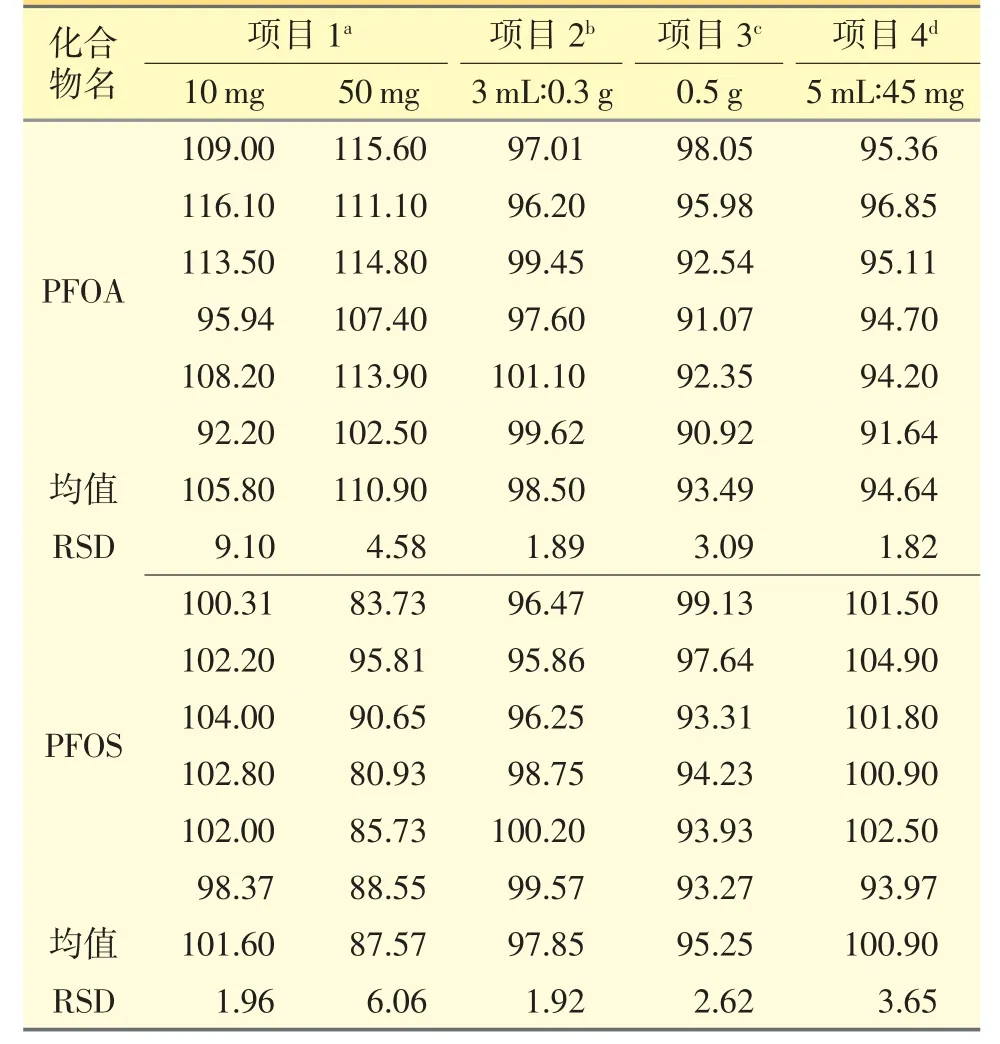
表5 不同注射剂回收率试验(%)
本实验尝试了液液萃取方式,使用溶剂:正己烷、乙酸乙酯、甲基叔丁基醚、二氯甲烷。PFOA 和PFOS 具有一定的水溶性,萃取效率较低,操作繁琐;后采用甲醇稀释样品,并使用有机尼龙膜过滤。
3.3 标准曲线法和标准加入法比较
本实验先考察标准曲线法,发现PFOA 回收率在60%附近偏低,PFOS 的回收率在180%附近偏高,不符合《中国药典》2015 版通则9101 药品质量标准分析方法“验证指导原则”中验证的要求;后采用标准加入法,结果良好,说明标准加入法可消除注射剂品种复杂基体干扰问题,避免使用操作繁琐的萃取方式,从而准确、简便、快速地测定了注射剂中来自生产管路的PFOA 和PFOS 的迁移量。

