黄芪多糖纳米粒的构建及特征*
许小英,周存敏,谭榜云,陈 琳,朱海平
兰州大学第一医院检验科,兰州730000
黄芪多糖(APS)是由葡萄糖、半乳糖、阿拉伯糖等多种酸性多糖组成的亲水性大分子混合物[1]。这种大分子物质很难穿透细胞膜或只有很少部分通过细胞间隙被吸收[2],导致APS 药效不显著。目前临床上主要以静脉方式给药,尚存在不明确的过敏风险。口服给药是中医药常用的经典而有效的途径,也是患者最易接受的给药方式,但APS 自带负电荷,口服给药会造成其与肠黏膜形成静电排斥,严重阻碍其在胃肠道的渗透作用,导致生物利用度更低[3]。寻求促进亲水大分子中药吸收的方法成为研究的焦点。
近年来,借助纳米粒子(NPs)较强的细胞穿透和靶向能力、高效的药代动力学、良好的生物相容性等优势,纳米中药制剂已成为一种很有前途的新型药物[4]。纳米中药制剂是利用纳米载体粒径小、比表面积大、表面活性高、吸附能力强等特性,通过物理或化学作用,将中药吸附或包埋在纳米粒子上构成的复合物。该复合物具有主动或被动靶向作用,使药物聚积于病灶部位,显著提高药物的生物利用度,且在保证药物效应的前提下可降低给药剂量,从而减轻或避免中药的毒副反应[5]。壳聚糖(CS)纳米粒子(以下简称CS-NPs)是一种常用的中药纳米制剂的载体。
本实验主要以CS-NPs 为载体制备APS 纳米粒,有望成为临床治疗的新工具。首先确定APS-CS NPs 制备的最佳条件,再按照文献方法检测该纳米粒的红外吸收光谱、粒径、Zeta 电位、分散指数等数据,以表征其大小、分布及稳定性等物理特性[6]。最后将APS-CS NPs 与大鼠心肌细胞系(H9c2 细胞)共培养,利用细胞活力变化评价该药物的细胞相容性,为该药物临床应用奠定基础。
1 材料与方法
1.1 材料
黄芪多糖(APS)BR,90%(Sigma,美国);壳聚糖(CS,脱乙酰度≥90%,细度80 目(济南海得贝海洋生物工程有限公司);三聚磷酸钠(TPP,分析纯,天津市鼎盛鑫化工有限公司);高糖DMEM 干粉、培养基胎牛血清(均GIBCO 公司,美国);H9c2 细胞细胞株(ATCC 细胞库,美国)。
1.2 仪器与设备
Zetasizer Nano ZS 粒度分析仪(马尔文公司,英国);紫外可见分光光度计(日本电子公司);CO2恒温细胞培养箱(SANYO 公司,日本);RT-6000 酶标仪(深圳雷杜生命科学股份公司);SPECTRUM 1000红外光谱仪(Pontypool,英国);BI-2005M 激光光散射仪(布鲁克海文公司,美国)。
1.3 APS-CS NPs 的制备
1.3.1 确定CS 和TPP 浓度 不同浓度的CS 和TPP,形成纳米载体的粒径不同。在磁力搅拌下,将0.5~2 mg·mL-1的TPP 溶液分别逐滴加入不同浓度的CS 溶液中(1~2.5 mg·mL-1),滴加完毕后继续搅拌10 min,所得纳米水分散体的粒径用激光粒度分析仪测定,即可确定最小粒径时CS 和TPP 的浓度。
1.3.2 确定APS 含量 不同含量的APS 会影响APSCS NPs 纳米粒的包封率,确定包封率达到最高时APS 的投入量,以获得最佳包封率的APS-CS NPs 纳米粒。将不同含量的APS(2.5~20 mg)分别加入CSNPs 纳米水分散体系,室温下磁力搅拌过夜。16000r·min-1超速离心60 min 后,取上清液0.5 mL,用95%的乙醇溶解定容于10 mL 量瓶中,用于游离APS 量的测定。游离APS 量测定方法如下:在200~800 nm范围内用紫外可见分光光度计进行扫描,确定上清液中游离APS 的最大吸收波长,然后在该波长下测定同体积不同浓度(0.02、0.04、0.06、0.08、0.1 mg·mL-1)APS 标准溶液和上清液游离APS 的吸光度值,通过APS 标准曲线的线性回归方程,计算上清液游离APS 吸光度值所对应的浓度值,即为上清液中游离APS 的浓度。应用下述公式计算APS-CS NPs 纳米粒的包封率 (encapsulating capacity,EE):EE%=(m总APS投入量-m上清游离APS量)/m总APS投入量×100%。
1.3.3 采用最佳工艺制备APS-CS NPs 纳米粒 按照上述确定的CS 及TPP 浓度,分别配制壳聚糖溶液及TPP 溶液,用0.22 μm 微孔滤膜过滤,在磁力搅拌下,将TPP 溶液逐滴加入壳聚糖醋酸溶液中,滴加完毕再继续搅拌10 min,然后加入上述确定浓度的APS,室温下磁力搅拌过夜,超速离心(16000 r·min-1)60 min,弃上清液,沉淀物用75%乙醇、蒸馏水各洗3 遍,将得到的沉淀物于-80 ℃冷冻24 h 后,再用真空冷冻干燥机干燥成粉末,备用。
1.4 APS-CS NPs 的理化性质表征
1.4.1 红外光谱分析 通过比较APS、CS-NPs 纳米载体、APS-CS NPs 纳米粒红外光谱吸收峰的差别,判断APS 是否成功包埋在CS-NPs 纳米载体上。取干燥的APS、CS-NPs 纳米粒子、APS-CS NPs 纳米粒各2.0 mg,用玛瑙研钵研细,加入100~200 mg 磨细的干燥溴化钾粉末,混和均匀装入模具内,在压片机上压制成片,用傅里叶红外光谱仪进行红外光谱分析,并应用origin 8.0 软件绘制红外光谱图。
1.4.2 平均粒径测定 应用激光粒度分析仪测定制备的APS-CS NPs 纳米粒的平均大小及分布。将冻干的APS-CS NPs 纳米粒分散在去离子水中,超声分散均匀,用激光粒度分析仪测定纳米粒粒径,得到粒径分布图。
1.4.3 Zeta 电位测定 采用Zeta 电位仪测定APSCS NPs 纳米粒的Zeta 电位,分析该纳米粒所带电荷。将冻干的APS-CS NPs 纳米粒分散在去离子水中,超声分散均匀,用Zeta 电位仪分别检测APS-CS NPs 纳米粒的Zeta 电位。
1.5 细胞相容性评价
为验证APS-CS NPs 纳米粒是否具有细胞毒性,将浓度为10~50 μg·mL-1的APS-CS NPs 纳米粒与H9c2 细胞共同培养24、48、72 h 后,分析细胞增值率变化,评价该药物的细胞相容性。常规培养H9c2 细胞于含10%胎牛血清的DMEM 高糖培养液中,并置于温度37 ℃、5% CO2的培养箱中。培养2天后,取对数生长期细胞,调整细胞浓度为5×104个/孔,接种至96 孔板上,每孔加入100 μL,培养4 h后待细胞贴壁后,将所得细胞分为实验组和对照组,分别向实验孔加入终浓度为10~50 μg·mL-1的APS-CS NPs 纳米粒,对照孔则加入等体积的PBS,两组细胞均培养24、48、72 h。然后每孔加入10 μL MTT(0.5 mg·mL-1),继续培养4 h 后,去除上清液,每孔加入200 μL DMSO,避光振荡10 min 使结晶充分溶解,采用酶标仪在570 nm 波长处测定每孔光吸收值(Optical Density,OD),重复3 次,每次做5 个复孔取平均值。将对照组的细胞增值率定为100%,细胞增值率(%)=(A对照组-A实验组)/A对照组×100%。
1.6 统计学处理
以SPSS 18.0 统计软件进行结果分析,所有的实验数据均采用均数±标准差()表示,采用单因素方差分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 不同条件对APS-CS NPs 纳米粒粒径及包封率的影响
2.1.1 CS 和TPP 浓度对制备的APS-CS NPs 纳米粒粒径的影响 在CS-NPs 纳米载体制备过程中,CS 和TPP 浓度对能否形成纳米粒,以及形成的纳米粒的粒径有较大影响,见表1。
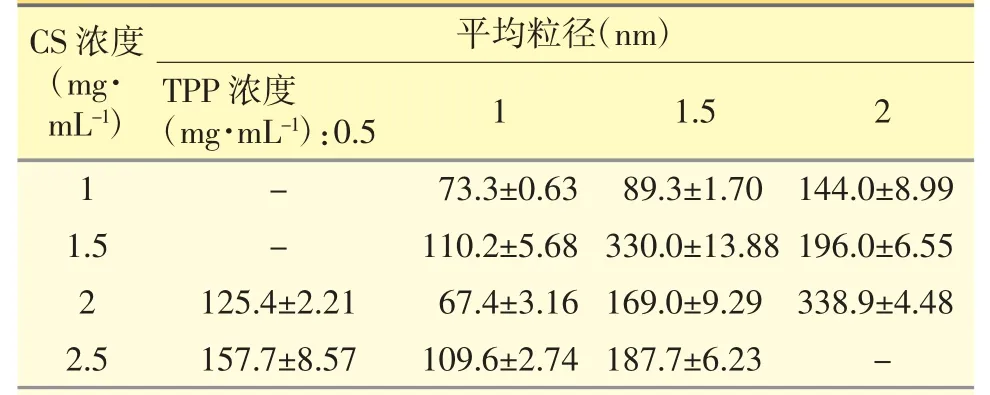
表1 CS 和TPP 浓度对纳米粒粒径的影响
当加入的CS 浓度小于2 mg·mL-1、TPP 浓度为0.5mg·mL-1时,生成的纳米粒子数量太少,溶液清亮。当CS 浓度为2.5mg·mL-1、加入的TPP 浓度为2 mg·mL-1时,CS-NPs 出现聚集,形成絮状沉淀。而不同浓度的CS 和TPP 形成的CS-NPs 纳米粒的平均粒径差异较大,CS-NPs 纳米载体的粒径并没有随着CS 和TPP 浓度的增大而增大,且规律性不强。但综合考虑减小粒径可形成较多的纳米载体,以利于对药物的包封,故选择纳米载体平均粒径最小(67.4±3.16)nm 时,CS 浓度为2mg·mL-1,TPP 浓度为1mg·mL-1做下一步研究。
2.1.2 APS 浓度对制备的APS-CS NPs 纳米粒包封率的影响 考察不同APS 浓度对APS-CS NPs 纳米粒包封率的影响,确定最大包封率时APS 的投入量。首先应用紫外分光光度法确定APS 紫外吸收波长,对APS 标准溶液在200~800 nm 进行全波段扫描,在275 nm 处产生最大吸收峰,无干扰峰存在,因此选定275 nm 作为APS 紫外吸收波长。然后在此波长下,测定0.02~0.10 mg·mL-1APS 标准液的吸光度,以峰面积A 对浓度C 做线性回归,绘制标准曲线,得回归方程为:A=0.715C-0.0017,r2=0.9990,结果显示,APS在0.02~0.10 mg·mL-1线性良好。最后根据公式计算包封率,结果显示,当APS 用量小于10 mg 时,包封率随APS 用量增大急剧升高,CS 与TPP 离子凝胶化过程中对APS 的捕捉率也相应提高;而当用量继续增大时,包封率又有所下降;当APS 投药量为10 mg时,得到的包封率最高,为89.20%。见图1。
综上所述,制备APS-CS NPs 纳米粒的最佳工艺条件是:CS 浓度为2 mg·mL-1,TPP 浓度为1 mg·mL-1,APS 浓度为1 mg·mL-1。
2.2 APS-CS NPs 纳米粒物理特征
2.2.1 红外吸收光谱 通过解析APS、CS-NPs 纳米载体、APS-CS NPs 纳米粒的红外光谱差异,可判断APS 是否结合在CS-NPs 纳米载体上。如图2 所示,APS-CS NPs 纳米粒红外光谱图的特征频率:2934.6、1637.9、1537.6、1228.3、1094.7、618.3 cm-1。其中,2934.6 cm-1是CH2反对称伸缩吸收峰,1637.9 cm-1是C=C 伸缩吸收峰,1537.6 cm-1是NH3+对称变角吸收峰,1228.3 cm-1是C-O-C (酯) 反对称伸缩吸收峰,1094.7 cm-1是C-O 伸缩吸收峰,618.3 cm-1为CO2剪式振动吸收峰。与CS-NPs 纳米载体的红外光谱图相比,特征吸收峰基本一致,但APS-CS NPs 纳米粒在618.3 cm-1出现特征吸收峰,对照APS红外吸收光谱,可知此处为APS 特征性吸收峰,由此可以推断:CS-NPs 纳米载体中含有APS,APS-CS NPs 纳米粒制备成功。
2.2.2 纳米粒平均粒径 选择CS 浓度为2mg·mL-1、TPP 浓度为1 mg·mL-1、APS 为10 mg 的条件下,制备的APS-CS NPs 纳米粒水分散体系经激光粒度分析仪测定,确定该纳米粒的粒径大小及粒径分布。从图3 可以看出,APS-CS NPs 纳米粒的平均粒径为112.4 nm,粒径分布比较均一。
2.2.3 Zeta 电位 采用Zeta 电位仪测定APS-CS NPs 纳米粒的Zeta 电位,分析该纳米粒所带电荷,结果如图4 所示,APS-CS NPs 纳米粒表面带正电荷,电位为(41.0±0.21)mV,粒度稳定性较好。
2.3 APS-CS NPs 纳米粒具有良好的细胞相容性
采用MTT 法检测APS-CS NPs 纳米粒浓度为10~50 μg·mL-1时细胞的活性,其吸光度如图5 所示,当APS-CS NPs 纳米粒浓度提高至50 μg·mL-1时,细胞增殖率仍保持在100%以上,呈增值状态,APS-CS NPs 纳米粒对细胞增殖率的影响无显著性差异(P=0.557)。结果表明,当APS-CS NPs 纳米粒浓度小于等于50 μg·mL-1时,具有良好的生物相容性,对H9c2 细胞无明显细胞毒作用。
3 讨论
为提高口服途径APS 的吸收率,本实验采用CS-NPs 作为纳米载体,吸附APS 制备出APS-CS NPs 纳米粒。首先通过检测CS-NPs 纳米粒径考察了制备APS-CS NPs 纳米粒最佳的CS 浓度和TPP浓度。CS 与TPP 的反应主要通过带正电荷的氨基和带负电荷磷酸基之间的静电引力作用,因此不同浓度的CS 与TPP 在反应中所占基团的比例也不同,会影响纳米粒子的形成及纳米粒子的粒径[7]。由表1 可见,当CS 浓度为1mg·mL-1、TPP 浓度为2mg·mL-1时,制备的CS-NPs 纳米载体粒径最小,为(67.4±3.16)nm,与以往的研究结果基本一致[8,9]。另外如若纳米粒包载APS 的量太少起不到药效,若APS 量太高则纳米粒包载不了,因此,需进一步考察不同APS 浓度对包封率的影响。结果显示,当APS 用量小于10 mg 时,包封率随APS 用量增大急剧升高,CS 与TPP 离子凝胶化过程中对APS 的捕捉率也相应提高;而当用量继续增大时,包封率又有所下降,这是因为此时体系中APS 的浓度已经足够高,包封率的大小已经不受APS 加入量的限制,而是受到纳米粒形成量的限制。本实验中当APS 投药量为10 mg 时可得到较高的包封率,即包封率为89.20%,与Vimal S 等[10]制备的DNA-CS-NPs 纳米粒子(79.9%)均具有较高的包封率。
APS 作为配体,是否与CS-NPs 纳米载体结合,需要对其结构进行表征。红外吸收光谱主要反映化合物中官能团。对比APS、CS-NPs 纳米载体和APSCS NPs 纳米粒的红外光谱发现,APS-CS NPs 纳米粒的红外光谱与CS-NPs 纳米载体的红外光谱比较相似,而与APS 的红外光谱存在明显差异,这是因为尽管APS 已达到最大包封率,吸附在CS-NPs 纳米载体上,但在APS-CS NPs 纳米粒中仍以CS-NPs 为主。在APS-CS NPs 纳米粒的红外光谱图中,618.3 cm-1出现新的特征峰,说明APS 与CS-NPs 纳米载体之间相互作用,APS-CS NPs 纳米粒制备成功。
本实验对制备的APS-CS NPs 纳米粒进行理化特性表征。Zeta 电位通常用来表征纳米颗粒的表面电荷性质,它还可以进一步用于探测带电的活性分子是包裹在纳米颗粒的中心还是表面[11]。APS 在蒸馏水中的Zeta 电位为-13 mV,CS-NPs 纳米载体Zeta 电位为(41±0.82)mV[12],APS-CS NPs 纳米粒和CS-NPs 纳米载体相同,Zeta 电位均为正,说明负的APS 分子是包埋在APS-CS NPs 纳米粒的中心。纳米粒子的Zeta 电位在±30 mV 以上被认为在悬浮状态下是稳定的[13],因为粒子之间的电荷排斥足以抑制聚集和结合。本实验制备的APS-CS NPs 纳米粒Zeta 电位值在40 mV 左右,认为具有稳定性。
最后测定不同浓度的APS-CS NPs 纳米粒对H9c2 细胞株的生物相容性,结果表明,当APS-CS NPs 纳米粒浓度小于等于50 μg·mL-1时,对H9c2细胞无明显的细胞毒作用,且APS-CS NPs 纳米粒浓度为50 μg·mL-1时,细胞增值率最高,因此,本实验成功制备出APS-CS NPs 纳米粒,该纳米粒对细胞具有良好的相容性,可用于体内体外实验研究。

