汞暴露对斑马鱼肠道菌群结构和肝脏抗氧化指标的影响
张棋麟 ,江宇航,董志祥,罗智文,林连兵 ∗
1.昆明理工大学生命科学与技术学院,云南 昆明 650500; 2.云南省高校饲用抗生素替代技术工程研究中心,云南 昆明 650500
汞被联合国列为威胁人类健康和环境的十大污染物之一,并受到了广泛的关注(Morelet al.,1998;Liet al.,2009a)。汞对水体污染十分严重,水环境中汞主要以3种形态存在:单质态、无机态(如氯化汞 (HgCl2,HGC) 等)和有机态(如甲基汞等)(Monteiro et al.,2010;Marceloet al.,2013)。汞是一种难降解、易迁移、高浓度、剧毒的全球重金属污染物。因此,世界上许多水体都存在因汞含量过高而造成的潜在环境风险。例如,在美国卡森河流域,废弃金矿附近的水体中总汞浓度已经达到了2 474 ng·L-1(Morway et al.,2017);印度西亚印第安纳州,某些黄金矿区附近的河流水体中总汞含量最高可达37 300 ng·L-1(Inoue et al.,2016);此外,中国贵州省铜仁汞矿区的地表水总汞含量也高达到81.6—4 250 ng·L-1(夏吉成等,2016)。水体汞污染作为一种典型的有害物质,在环境科学领域得到了广泛的研究和调查。然而,目前较少有研究探讨水体中汞对鱼类的影响。
肠道菌群在宿主的健康与疾病中扮演了重要的角色,被称为宿主的第二基因组(Backhedet al.,2007)。肠道菌群功能的发挥依赖于肠道菌群的组成与结构,当受到外源物刺激时,可能会导致肠道菌群紊乱,使宿主发生炎症甚至死亡。例如,当成年鲤(Cyprinus carpio)暴露于含有重金属镉的水溶液后,会导致鲤肠道菌群的多样性降低,且肠道内益生菌Akkermansia muciniphila的相对丰度显著下降(Changet al.,2019);通过对暴露于重金属铅的成年斑马鱼进行研究,研究者发现其肠道菌群的多样性与对照组相比发生了显著改变,并导致其肠道菌群失调,产生功能紊乱(Xiaet al.,2018);鲫(Carassius auratus)肠道菌群也会随着氨溶液暴露浓度的变化而改变(Qiet al.,2017)。此外,鱼体内的抗氧化酶防御体系对环境污染物敏感,因此鱼类组织中的抗氧化酶能作为环境污染物的生物标记物(Ahmad et al.,2006;Oliveira et al.,2008)。有研究报道了重金属类污染物能在鱼类的不同组织中积累,影响体内脂质过氧化物含量的变化,尤其是肝组织对水体污染物的毒害反应最为敏感,可直接影响组织中的抗氧化酶系统,诱导细胞凋亡和造成机体损伤等(刘林等,2015a)。以上研究表明,水体污染物对鱼类肠道菌群结构和肝组织影响巨大,对鱼类的健康造成了威胁。然而,迄今为止,人们对汞如何影响鱼类肠道菌群及肝组织抗氧化性能的认识仍较为有限。
斑马鱼(Danio rerio)是国际标准化组织(ISO)推荐使用的鱼类毒性试验动物,因此被广泛应用于毒理学、环境保护、发育生物学等研究,已成为一种重要的生物模型(宋志慧等,2012;Maet al.,2013)。当斑马鱼暴露于水体污染物时,其能在不同层面上(如行为、生理、表型、基因表达等)对环境非生物压力做出不同程度的响应,因此被称为水环境污染风险评估的“活监测仪”(Huet al.,2016)。然而,斑马鱼肠道菌群和肝脏抗氧化酶活性对重金属污染物的响应研究并不多见,尤其针对汞的相关报道还未发现。本研究以模式生物斑马鱼为对象,通过汞暴露诱发斑马鱼成鱼肠道菌群结构和肝脏中抗氧化酶活性的变化,旨在探讨水体中汞对斑马鱼肠道菌群结构和肝脏抗氧化指标的影响。
1 试验材料及方法
1.1 斑马鱼样品及试验方法
研究使用成年斑马鱼,购买自中国斑马鱼资源中心(CZRC,http://en.zfish.cn/)。所有斑马鱼都饲养于连续曝气的300 L水族箱中,并配备温度、光照和供氧控制装置,光周期白天和黑夜比为14 h꞉10 h,水温 (25±1) ℃,酸碱度为 (7.0±5),导电性为850—900 μs·cm-1。斑马鱼氯化汞暴露实验根据我们以前的方法进行(Zhanget al.,2020)。首先,在无菌容器中配置0.1%(1 g·L-1)的氯化汞(HgCl2,HGC,Sigma-Aldrich,美国)母液。所有动物实验完全按照昆明理工大学关于实验动物伦理道德和福利的相关规定进行(KMUSTA-2019723-01)。将40尾大小相似 (3.8±0.3) cm的成年斑马鱼平均分为2个组(每组20条),分别饲养于两个独立水族箱内(1.5 L)。HGC暴露实验组(DRM)的斑马鱼暴露在浓度为30 μg·L-1(采用冷原子荧光法测定水中Hg2+浓度(Wang et al.,2015),Hg2+浓度约为21.3 μg·L-1(Zhanget al.,2020)的HGC。在斑马鱼基因表达、氧化压力、荷尔蒙和生殖系统等对汞暴露响应的条件下,此浓度的氯化汞显然能对成年斑马鱼肠道及肝组织功能造成影响(Zhanget al.,2016;Zhanget al.,2020)。以往的研究表明:30 μg·L-1氯化汞对成年斑马鱼生殖毒理学相关指标和肠道基因表达等产生影响,故本研究选取30 μg·L-1的氯化汞作为成年斑马鱼汞暴露浓度(Zhanget al.,2016;Zhanget al.,2020)。此外,不含氯化汞水族箱中的斑马鱼个体作为对照组(DRC)。在饲养24 h后,分别随机收集处理和对照组中的斑马鱼样品各15尾。该实验分别独立重复3次作为3个生物学重复(处理组:DRM-1、2、3;对照组:DRC-1、2、3)避免单次取样和斑马鱼个体间引起的随机及偶然误差。因本研究仅关注氯化汞暴露及未暴露组间斑马鱼肠道菌群结构和肝脏抗氧化酶活间的差异,以期探讨汞暴露对斑马鱼肠道菌群结构和肝脏抗氧化指标的影响,故本研究仅设置了一个斑马鱼汞暴露组。收集后斑马鱼成体置于-80 ℃的超低温冰箱(Sanyo,日本)。
1.2 DNA提取和PCR扩增
将样品置于超净工作台(苏坤,中国)进行解剖。分别将每个个体肠道取出,并转移至1.5 mL的离心管中,用无菌水冲洗3次以去除肠道表面微生物和其中杂质。采用TIANamp Stool DNA Kit(天根生物技术公司,中国)试剂盒,按照说明书进行总DNA抽提。利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样品于离心管中,使用无菌水稀释样品至1 ng·μL-1。以稀释后的基因组DNA为模板,使用带Barcode的特异引物(V1—V9,正向引物:AGRGTTTGATYMTGGCTCAG;反向引物:GGYTACCTTGTTACGACTT、Phusion® High-Fidelity PCR Master Mix with GC Buffer(New England Biolabs,英国)和高保真酶混合体系进行16S全长的PCR扩增。PCR产物使用质量分数为2%的琼脂糖凝胶电泳进行检测;根据PCR产物浓度进行等量混样,充分混匀后使用质量分数为2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用QIAquick Gel Extraction Kit试剂盒(Qiagen,德国)试剂盒进行胶回收。
1.3 文库构建和上机测序
纯化后的16S基因全长采用SMRT Bell Template Prep Kit(Pacific Biosciences,美国)试剂盒进行文库构建:使用DNA黏合酶将测序接头连接在扩增好的DNA片段两端,用AMpure PB磁珠对DNA片段进行纯化选择,构建SMRT Bell文库。纯化后的片段经buffer回溶后,使用BluePipin片段筛选特定大小的片段,并AMpure PB磁珠对DNA片段进行纯化。构建好的文库经Qubit 3.0荧光计(英潍捷基,美国)进行浓度定量,并利用Agilent 2100(安捷伦,美国)确认插入片段长度,随后用PacBio Sequel(Pacific Biosciences,美国)平台对6个样本进行测序。
1.4 测序数据处理
将PacBio下机数据导出bam格式文件。使用Lima软件根据barcode序列区分各样本的数据,所有样本的序列以bam格式保存。然后使用CCS(SMRT Link v5.0)对序列进行校正,矫正参数为:CCS=3,最小准确率为0.9,并去除长度小于1 340 bp、最长序列长度大于1 640 bp的序列,以fastq和fasta保存;随后进行SSR过滤并使用cutadapt去除掉引物,将含有连续相同碱基数>8的序列过滤掉。经过以上处理后得到的reads需要进行去除嵌合体序列(http://www.drive5.com/usearch/manual/chimera_formation.html)的处理,reads序列通过(UCHIME Algorithm,http://www.drive5.com/usearch/manual/uchime_algo.html)与全长注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的高质量数据(clean reads)。
利 用Uparse软 件(Uparse v7.0.1001,http://drive5.com/uparse/)对所有样品的全部clean reads进行聚类,默认以97%的一致性将序列聚类成为OTUs(operational taxonomic units),同时会选取OTUs的代表性序列,依据其算法原则,筛选的是OTUs中出现频数最高的序列作为OTUs的代表序列。对OTUs代表序列进行物种注释,用Mothur方 法 与SILVA(http://www.arb-silva.de/)的SSUrRNA数据库进行物种注释分析(设定阈值为0.8—1.0),获得分类学信息并分别在各个分类水平:kingdom(界)、phylum(门)、class(纲)、order(目)、family(科)、genus(属)、species(种)统计各样本的群落组成。使用MUSCLE(Version 3.8.31,http://www.drive5.com/muscle/)软件进行快速多序列比对,得到所有OTUs代表序列的系统发育关系。最后,对各样品的数据进行均一化处理,以样品中数据量最少的为标准进行均一化处理,后续的Alpha多样性分析和Beta多样性分析都是基于均一化处理后的数据。
使用Qiime软件(Version 1.9.1)(Caporasoet al.,2010)计算Observed-otus、Chao1、Shannon、Simpson、ACE,Goods-coverage指数。Alpha和Beta多样性指数组间差异分析均进行有参数检验和非参数检验,当满足参数假设条件,则组间两两比较选用T-test检验;反之,则使用Wilcoxon秩和检验测试组间差异的显著水平,统计分析采用IBM SPSS Statistics 22软件进行。采用Qiime软件计算Unifrac距离。使用R语言(Version 2.15.3)vegan软件包绘制NMDS图。
1.5 肝脏抗氧化酶活性检测
解剖收集成年斑马鱼肝脏,后在预冷匀浆培养基(0.01 M Tris-HCl、0.001 M EDTANa2、0.01 M蔗糖、pH7.4)中研磨,以3 000 r·min-1离心,收集上清液以测定酶活性(刘林等,2015a)。然后将上清液与酶底物孵育,使用UV-8000ST分光光度计(上海元析仪器有限公司)以指定波长读取。酶活性检测一式三份。谷胱甘肽过氧化物酶(GSH-Px,E.C.1.11.1.9)、过氧化氢酶(CAT,E.C.1.11.1.6)、超氧化物歧化酶(SOD,E.C.1.15.1.1)、过氧化物酶(POD,E.C.1.11.1.7)活性和丙二醛(MDA)水平,并用作生化指标。商业检测试剂盒购自南京建城生物工程研究所(南京,中国,http://elder.njcbio.com/index_en.php),所有酶活性检测均按照试剂盒说明书测量。采用GSH-Px活性测定试剂盒(目录号:A005-1-2)测量GSH-Px活性。GSH-Px催化还原型谷胱甘肽还原过氧化氢,在420 nm处检测其吸光度。使用CAT活性测定试剂盒(目录号:A007-1-1)测量CAT活性。CAT能催化过氧化氢的分解,钼酸铵能迅速阻止过氧化氢的分解。剩下的过氧化氢可以很快与钼酸铵结合,生成一种淡黄色的络合物,可以在405 nm处测量。采用总超氧化物歧化酶(T-SOD)检测试剂盒(羟胺法)(目录号:A001-1-2)在550 nm处测定SOD活性。POD活性用过氧化物酶检测试剂盒(目录号A084-1-1)测定,POD能催化过氧化氢反应;酶活性用420 nm吸光度变化测定。使用丙二醛测定试剂盒(TBA法)(目录号:A003-1-1)在532 nm的吸收波长下测量丙二醛水平。用总蛋白测定试剂盒(双辛酸法)(目录号:A045-4-1)在562 nm处测定粗酶提取物中的可溶性蛋白质。
2 结果与分析
2.1 测序数据
对两组实验的6个斑马鱼肠道菌群测序文库进行测序,一共得到71 472条原始序列,质量控制后,得到69 344高质量序列;一共获得碱基100 717 757 bp,平均长度为1 450 bp。单独样品的测序结果如表1所示。有效序列和原始序列的比值为96.72%。每个样品详细数据测序数据和过滤后数据信息见表1。
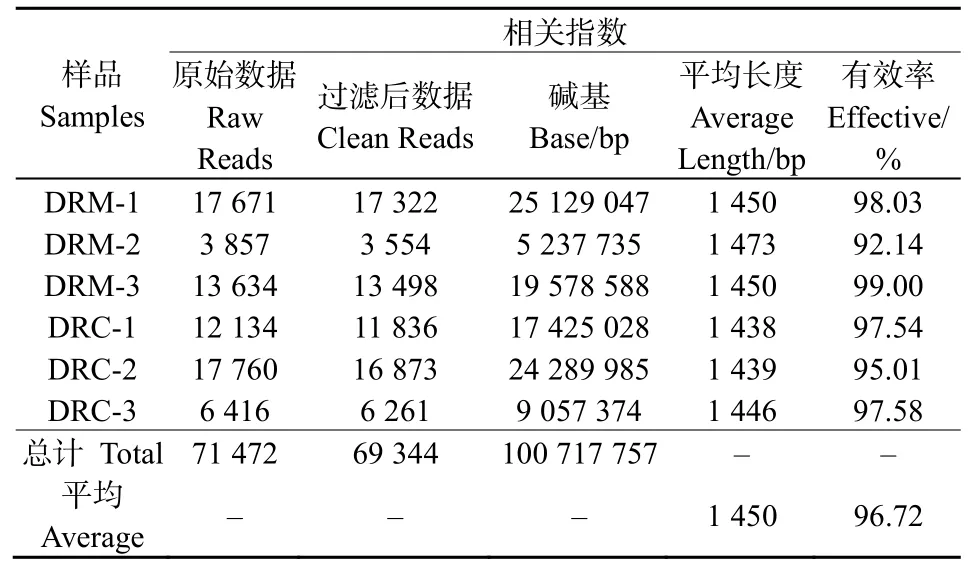
表1 不同斑马鱼肠道菌群样品16S rDNA测序基本信息Table 1 Information of 16S rDNA sequencing of different gut flora samples in zebrafish
2.2 斑马鱼肠道菌群Alpha和Beta多样性分析
NMDS(Stress<0.001)结果显示,实验组与对照组显著分开,且各自生物学重复间具有更近的距离(图1)。本研究通过Alpha多样性指数反映微生物群落的丰富度和多样性。使用Chao 1、ACE指数反映群落丰富度,使用Shannon、Simpson指数反映群落多样性。使用Coverage指数反应群落覆盖度(表2)。通过对是否暴露于重金属汞的斑马鱼肠道菌群进行统计分析发现,HGC暴露显著影响斑马鱼肠道菌群的多样性(ACE,P=0.004 6;Chao 1,P=0.008 7;Shannon,P=0.017 0;Simpson,P=0.059 0)。这些结果表明,HGC暴露显著降低了斑马鱼肠道菌群的多样性。Coverage指数均大于0.983,表明测序饱和,所测数据充分。
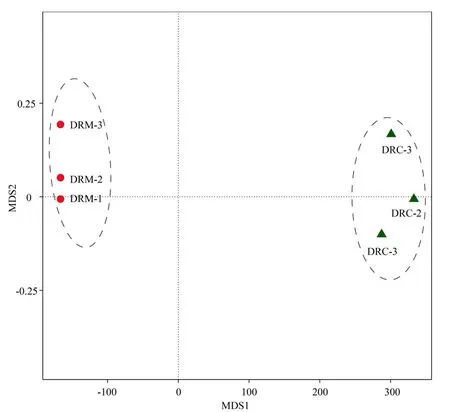
图1 不同处理样品NMDS图Fig.1 NMDS plots for different samples
2.3 肠道菌群组成及优势菌群相对丰度分析
对斑马鱼肠道菌群测序数据进行注释后,得到门、属等分类单元信息。其中,在门分类单元中,相对丰度最高的为梭杆菌门(Fusobacteria),其次为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、蓝藻菌门(Cyanobacteria)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、Melainabacteria和酸杆菌门(Acidobacteria) (图2A)。在属分类单元中,相对丰度最高的为鲸杆菌属(Cetobacterium),鞘脂单胞菌属(Sphingomonas),芽孢杆菌属(Bacillus),链球菌属(Streptococcus),邻单胞菌属(Plesiomonas),气单胞菌属(Aeromonas),Burkholderiaceae,尿素芽胞杆菌属(Ureibacillus),醋杆菌属(Acetobacter),肠球菌属(Enterococcus)(图2B)。
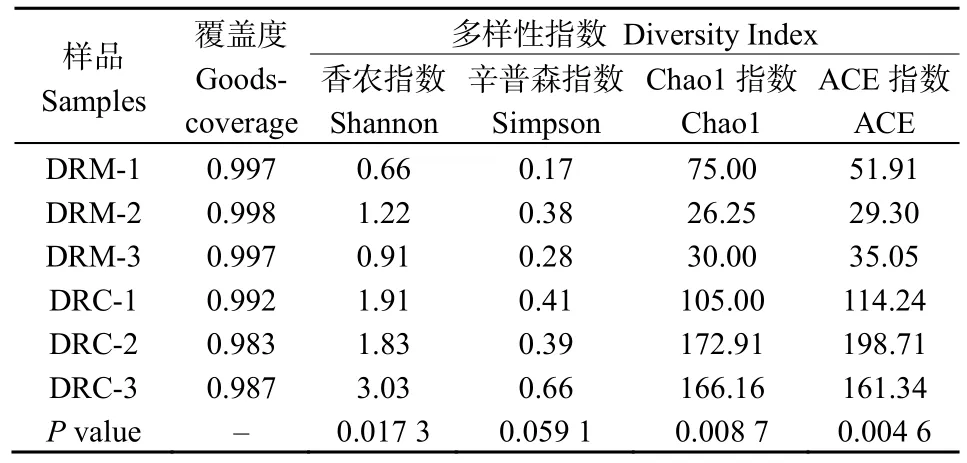
表2 多样性指数统计Table 2 Statistics for diversity indices
为探索HGC暴露对斑马鱼肠道菌群结构的影响,本研究定义相对丰度前十的菌群为优势菌群,并进一步对其在对照组和HGC处理组间的相对丰度差异进行比较分析。结果表明:相比于对照组,HGC暴露后,梭杆菌门(P=0.000 0)、变形菌门(P=0.000 2)、厚壁菌门(P=0.015 3)、拟杆菌门(P=0.030 4)、放线菌门(P=0.005 5)、蓝藻菌门(P=0.001 9)、浮霉菌门(P=0.000 2)等7个门的相对丰度发生了显著变化(表3)。其中,梭杆菌门的相对丰度上升幅度最大,与对照组中未明显检测相比其相对丰度上升至处理组中的75%以上;相反,变形菌门的相对丰度下降幅度最大,其在对照组样品中相对丰度约占75%,而在处理组样品中却仅占约20%,约降低了近4倍;同时,厚壁菌门也显示了显著的下降幅度,处理组中厚壁菌门细菌仅为对照组中约不足30%。此外,在属水平,鲸杆菌属(P=0.000 0)、鞘脂单胞菌属(P=0.000 2)、芽孢杆菌属(P=0.006 8)、链球菌属(P=0.011 2)、气单胞菌属(P=0.019 6)、尿素芽胞杆菌属(P=0.016 1)、肠球菌属(P=0.007 6)等7个属细菌的相对丰度在斑马鱼HGC暴露下也发生了显著改变。其中,鲸杆菌属、链球菌属和气单胞菌属的细菌相对丰度上呈现出显著的上升幅度,尤其是鲸杆菌属的细菌上升幅度最大,从对照组中未明显检测到上升至处理组中的75%以上;相反,鞘脂单胞菌属、芽孢杆菌、解脲芽孢杆菌属和肠球菌属的细菌相对丰度上呈现出显著的下降幅度,尤其是鞘脂单胞菌属的细菌,从对照组样品中的约70%相对丰度下降至处理组样品中的低于5%(表4)。
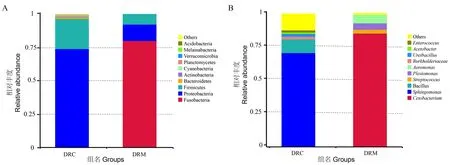
图2 门(A)、属(B)水平肠道菌群组成Fig.2 Composition of gut flora at Phyla (A) and Genera (B) level in treatment and control groups
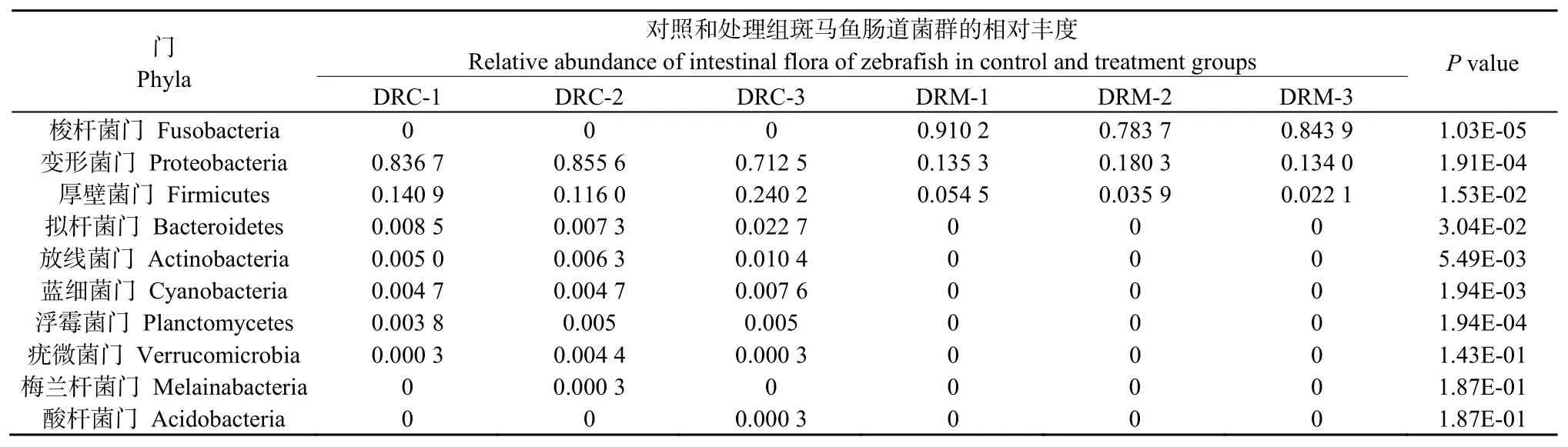
表3 门分类单元下相对丰度前10细菌的变化Table 3 Changes in relative abundance of top10 bacteria phylum taxa
2.4 肝脏抗氧化酶活性
成年斑马鱼HGC暴露后,肝脏抗氧化酶GSH-Px、CAT和SOD活性发生显著上升或下降(P<0.05),而POD活性略有上升,但差异不显著(P>0.05)(表5)。另外,相比对照组,HGC暴露组肝脏MDA水平发生显著上升(P<0.05)。具体来看,HGC暴露后,斑马鱼肝组织的GSH-Px活性(41.79±7.11) U·mg-1与对照组的GSH-Px活性(23.61±4.98) U·mg-1相比显著增高1.77倍;HGC暴露后,斑马鱼肝组织的SOD活性 (74.12±9.32)U·mg-1与对照组的SOD活性 (31.22±6.47) U·mg-1相比显著升高到了2.37倍;与此同时,MDA水平在斑马鱼HGC暴露前后变化最为剧烈,由(4.71±0.51) nmol·mg-1升 高 到 (31.26± 5.58)nmol·mg-1,升幅高达6.64倍。但通过HGC暴露处理成年斑马鱼后,却诱发了肝脏中CAT活性发生显著下降由对照组((132.63±13.87) U·mg-1下降至(53.71±8.16) U·mg-1,2.47倍)。
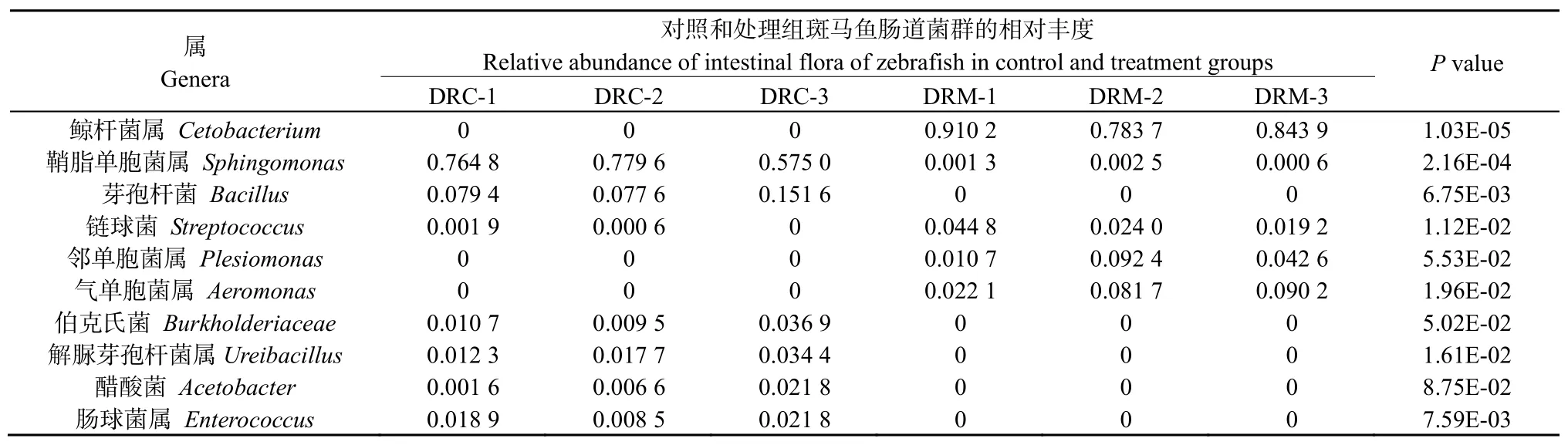
表4 属分类单元下相对丰度前10的变化Table 4 Changes in relative abundance of the top10 in genera taxa

表5 汞暴露对斑马鱼肝脏抗氧化酶(谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶、过氧化物酶)活性和丙二醛水平的影响Table 5 Effect of mercury exposure on the activity of antioxidant enzymes (GSH-Px, CAT, SOD, POD) and MDA levels in zebrafish liver
3 讨论
3.1 汞暴露对斑马鱼肠道菌群结构的影响
本研究通过第三代测序技术对对照和HGC暴露的斑马鱼肠道菌群进行16S rDNA全长序列进行高通量测序,获得了一批高质量的数据,保证了下游肠道菌群结构分析的可靠性。NMDS分析表明实验处理恰当,不同处理的生物学重复样品各自聚在一起,且处理和对照组明显分开,显示了斑马鱼肠道菌群在HGC暴露后产生了明显不同的结构特征。研究结果进一步显示对照组斑马鱼肠道菌群多样性显著高于HGC暴露组斑马鱼,可见肠道菌群多样性下降也是菌群结构变化的重要特征之一。此外,利用重金属铜处理异育银鲫(Carassius auratus)后,肠道微生物发生多样性出现显著下降(涂宗财等,2017),而且斑马鱼短期暴露于霜霉威盐酸盐时,肠道菌群的多样性也会发生显著下降(Zhanget al.,2018)。这些证据进一步支持了HGC暴露可以降低斑马鱼肠道菌群的多样性,肠道菌群多样性的下降可能是外源环境的强烈刺激对机体正常生命活动造成的一种损伤机制。当然,这还需要通过降低或提高斑马鱼肠道菌群多样性后,比较不同肠道菌群多样性斑马鱼间的行为、生理和生化等指标来进一步确认。另外,斑马鱼肠道菌群多样性的降低或可作为一个对水环境污染风险评估的潜在指标。
在门分类水平,梭杆菌门,变形菌门,厚壁菌门为的斑马鱼肠道细菌相对丰度占据前三,尤其梭杆菌和变形菌占绝大多数,该研究结果与以往大部分针对成年斑马鱼肠道菌群的研究结果相似(Bates et al.,2006;Wonget al.,2015;Zhanget al.,2019),显示了本研究测序及分析结果的可靠。同时,斑马鱼暴露于HGC,结果发现其肠道优势菌群中的梭杆菌门相对丰度发生了显著上升,而变形菌门和厚壁菌门相对丰度发生了显著下降,这也进一步表明斑马鱼暴露于HGC后,其肠道菌群在门水平的相对丰度会受到显著影响。以往研究表明,暴露于高浓度的杀菌剂抑霉唑21 d后,斑马鱼肠道内的变形菌门相对丰度显著下降,而厚壁菌门的丰度显著上升(Jinet al.,2017),厚壁菌门的变化趋势同幼年斑马鱼暴露于微塑料7 d后的一致(Wanet al.,2019)。然而,作为常见的重金属污染物,砷会改变小鼠肠道微生物的组成,造成厚壁菌门的丰度显著降低(Luet al.,2014)。可见,不同水体污染物造成的肠道细菌在门水平类型和变化趋势上存在较大差异。
在属分类水平,7个优势细菌属的相对丰度对斑马鱼HGC暴露发生了显著的响应,其中鲸杆菌属、链球菌属和气单胞菌属的细菌相对丰度上发生了显著上升,鞘脂单胞菌属、芽孢杆菌、解脲芽孢杆菌属和肠球菌属的细菌相对丰度发生显著下降,这与涂宗财等(2017)利用重金属铜对异育银鲫肠道处理后鲸杆菌属和气单胞菌属细菌相对丰度发生显著上升,芽孢杆菌属细菌相对丰度发生显著下降,具有一定相似性。尽管一些相对丰度显著改变的细菌的生物学功能尚不清楚,但其中部分细菌类群与代谢、疾病和炎症密切相关。例如,鲸杆菌属是鱼类肠道和粪便中的优势菌群(Sylvain et al.,2017),是鱼类微生物屏障功能的重要组成部分。当前环境污染物对鱼类肠道鲸杆菌属类群影响的研究还极为鲜见,本研究首次报道了重要水体重金属污染物对鱼类肠道鲸杆菌属细菌的影响。不过,在鱼类病原菌对鱼类肠道菌群影响的研究中已发现嗜水气单胞菌(Aeromonas hydrophilis)感染显著提高了成年草鱼(Ctenopharyngodon idellus)肠道内鲸杆菌属菌群的相对丰度(李东亮,2016)。本研究结果显示:当斑马鱼暴露于HGC时,肠道内鲸杆菌的相对丰度会显著增加。这些证据暗示了鲸杆菌属相对丰度的增加可能是鱼类遭受外源物刺激诱发的一个肠道细菌标志。此外,鞘脂单胞菌属是鱼类重要的益生菌(余桂娟等,2019)。本研究发现鞘脂单胞菌相对丰度在斑马鱼HGC暴露下,丰度显著降低。芽孢杆菌能对斑马鱼肠道有较好的黏附,具有免疫调节和免疫保护作用,能有效刺激斑马鱼肠道黏膜的抗炎反应和屏障再生,提高斑马鱼对嗜水气单胞菌感染的免疫抵抗能力(Wanget al.,2015)。尿素芽胞杆菌和肠球菌在斑马鱼肠道中的角色还鲜有报道,但这两类细菌已广泛作为动物肠道益生菌。链球菌和气单胞菌是自然界重要的鱼类病原菌,其病害是水产业的主要威胁之一,斑马鱼已被用于作为链球菌和气单胞菌疾病研究的模型(Neelyet al.,2002;Ayaz Ahmedet al.,2018)。这些证据表明,水体HGC暴露诱导成年斑马鱼肠道菌群失调,主要益生菌和病原菌的相对丰度都产生了显著改变。
3.2 汞暴露对斑马鱼肝脏抗氧化酶的影响
活性氧种类(reactive oxygen species,ROS)和过氧化氢(hydrogen peroxide,H2O2)水平由抗氧化防御机制的协同作用控制,抗氧化酶的活性是氧化应激、细胞膜和DNA损伤程度以及过量ROS和H2O2消除的潜在指标(刘林等,2015b;Zhenget al.,2019)。大量的研究显示水体污染物能引诱机体产生过量的ROS和H2O2,从而损伤器官和组织(Livingstone,2003;Valavanidiset al.,2006)。GSH-PX在CAT含量较低的组织中具有与CAT相似的作用,可以去除H2O2,防止H2O2对组织的氧化损伤(Eliaet al.,2006)。已有大量研究报道了GSH-PX在鱼类遭受水体污染物胁迫中的抗氧化防御作用。例如,研究发现水体中Cu2+暴露能显著提高银鲳(Pampus gentareus)幼鱼组织中的GSH-PX活性,造成抗氧化防御系统的破坏(周健恺等,2014)。本研究中,斑马鱼HGC暴露前,肝脏中GSH-Px水平较低时具有良好的抗氧化防御作用,然而,HGC暴露后,GSH-PX活性急剧上升,表明汞暴露可促进斑马鱼肝脏中抗氧化酶系统的损伤。
CAT作为清除ROS的第一道防线(Udayangani et al.,2017),且CAT是过氧化物酶体的标志酶,能催化H2O2的分解,从而使细胞免于遭受ROS和H2O2的毒害,是生物防御体系的关键酶之一(刘林等,2015a)。以前的研究发现,铅对鲫鱼组织中的CAT活性有一定的抑制作用(成嘉等,2006);也有研究报道了一种印度的淡水鱼Wallago attu在污染水体中,鱼体内的CAT活性较清洁水体中的低(Pandeyet al.,2003)。CAT活性下降可能是重金属通过置换出金属酶活性中的必要金属或结合到酶蛋白分子中的巯基、羧基等功能基团而导致的,当机体中抗氧化酶活性受到抑制后,清除自由基能力下降(刘林等,2015a)。在本研究中,与对照组相比,斑马鱼HGC暴露显著降低了肝组织CAT活性,表明水体汞对斑马鱼肝组织可能造成了氧化损伤。另外,CAT也可能是一种潜在的水环境汞污染风险评估酶学标志物,显示了其用于评估汞暴露对鱼类肝组织损伤程度的潜力。
SOD在鱼类抗氧化酶系统中起重要作用,是氧化应激的关键指示物,早已作为一种酶学标志物用于水环境污染风险评估(Carla et al.,2002)。SOD维持着机体的氧化(自由基产生)与抗氧化(自由基清除)平衡,它能通过清除超氧阴离子保护机体免受损伤(刘林等,2015a)。在哺乳动物中的研究发现,当机体受到氧化压力,生物体内会出现比正常情况下多数倍的SOD来清除过量的氧自由基,避免机体受到氧化损伤(Kellyet al.,1998)。以往研究也报道了纳米氧化锌暴露不同的时间,斑马鱼肝组织中的SOD活性上升3—5倍不等,表明了纳米氧化锌暴露对斑马鱼肝的氧化损伤(刘林等,2015a)。本研究中,HGC暴露导致了斑马鱼肝组织中SOD活性升高,进一步表明汞对斑马鱼的肝组织造成了氧化损伤,而斑马鱼肝组织通过产生更多的SOD阻止或减缓损伤进程。
MDA是脂质过氧化作用的产物,是细胞膜系统损伤的重要指标之一,其水平可用于评估组织受损伤程度(Al-Bairutyet al.,2013;刘林等,2015a)。先前的研究表明,汞暴露浓度为15 μ·mL-1时,可导致斑马鱼卵巢内的MDA水平显著上升(Zhanget al.,2016);刘占才等(2016)也发现浓度为0.5 μg·mL-1的汞暴露5 d后,草鱼肾脏中的MDA水平会出现显著上升;刘林等(2015a)甚至发现纳米氧化锌在水体中浓度超过0.01 μg·mL-1时,就能诱导斑马鱼肝组织中的MDA水平明显升高,并提出这种现象可能是组织细胞受污染物的胁迫产生过多的自由基,损伤细胞膜膜脂中的不饱和脂肪酸,破坏了细胞膜正常的结构和膜内外物质交换,从而产生大量的MDA。本研究也显示了,汞暴露斑马鱼时,其肝组织中的MDA水平上升数倍,表明汞暴露给斑马鱼肝中的抗氧化酶系统带来了巨大氧化压力,破坏了肝组织的正常功能和解毒能力。此外,本研究中,仅在24 h汞暴露后,斑马鱼肝中丙二醛水平就有较大幅度升高,说明汞暴露可在较短时间内造成斑马鱼的肝损伤。
4 结论
(1)本研究首次采用第三代测序技术及生物信息学分析,研究了重金属汞暴露前后鱼类肠道菌群结构,并比较了它们之间的差异。研究结果证实了汞暴露引起斑马鱼肠道菌群多样性显著下降,以降低斑马鱼的抗逆能力,这可能是水体污染物损伤鱼类的一种潜在机制。
(2)水体汞暴露能使斑马鱼肠道菌群中的梭杆菌门、益生菌鲸杆菌属、鱼类病原菌气单胞菌属和链球菌属相对丰度显著上升;变形菌门、厚壁菌门、拟杆菌门、放线菌门、蓝藻菌门、浮霉菌门等6个门,鞘脂单胞菌属、芽孢杆菌属、尿素芽胞杆菌属、肠球菌属等4个属肠道益生菌的相对丰度显著下降。
(3)水体汞暴露能使斑马鱼肝组织中抗氧化酶活性受到影响,引起肝组织中氧化酶及抗氧化酶系统发生紊乱,导致肝组织受损,且这种损伤在短时间(24 h)内即可产生。

