胡敏酸和富里酸对土壤中DnBP降解及微生物数量的影响规律
李玉双, 刘厶瑶, 赵晓旭, 宋雪英, 侯永侠, 魏建兵, 徐 硕
(1. 沈阳大学 环境学院, 辽宁 沈阳 110044;2. 莆田学院 环境与生物工程学院, 福建 莆田 351100)
邻苯二甲酸酯(phthalic acid esters, PAEs)是一类重要的环境激素类有机污染物,是近年来备受国内外学者和公众关注的一类全球性环境污染物.土壤中的PAEs主要来自于塑料薄膜(包括地膜和棚膜)、城市污泥农用、施用肥料和污水灌溉等[1].据统计,我国每年塑料地膜的使用面积约为1 500万hm2,地膜残留量高达12.10万t[2],残留在土壤中的地膜会释放出PAEs,经过淋溶、挥发和沉降等过程,最终在土壤中形成累积.调查研究表明我国农田土壤普遍遭受了PAEs污染[3-6],其中尤以邻苯二甲酸二(2-乙基己)酯(di-(2-ethylhexyl) phthalate, DEHP)和邻苯二甲酸正二丁酯(di-n-butyl phtalate, DnBP)的检出率和污染水平较高[7-8],部分地区土壤中这2种污染物质量分数之和高达总PAEs污染物的90%[9-10].
土壤腐殖质可以吸附大部分存在于土壤中的 PAEs,不同组分对有机污染物的吸附能力及稳定性有很大差异[11-12].胡敏酸(humic acid,HA)和富里酸(fulvic acid, FA)是土壤中重要的溶解性腐殖质组分,二者分子结构中含有大量羧基、羟基等活性基团[13],易结合土壤中有机污染物,并影响土壤有机污染物的环境归宿,因此引起了环境科学及其相关领域学者的广泛关注[14].
土壤微生物是土壤中各物质迁移转化的动力,对有机质的分解、腐殖质的形成过程都有重要作用[15-17].在自然环境中,土壤中PAEs的主要降解途径是微生物降解,微生物降解包括好氧生物降解和厌氧生物降解2种方式.土壤微生物群落结构作为土壤微生物的活性指标在一定程度上反映了PAEs污染条件下土壤微生物活性及其对有机物降解过程的变化.
本文以腐殖质的重要组分HA和FA为研究对象,以DnBP为目标污染物,通过土壤培养实验,研究外源HA和FA对土壤中DnBP降解的影响规律及其与土壤微生物数量变化的关系,以期为深入理解PAEs在土壤中的降解行为及其污染土壤生物修复提供理论基础和数据依据.
1 材料与方法
1.1 材料
供试土壤采自辽宁省沈阳市新民蔬菜基地农田,采样点地理坐标为E41°48′41″,N122°50′47″;采样深度为0~20 cm.土壤样品经自然风干后,研磨过2 mm筛.土壤类型为潮棕壤,pH值为5.81,有机质质量分数为3.01%,总氮质量分数为0.21%,总磷质量分数为0.024%,土壤中DnBP的初始质量分数为 0.04 mg·kg-1.
供试HA和FA购于南京都莱生物技术有限公司;DnBP标准溶液(1 g·L-1)购于百灵威科技有限公司;所用丙酮、二氯甲烷、正己烷等有机试剂购于康科有限公司,均为色谱纯试剂,且经色谱检验无杂峰;无水硫酸钠(分析纯)购于国药集团化学试剂有限公司,在马弗炉中于400 ℃条件下烘干4 h;玻璃器皿均用重铬酸钾洗涤液浸泡、洗净后,于450 ℃烘4 h,备用.
1.2 污染土壤制备及HA和FA添加
将一定量DnBP溶于丙酮中,配成质量浓度为2 mg·L-1的DnBP丙酮溶液,然后按1 kg土壤50 mL溶液的比例添加到土壤中,混合均匀,放在通风橱内风干7 d.土壤中DnBP处理质量分数为100 mg·kg-1.向土壤中分别加入HA和FA,使土壤中HA和FA的质量分数为10、20、40、80、160 mg·g-1(分别记作H1~H5和F1~F5),充分混合均匀.同时设不含HA和FA的对照处理组(CK).每个处理对应保留一份50 g左右的空白土壤于纸袋中,用于土壤中DnBP初始质量分数测定.
1.3 土壤培养实验
准确称取(15.000±0.002) g上述系列土壤样品于250 mL三角瓶中,按最大持水量60%加入纯水.然后用中央带透气孔的铝箔纸封口,放入恒温恒湿培养箱中培养,培养条件为:温度25 ℃,湿度80%,定期补水,维持土壤含水量.分别于实验第5、10、15、20、25、30、35、40 d采集土壤样品,室温风干,过20目筛(孔径0.85 mm),冰箱冷冻保存,用于土壤中DnBP质量分数分析.取培养第5 d的新鲜土壤样品进行微生物数量测定.每个不同HA和FA质量分数的土壤处理设置3个平行样品.
1.4 样品分析
土壤中DnBP提取采用超声波提取法[18], 提取液中DnBP质量分数分析采用气相色谱法进行[19]. 色谱分析条件参照文献[7]设定. 以3倍信噪比作为方法检出限,DnBP的检出限为0.01 mg·kg-1.DnBP加标回收率为84.33%~94.42%,土壤空白和试剂空白中目标化合物低于检出限,满足分析要求.
土壤微生物数量采用稀释平板涂布法进行计数.细菌培养选用牛肉膏蛋白胨培养基,28 ℃培养3 d;真菌培养选用孟加拉红培养基,25 ℃培养5 d.
1.5 数据分析
采用SPSS 20.0软件进行ANOVA、Pearson相关分析,采用Original 8.5.1制图.
2 结果与讨论
2.1 HA和FA处理对土壤中DnBP降解的影响
HA处理组土壤中DnBP的降解率随时间的变化如图1所示,土壤中DnBP的降解率随着培养时间的延长而增大.在培养的前10 d, DnBP降解率迅速提高,而后降解速率减慢;培养15 d以后,各处理组DnBP质量分数趋于平稳.在培养第5 d时对照处理组(CK)的DnBP降解率为49.9%,H1~H5各处理组的DnBP降解率为56.6%、59.8%、62.5%、68.6%和66.0%,分别为CK组的1.1、1.2、1.3、1.4和1.3倍;培养第10 d时H1~H5各处理组降解率分别93.6%、93.9%、94.9%、96.1%和95.6%,降解率均达到90%以上.FA处理组土壤中DnBP的降解率随时间的变化如图2所示,土壤中DnBP的降解率也随着培养时间的延长而增大.在培养的前10 d,DnBP降解率迅速提高,而后降解速率减慢;培养15 d以后,各处理组DnBP质量分数趋于平稳,与HA处理组的变化趋势相同.在培养第5 d时F1~F5各处理组的DnBP降解率为53.8%、64.5%、74.5%、68.4%和58.7%,分别为CK组的1.1、1.3、1.5、1.4和1.2倍.培养第10 d时F1~F5各处理组的降解率为93.1%、95.0%、97.0%、96.1%和93.4%,降解率均达到90%以上.

图1 HA处理组土壤中DnBP的降解率随时间的变化Fig.1 Changes of DnBP degradation rate with HA treatment over time
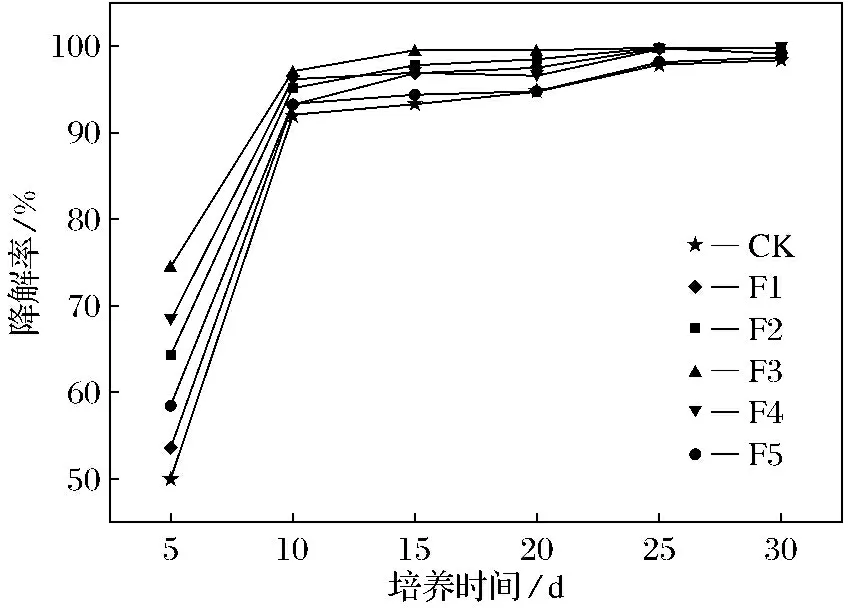
图2 FA处理组土壤中DnBP的降解率随时间的变化Fig.2 Changes of DnBP degradation rate with FA treatment over time
HA和FA各处理组DnBP的降解率均大于对照处理组,HA的最佳添加量为80 mg·g-1,而FA的最佳添加量为40 mg·g-1,FA处理获得了更高的降解率,这说明HA和FA的添加促进了土壤中DnBP的降解,且FA比HA的促进效果更佳,具有明显的质量分数效应.分析原因为外源碳的添加使菌群的氧化还原能力增强,促进了微生物的生命活动,而当添加量过高时,对土壤碳氮比影响较大,偏离了土壤微生物的最适生长条件,从而降低了微生物活性,DnBP降解率有所降低.
Cai等[20]研究发现HA和FA能够增加有机污染物的生物有效性, 且HA能够被菌株共代谢, 进一步促进污染物的微生物降解. 韩晓君等[21]研究表明土壤长期配施有机肥能够显著提高多环芳烃(PAHs)降解能力, 降解能力的增强与溶解性有机质质量分数变化及其带来的微生物活性的变化有关; 而且HA的降解效果比FA更显著. 李丽等[22]试验证明, 腐殖质加速了PAHs的降解, 提高了微生物聚生体的矿化速率. Tao等[23]研究表明, HA的添加缩短了DnBP在黑土中的降解半衰期; 李玉双等[24]研究表明HA的添加缩短了DnBP在潮棕壤中的半衰期. 这些研究均表明土壤溶解性腐殖质的添加能够促进土壤微生物对有机污染物的降解, 与本文研究结果一致.
2.2 HA和FA处理对土壤微生物数量的影响
细菌是土壤微生物中数量最多的一个微生物类群,主要参与有机质的分解和氨化作用等[25-26].表1为HA和FA处理组对土壤细菌和真菌的影响,由表1可知,HA和FA的添加促进了细菌的增殖,各处理组细菌数量均大于空白对照组.H1~H5各处理组细菌数量相较于CK组分别增加了41.8%、112.7%、140.0%、121.8%和90.9%,细菌数量随HA质量分数的升高呈先增加后减少的趋势.F1~F5各处理组细菌数量相较于CK组分别增加了72.7%、96.4%、154.6%、63.6%和56.4%.细菌数量随FA质量分数的增加也呈先增加后减少的趋势,表明适量添加HA和FA对细菌增殖效果较好.
真菌主要参与土壤中有机质的分解和腐殖质的形成,是土壤中氮、碳循环不可缺少的动力[27].由表1可知,HA和FA的添加也促进了真菌的增殖,各处理组真菌数量均高于空白对照组,H1~H5各处理组真菌数量相较于CK组分别增加了30.8%、84.0%、108.2%、122.76%和33.9%.F1~F5各处理组相较于CK组真菌数量分别增加了40.44%、74.3%、117.9%、101.7%和63.0%,真菌数量随HA和FA质量分数的增加呈现出先增加后减少的趋势,表明适量添加HA和FA对真菌增殖效果较好.
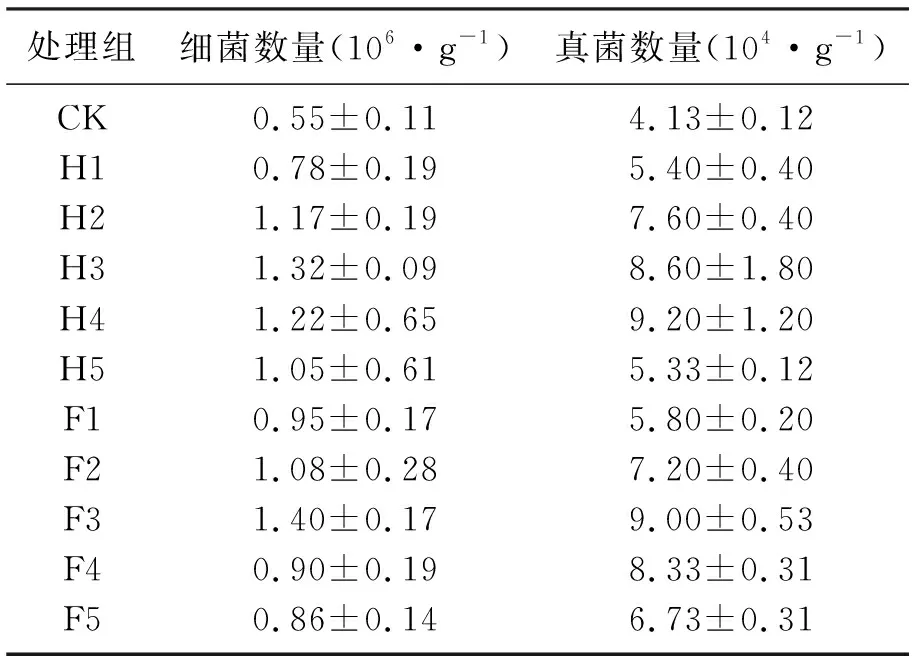
表1 HA和FA处理组对土壤细菌和真菌数量的影响Table 1 Effect of HA and FA treatment on the number of bacteria and fungi
土壤中细菌和真菌的数量随HA和FA添加量的增加变化趋势相似,HA处理组细菌数量与FA处理组的细菌和真菌数量均在添加量为40 mg·g-1时出现最大值,而HA处理组真菌的数量则在添加量为80 mg·g-1时呈现最大值.袁婉潼等[27]研究表明低量、中量和高量腐殖酸的加入都能提高盐碱地土壤中细菌、真菌数量,其中中量腐殖酸的促进作用最好,高量腐殖酸效果次之,与本研究结果相似.
2.3 土壤微生物的数量与DnBP降解率之间的相关分析
表2为土壤微生物的数量与DnBP降解率之间的相关系数,由表2可知,HA 和FA处理组细菌数量均与土壤中DnBP降解率呈显著相关关系(P<0.05),FA处理组真菌数量与土壤DnBP降解率之间呈极显著性相关关系(P<0.01),这说明土壤细菌和真菌数量的增加提高了土壤DnBP的降解率.
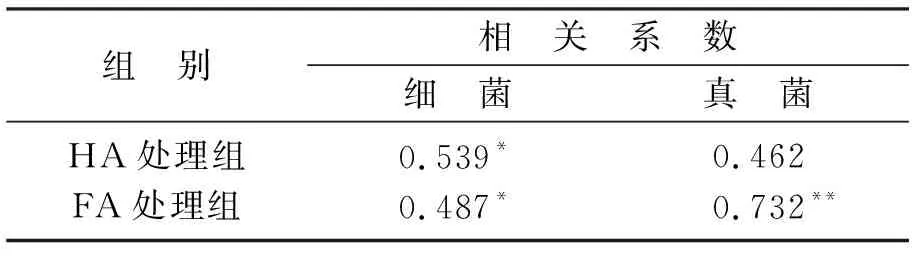
表2 土壤微生物数量与DnBP降解率之间的相关系数Table 2 Correlation coefficient between soil microbial population and DnBP degradation rate
土壤中细菌、真菌作为土壤微生物的重要组成部分, 对土壤中各物质的分解、转化、降解等过程有重要影响, 是体现土壤质量状况的重要指标[28]. 本研究结果表明, HA和FA的添加促进了土壤细菌和真菌的繁殖, 进而促进了土壤微生物对DnBP的降解. 适量添加HA和FA对微生物增殖作用显著. 但由于腐殖质的加入对土壤碳氮比影响较大, 并且HA和FA含有多种可溶性物质, 质量分数过高会形成较高的渗透压, 从而对细菌和真菌的生长和繁殖产生一定的抑制作用.
3 结 论
HA和FA的添加促进了土壤微生物对DnBP的降解,HA和FA添加量与和土壤中DnBP降解率之间具有明显的量效关系,DnBP的降解率随HA和FA添加量的增加呈先升高后降低的趋势.HA和FA的最适添加量分别为80和40 mg·g-1,该用量处理5 d时DnBP的降解率分别达68.6%和74.5%,分别为对照处理组的1.4和1.5倍;10 d时土壤中DnBP的降解率分别达96%和97%.
HA和FA的添加促进了土壤细菌和真菌的增殖,微生物数量随HA和FA添加量呈先增加再减少趋势,HA处理组细菌数量与FA处理组的细菌和真菌数量均在添加量为40 mg·g-1时出现最大值,而HA处理组真菌的数量则在添加量为80 mg·g-1时呈现最大值.相关分析结果表明HA和FA的添加促进了土壤细菌和真菌的繁殖,进而促进了土壤微生物对DnBP的降解.

