草菇响应低温胁迫的差异蛋白质组学分析
吴志亮,黄 莹,,王则金,
(1.福建农林大学食品科学学院,福建 福州 350002;2.福建省农副产品保鲜技术开发基地,福建 福州 350002)
草菇(Volvariella volvacea)又称作中国蘑菇,是热带、亚热带地区栽培最多的食用菌之一。草菇是典型的高温型食用菌,适于在高温环境下生长。当生长温度低于15 ℃时,草菇菌丝体的活力下降、生长变缓甚至死亡。当贮藏温度低于15 ℃时,草菇子实体也在12 h内发生自溶。草菇低温自溶的特性制约了草菇菌种保藏和子实体生产流通,严重影响了该产业的健康可持续发展。
目前,国内外的研究多集中于草菇菌丝体的基因水平变化。Bao Dapeng等[1]将草菇的菌丝体在4 ℃下处理0、2 h和4 h,然后通过检测每个阶段中表达的mRNA来研究草菇的低温自溶。Gong Ming等[2-3]进一步通过实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)分析发现,草菇菌丝体在4 ℃下处理4、6 h和8 h后,泛素缀合酶E2和一个具有F-box结构域细胞周期特定类型的蛋白质的基因表达显著上调,这两个基因被认为与草菇的低温自溶相关。关于草菇自溶时的蛋白质水平变化鲜见报道。本研究以草菇子实体为对象,利用蛋白质组学技术研究草菇子实体响应低温胁迫的差异蛋白质,揭示草菇发生低温自溶后的代谢通路变化,旨在为草菇低温自溶机理的进一步研究提供参考。
1 材料与方法
1.1 材料与试剂
本实验草菇(Volvariella volvacea)品种为V23,购于福建省漳州市角美镇佳兴食用菌合作社。于清晨6点采摘蛋形期草菇,采后立即运回福建农林大学保鲜实验室。
iTRAQ试剂盒 美国SCIEX公司;Bradford蛋白质浓度测定试剂盒 美国Bio-Rad公司;RNAiso Plus试剂盒、PrimeScript™ RT reagent Kit with gDNA Eraser试剂盒、TB Green™ Premix ExTaq™试剂盒 日本Takara公司;盐酸、氯乙酰胺、乙酸乙酯、脱氧胆酸钠、三氟乙酸、乙二胺四乙酸、尿素、碘乙酰胺、三羟甲基氨基甲烷、二甲基亚砜、二硫苏糖醇、六水合氯化铁、十二烷基硫酸钠、三氯乙酸 美国Sigma公司;乙腈、甲醇、乙酸 美国Thermo Fisher公司;乙基苯基聚乙二醇、甲醇、引物 上海生工生物工程股份有限公司;其他常用化学试剂(分析纯) 国药化学试剂有限公司。
1.2 仪器与设备
Triple TOF 5600 plus串联四极杆飞行时间液相色谱-质谱联用仪 美国SCIEX公司;1260半制备型液相色谱仪 美国Agilent公司;JY98-IIN超声波细胞破碎仪宁波新芝生物科技有限公司;NanoLC-Ultra 1Dplus液相色谱仪 美国Eksigent公司;5424 R台式冷冻离心机 德国Eppendorf公司;T10研磨仪 德国IKA公司;SimpliAmp热循环仪、7300 qPCR系统 美国应用生物系统公司;FluorChem FC3凝胶成相分析系统美国ProteinSimple公司;DW-86L626超低温冰箱 青岛海尔生物医疗股份有限公司。
1.3 方法
1.3.1 原料处理
挑选椭圆形、大小均一、无机械损伤的草菇作为实验对象,新鲜草菇设为对照组,低温胁迫处理组的草莓置于温度为4 ℃的冷库内12 h。取部分进行拍照;其他取样后立即使用液氮速冻,并保存于-80 ℃冰箱中备用。实验重复2 次。
1.3.2 蛋白质提取及质量浓度测定
取1 mg草菇组织样本,加入5.0 mL裂解液(含2.5 g/100 mL十二烷基硫酸钠、100 mmol/L三羟甲基氨基甲烷-盐酸缓冲液,pH 8.0),充分混合均匀。使用组织破碎仪进行组织破碎匀浆,煮沸10 min,超声(80 W)处理10 min后,12 000 r/min离心15 min,取上清液。加入上清液5 倍体积的预冷10 g/100 mL三氯乙酸-丙酮溶液,振荡混合,在-20 ℃放置2 h,4 ℃、12 000 r/min离心10 min,收集沉淀。加入预冷丙酮清洗沉淀,充分混匀后,在冰上放置15 min,4 ℃、12 000 r/min离心10 min,收集沉淀,此步骤重复2 次。向得到的蛋白质沉淀中加入500 μL复溶液(含8 mol/L尿素、100 mmol/L三羟甲基氨基甲烷-盐酸缓冲液,pH 8.0)。复溶后,加入200 μL现配的二硫苏糖醇溶液(含50 mmol/L 二硫苏糖醇、8 mol/L尿素、100 mmol/L三羟甲基氨基甲烷-盐酸缓冲液,pH 8.0),37 ℃水浴1 h。加入100 μL现配的碘乙酰胺溶液(含50 mmol/L碘乙酰胺、8 mol/L尿素、100 mmol/L三羟甲基氨基甲烷-盐酸缓冲液,pH 8.0),于室温静置1 h。于4 ℃、12 000 r/min 离心10 min,取上清液(蛋白溶液)。根据Bradford法测定上清液蛋白质量浓度。
1.3.3 蛋白组成测定
蛋白质定量后取1.3.2节所得的蛋白溶液(含50 μg蛋白质),采用12 g/100 mL十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。分离后的凝胶采用考马斯亮蓝染色法进行染色。具体操作如下:固定2 h,染色12 h,水洗至背景清晰。染色后的凝胶使用FluorChem FC3凝胶成相分析系统进行扫描,扫描模式为全彩模式。
1.3.4 胰蛋白酶酶解及标记
在蛋白溶液中加入100 mmol/L三羟甲基氨基甲烷-盐酸缓冲液(pH 8.0)。按照酶与蛋白质1∶50的质量比加入胰蛋白酶,在37 ℃下孵育振荡过夜。第2天加入1.5 µL体积分数0.1%三氟乙酸终止酶切,并调节溶液pH值至6.0,12 000 r/min离心15 min。取上清液进行固相萃取柱Sep-Pak C18脱盐,除盐后的肽段溶液经离心浓缩仪抽干后,在-20 ℃下冻存待用。每个样品取100 μg酶解后的肽段进行同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)标记。标记后的样品混合后使用Sep-Pak C18进行除盐,真空抽干。
1.3.5 高效液相反相色谱分离
采用1260半制备型高效液相色谱仪对混合样品进行反相色谱分离,最终合并为15 个组分。色谱柱:TechMate C18柱(150 mm×4.6 mm,5 µm)。流动相A:20 mmol/L甲氨酸,用氨水调pH值至10;流动相B:20 mmol/L甲氨酸(溶剂为体积分数80%乙腈溶液);进样体积:100 µL;柱温:25 ℃;流速:0.2 mL/min;运行时间:60 min;图像二极管阵列检测器检测吸收波长:216 nm;四元泵梯度洗脱。
1.3.6 液相二级质谱分析
采用串联四极杆飞行时间液相色谱-串联质谱联用仪对样品进行液相二级质谱分析。
液相色谱条件:肽段样品通过自动进样器吸入后结合至C18捕获柱(5 mm×0.3 mm,5 µm)后,被洗脱至Eksigent C18色谱柱(75 μm×150 mm,3 μm)进行分离。利用流动相A(含3%(体积分数,下同)二甲基亚砜、0.1%甲酸的水溶液)和流动相B(含3%二甲基亚砜、0.1%甲酸-乙腈溶液)建立100 min的分析梯度(0 min,5% B;0~65 min,5%~23% B;65~85 min,2 3%~5 2% B;8 5 ~8 6 m i n:5 2%~8 0% B;86~90 min,80% B;90~90.1 min,80%~5% B;90.1~100 min,5% B)。流速:300 nL/min。
质谱条件:扫描方式为质谱数据依赖型扫描模式分析,每个扫描循环中包含1 个MS全扫描(质量扫描范围:m/z350~1 500,离子累积时间:250 ms)以及40 个MS/MS扫描(质量扫描范围:m/z100~1 500,离子累积时间:50 ms)。
1.3.7 生物信息学分析
实验数据采用ProteinPilot 4.5软件分析,使用Uniprot数据库中伞菌目的Uniprot.taxonomy.Agaricales.20190429.fasta蛋白质序列参考数据库。检索结果以Unused≥1.3为标准筛选可信蛋白质信息用作后续的分析。为了获得基因本体(gene ontology,GO)注释分析、同源蛋白簇(clusters of orthologous groups of proteins,COG)分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析的数据,将差异蛋白质数据上传到NCBI数据库(https://www.ncbi.nlm.nih.gov/)、Uniprot数据库(https://www.uniprot.org/)和KEGG数据库(https://www.kegg.jp/)并分析。
1.3.8 RNA提取、逆转录和qPCR
使用RNAiso Plus试剂盒提取样品的总RNA。使用PrimeScript™ RT reagent Kit with gDNA Eraser 试剂盒去除样品总RNA中的基因组DNA并进行逆转录。使用TB Green™ Premix ExTaq™试剂盒进行qPCR。使用微管蛋白α(tubulin-α,TUB)作为草菇的内参基因来验证甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和NADH-泛醌氧化还原酶(NADH-quinone oxidoreductase,NADH)的基因。使用NCBI引物设计工具(https://www.ncbi.nlm.nih.gov/tools/primer-blast)设计引物(表1)。使用2ΔΔCt法分析数据。
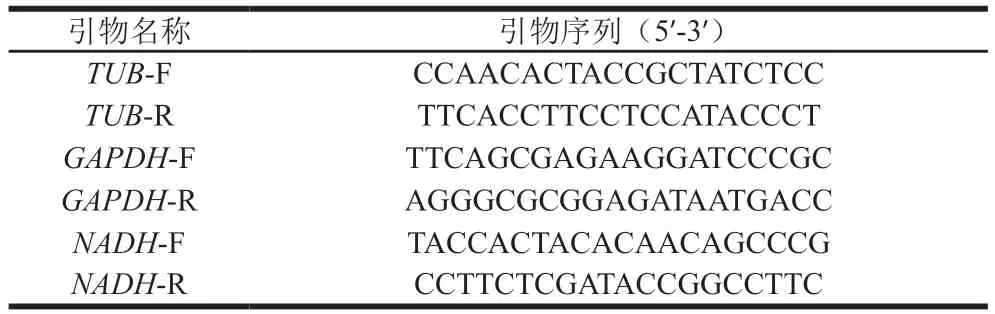
表1 本研究使用的引物Table 1 Primers used in this study
2 结果与分析
2.1 草菇受低温胁迫的形态变化

图1 草菇响应低温胁迫的形态变化Fig. 1 Changes in the morphology of straw mushroom in response to cold stress
草菇子实体由菌膜、菌托、菌伞、菌柄、菌褶构成。新鲜草菇的外部上方为灰黑色,往下至菌托渐淡,位于内部的成分均为白色,带有草菇特有清香(图1A)。经低温(4 ℃)处理12 h后,草菇发生了自溶,草菇表面覆盖水珠并发生褐变,内部以菌膜褐变最为严重,内部间隙可见自溶产生的积液,质地变软萎蔫,发出腐烂的恶臭味(图1B)。
2.2 草菇菌伞组织蛋白分析结果
分别从新鲜的草菇和经低温处理的草菇的菌伞组织提取蛋白质,根据Bradford法测定得对照组C1、C2和低温胁迫处理组CS1和CS2的上清液蛋白质量浓度分别为2.35、3.05、2.69 μg/μL和2.39 μg/μL,随后进行SDS-PAGE。由图2可知,样品的SDS-PAGE图条带清晰,样品之间平行度较好,对照组与低温处理组之间具有一定差异。蛋白质提取样本量足够,样品量适于进行后续实验。

图2 草菇菌伞组织蛋白响应低温胁迫的SDS-PAGE图Fig. 2 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis analysis of proteins in straw mushroom in response to cold stress
2.3 差异蛋白质筛选结果

表2 变化倍数较高的上调蛋白质Table 2 List of highly up-regulated proteins
草菇在4 ℃下处理12 h后,其蛋白质表达发生了一定的变化。样品经质谱检测,筛选出2 455 种Unused≥1.3的可信蛋白质。以P<0.05、变化倍数≥1.5或≤0.667(1/1.5)为依据筛选出332 种差异蛋白质,其中包含了64 种上调蛋白质、268 种下调蛋白质。表2列出了20 种变化倍数较高的上调蛋白质信息。图3为所有差异蛋白质的火山图,黑色为没有显著差异的蛋白质,蓝色为显著下调的差异蛋白质,红色为显著上调的差异蛋白质。
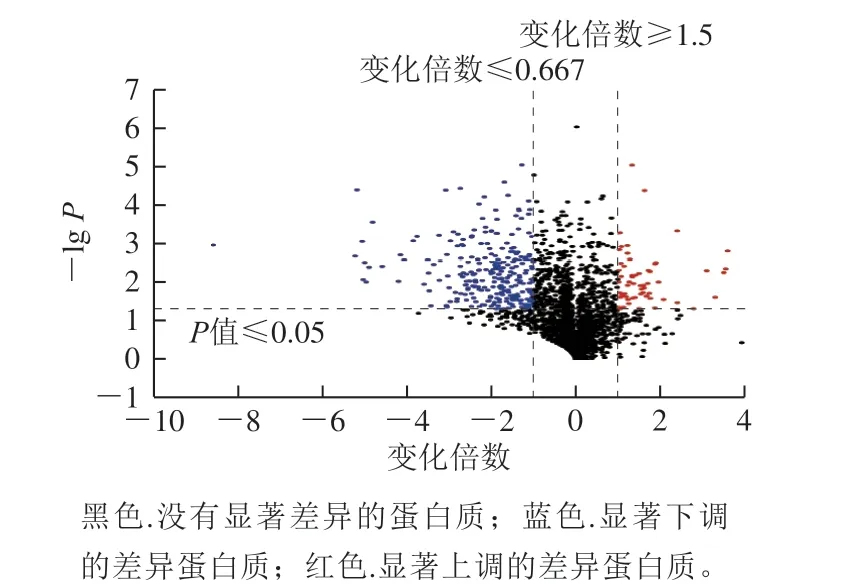
图3 草菇响应低温胁迫差异蛋白质的火山图Fig. 3 Volcanic map of differentially expressed proteins of straw mushrooms in response to cold stress
2.4 GO注释分析结果
为进一步了解草菇在低温胁迫下差异蛋白质的生物学功能,对差异蛋白质进行GO注释分析,从生物学过程、细胞组成和分子功能方面进行富集分析。生物学过程注释表明差异蛋白质主要参与细胞过程(37.04%)、代谢过程(31.71%)、定位(10.42%)、生物调节(8.33%)、细胞成分的组织或生物发生(7.18%)、应激响应(3.94%)。细胞组分注释表明差异蛋白质主要分布在细胞部分(37.68%)、含蛋白质的复合物(21.92%)、细胞器(14.04%)和细胞器部分(13.05%)等。分子功能主要涉及结合活性(45.97%)、催化活性(40.52%)和结构分子活性(8.31%)等。


图4 草菇响应低温胁迫差异蛋白质的GO注释分析Fig. 4 Gene ontology analysis for differentially expressed proteins of straw mushrooms in response to cold stress
2.5 KEGG通路分析结果
为了进一步了解草菇受到低温胁迫时代谢通路的途径信息,将差异蛋白质上传到KEGG网站,以注释序列和代谢途径。在P<0.05的范围内,有109 种差异蛋白质被注释到57 条KEGG通路上。其中差异蛋白质数量最多的通路是核糖体,有28 种,通路图是map03010(图5)。其次是RNA转运,有15 种。与甲型流感相关的差异蛋白质有13 种。与肌动蛋白细胞骨架调节相关的差异蛋白质有11 种。与紧密连接相关的差异蛋白质有10 种。与病毒致癌相关的差异蛋白质有10 种。与精氨酸和脯氨酸代谢相关的差异蛋白质有10 种。由此可见,草菇在受到低温胁迫后,核糖体、RNA转运等代谢通路受到较大影响。
2.6 COG分析结果
为研究草菇响应低温胁迫的差异蛋白质,将鉴定到的蛋白质和COG数据库进行比对,共计328 种蛋白质获得注释,分为22 种COG功能,分别用A~Z表示(表3)。如表3所示,P<0.05的功能聚类有J(翻译、核糖体结构和生物合成)、Z(细胞骨架)、Y(细胞核结构),分别包含61、19、8 种差异蛋白质。这表明低温胁迫主要影响了草菇的J、Z、Y功能,结果与KEGG通路分析结果一致。

表3 草菇响应低温胁迫的差异蛋白质COG聚类Table 3 COG clustering of differentially expressed proteins of straw mushroom in response to cold stress
2.7 qPCR验证实验结果
Western bloting技术是验证蛋白质组数据的最佳方法,但食用菌大多数蛋白质缺乏针对性的抗体,所以采用qPCR技术验证草菇蛋白质组学数据[4]。筛选常用的内参基因所对应的蛋白质(表4),翻译延伸因子1-α、β-肌动蛋白、GAPDH在蛋白质水平出现差异表达,不适合作为qPCR验证实验的内参基因。选择变化倍数小于10%的TUB-β作为qPCR验证实验的内参基因。NADH-泛醌氧化还原酶是线粒体呼吸链的复合物Ⅰ,是具有代表性的差异蛋白质。如表5所示,甘油醛-3-磷酸脱氢酶和NADH-泛醌氧化还原酶的基因转录水平表达变化和蛋白质水平一致。

表4 与内参基因相关的差异蛋白质Table 4 Differentially expressed proteins related to house-keeping genes

图5 涉及核糖体的差异表达蛋白质的KEGG代谢途径Fig. 5 Metabolic pathway maps of differentially expressed proteins involved in ribosome in KEGG

表5 关键蛋白质qPCR验证结果Table 5 qPCR validation of key proteins
3 讨 论
有研究表明低温胁迫可影响草菇的膜脂代谢、活性氧代谢、海藻糖代谢等相关生物学过程[5-7]。本研究利用iTRAQ蛋白质组学技术定量了草菇响应低温胁迫的蛋白质,一些差异表达的蛋白质可能在草菇响应低温胁迫的代谢过程中起重要作用。讨论部分归纳分析了与能量代谢、碳水化合物代谢、氨基酸合成与代谢、信号通路、活性氧代谢、膜脂代谢、核糖体代谢等代谢过程相关的差异蛋白质,旨在为草菇低温自溶机理的研究提供新的线索。
3.1 与能量代谢相关的差异蛋白质
线粒体主呼吸链(N A D H 呼吸链)由复合物I(NADH-泛醌氧化还原酶)、复合物III(细胞色素b-c1)和复合物V(ATP合成酶)组成[8]。NADH-泛醌氧化还原酶位于线粒体内膜,催化电子从NADH传递至辅酶Q[9]。细胞色素b-c1偶联催化电子由氢醌到细胞色素c的转移和质子基质由膜内向膜外空间的运输。ATP合成酶α亚基能够调节ATP合成酶的活性,ATP合成酶在跨膜质子动力势的推动下合成ATP[10]。蛋白质组数据发现NADH-醌氧化还原酶、细胞色素b-c1复合物亚基Rieske和ATP合成酶α亚基在草菇进行低温处理后上调,推测其通过NADH呼吸链增强呼吸强度以产生更多的能量以对抗低温胁迫。草菇在低温贮藏时仍具有较强的呼吸作用,线粒体主呼吸链相关蛋白质上调可能是该现象的内在原因。
丙酮酸激酶参与糖酵解过程中最后的不可逆终反应,催化生成ATP和丙酮酸,在细胞能量代谢过程中具有重要的作用[11]。柠檬酸合成酶在三羧酸循环的第一步反应中,催化草酰乙酸和乙酰辅酶A合成柠檬酸[12]。上述两个上调的差异蛋白质可能在草菇受到低温胁迫时调控能量代谢途径。
此外,数据显示ATP合成酶β亚基下调和丙酮酸脱氢酶E1α亚基上调。ATP合成酶β亚基功能紊乱与糖尿病、肥胖等多种疾病相关。研究表明,ATP合成酶β亚基的下调会加重小鼠糖尿病肾病[13],肥胖患者骨骼肌ATP合成酶β亚基合成率和活性降低[14]。丙酮酸脱氢酶E1α亚基突变或者磷酸化是丙酮酸脱氢酶系缺失的主要原因,丙酮酸脱氢酶系缺失可导致线粒体代谢紊乱[15]。低温胁迫可能导致了草菇线粒体代谢和ATP合成酶代谢紊乱,ATP合成酶β亚基和丙酮酸脱氢酶E1α亚基可能与草菇自溶相关。
3.2 与碳水化合物代谢相关的差异蛋白质
真菌细胞壁降解的酶机制十分复杂,需要大量的糖苷水解酶和碳水化合物裂解酶。糖苷水解酶(glycoside hydrolase,GH)催化糖苷键的水解,是细菌、真菌、植物和哺乳动物中碳水化合物代谢中的重要酶类[16]。GH家族13的代表酶类有α淀粉酶、环糊精葡萄糖转移酶和分支酶,可作用于淀粉、蔗糖等的α-葡聚糖[16]。对GH家族63研究最多的酶是α-葡萄糖苷酶I,其特异性水解Glc3Man9GlcNAc2的末端α-1,2-葡萄糖苷键[17]。醛脱氢酶广泛存在于白腐菌担子菌中,它们参与真菌木质素和芳香异生素的降解[18]。S-腺苷甲硫氨酸合成酶是植物合成木质素的关键酶[19]。此外,转酮酶是磷酸戊糖途径的关键酶,在磷酸戊糖途径与糖酵解的连接中起着至关重要的作用[20-21]。数据表明GH家族13、GH家族63、醛脱氢酶、S-腺苷甲硫氨酸合成酶、转酮酶这5 种蛋白质的表达量下调,说明受到低温胁迫时草菇的磷酸戊糖途径受到抑制,水解酶活性和木质素相关的代谢下降以减少不必要的能量和物质消耗。但本研究发现2 个具有水解酶活性的蛋白质表达上调,分别是碳水化合物酯酶家族9蛋白质和与EXG1-exo-beta-1,3-葡聚糖酶相关的蛋白质。推测这两个差异蛋白质可能在草菇遭受低温胁迫时使草菇的细胞壁发生降解,推测其与草菇低温自溶相关。
海藻糖是真菌中重要的贮藏性碳源之一,可被海藻糖酶水解成葡萄糖提供能量,又可在低温、干旱等胁迫环境下保护细胞[22-23]。在本研究中,海藻糖-6-磷酸合酶(trehalose-6-phosphate synthase,TPS)和海藻糖磷酸化酶(trehalose phosphorylase,TP)表达下调,而海藻糖酶表达无显著性变化。TPS参与海藻糖合成途径[22],TP则同时参与海藻糖的分解和合成[24]。TPS和TP蛋白质表达下调导致草菇耐寒性下降,这可能是草菇对低温敏感的主要原因之一。
3.3 与氨基酸合成和代谢相关的差异蛋白质
天冬氨酸氨基转移酶催化酸性氨基酸和相应的酮酸相应转化,对氨基酸代谢过程起到非常重要的作用[25]。O-乙酰丝氨酸(硫醇)裂解酶参与硫酸盐同化途径及半胱氨酸合成[26]。氨肽酶是一种蛋白酶,常应用于改善食品的风味,还应用于制备活性肽和蛋白质序列检测等领域[27-28],亮氨酸氨肽酶是最具代表性的氨肽酶,对N端带有亮氨酸残基的底物具有很高水解活性[29]。由主要组织相容性复合体(major histocompatibility complex,MHC)I类分子呈递的抗原主要由细胞溶质中的蛋白酶产生。人类细胞中的细胞溶质氨肽酶以等位基因依赖性的方式影响MHC I类分子呈递的抗原表达[30]。翻译延伸因子1α是重要的翻译因子,参与信号传导、翻译控制、凋亡、细胞骨架组成、病毒复制及癌基因转化等重要的细胞过程和疾病[31]。天冬氨酸氨基转移酶、O-乙酰丝氨酸(硫醇)裂解酶、亮氨酸氨肽酶、细胞溶质氨肽酶、翻译延伸因子1α这5 种差异蛋白质在草菇受到低温胁迫时表达上调,推测其参与调节氨基酸的合成和代谢以响应低温胁迫。
3.4 与信号通路相关的差异蛋白质
一些控制适应环境变化的信号通路对细胞周期调控、繁殖和应激反应至关重要。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是生物体内重要的信号转导系统之一,参与介导细胞生长、发育、分裂和分化等多种生理及病理过程。在本研究中,参与MAPK信号通路的丝裂原活化蛋白激酶、Ras蛋白质、Rho家族蛋白质、推定热休克同源70蛋白质表达均下调,说明草菇受到低温胁迫时MAPK信号通路受到抑制。
3.5 与活性氧代谢相关的差异蛋白质
受到低温等非生物胁迫时,细胞内自由基代谢往往被破坏,活性氧自由基大量积累并引发或加剧脂质过氧化作用,伤害膜系统和体内大分子。过氧化氢酶(catalase,CAT)是植物重要活性氧清除酶。CAT蛋白表达下调可能导致H2O2的累积,从而对草菇细胞造成氧化伤害,推测CAT活性与草菇自溶相关。
3.6 与膜脂代谢相关的差异蛋白质
脂肪酸是生物膜的核心组成部分,参与细胞结构形成、能量产生和储存,控制蛋白质定位和其他生物学重要分子的生物合成。脂肪酸合成酶α亚基的表达上调可能通过增大细胞膜的通透性以增加白灵菇的代谢产物[32]。FAD结合蛋白质是一种膜结合蛋白质,参与催化不饱和脂肪酸的生物合成,参与生物和非生物胁迫防御反应[33-34]。膜脂不饱和脂肪酸含量升高能提高植物的耐寒性[35]。数据显示脂肪酸合成酶α亚基和FAD结合蛋白质表达上调,说明草菇可能通过提高合成不饱和脂肪酸的能力来增加耐寒性,但细胞膜通透性增大被认为是因为低温对植物的伤害,脂肪酸合成酶α亚基可能与低温自溶相关。
脂氧合酶催化多元不饱和脂肪酸的过氧化反应,生成脂肪酸过氧化物和大量的活性氧自由基,其作用的底物主要是细胞质膜的多元不饱和脂肪酸,如亚油酸、亚麻酸等。本研究鉴定到亚油酸10R-脂氧合酶的表达上调,表明草菇的膜脂过氧化作用被促进。
3.7 与核糖体代谢相关的差异蛋白质
核糖体代谢通路涉及到的大多数差异蛋白质表达下调,上调的差异蛋白质包括核糖体蛋白质、40S核糖体蛋白质S4和60S核糖体蛋白质L33及未知蛋白质。核糖体蛋白质不仅能与核糖体RNA组合成新的核糖体,还具有调控基因转录、细胞增殖、分化和凋亡等核糖体外功能[36]。推测低温胁迫对草菇核糖体形成和核糖体体外功能具有一定影响,核糖体蛋白质可能与草菇低温自溶相关。
4 结 论
本研究利用iTRAQ蛋白质组学技术研究草菇子实体响应4 ℃低温胁迫的蛋白质表达变化,从蛋白质水平了解草菇低温自溶的机理。结果表明,64 种上调蛋白质和268 种下调蛋白质响应低温胁迫,生物信息学分析从宏观角度反映了草菇自溶后的生物学功能和代谢通路变化,讨论部分具体分析了与能量代谢等7 种代谢过程相关差异蛋白质,认为ATP合成酶β亚基、丙酮酸脱氢酶E1α亚基、碳水化合物酯酶家族9蛋白质、与EXG1-exo-beta-1,3-葡聚糖酶相关的蛋白质、TPS、TP、CAT和核糖体蛋白质等差异蛋白质可能与草菇低温自溶相关,值得进一步研究。

