二甲双胍激活AMPK/p53调节尿素循环抑制结肠癌HCT116细胞增殖
张 滔,胡 玲,唐加峰,徐 航,田 宽,黄世莹,杜玉梅,杨周倩, 李 静,陈地龙,冉建华
(重庆医科大学基础医学院 1.解剖教研室神经科学研究中心; 2.干细胞与组织工程研究室,重庆 400016; 3.重庆三峡医药高等专科学校,重庆 404120; 4.重庆医科大学公共卫生与管理学院;重庆 400016)
结直肠癌(colorectal cancer,CRC)是全球发病率第四的癌症,尽管近年来CRC总体发病率有明显下降,但其在50岁以下患者中的发病率却持续增加。结直肠癌的预后不容乐观,5年生存率为60%,约有一半的患者在根治切除术后死亡[1]。目前,结肠癌的治疗仍以化疗为主;常用化疗药物包括奥沙利铂、伊立替康等具有较大的毒副作用,且常发生耐药[2]。因此,研发高效低毒的抗结肠癌药物备受研究者的关注。
二甲双胍是口服双胍类药物,于1994年被美国FDA批准作为糖尿病治疗的一线药物。近年来的临床研究显示,使用二甲双胍的糖尿病患者罹患不同类型肿瘤的存活率均高,提示二甲双胍具有潜在的抗癌效果[3]。作为安全性已得到临床验证的经典药物,二甲双胍抗肿瘤作用具有良好的应用前景,成为了基础和临床研究的热点[4]。研究发现,二甲双胍作为调节糖代谢的经典药物,可通过AMPK依赖和非依赖途径诱导自噬、抗衰老、抗氧化应激、抗内质网应激、抗炎、抗纤维化等,对慢性肾脏病和急性肾损伤起防治作用[5];二甲双胍可通过AMPK通路激活p53[6],提示AMPK/p53信号通路可能是二甲双胍抗肿瘤的分子机制,但缺乏实验证据。
p53基因是人类癌症中最常见的抑癌基因之一。在肿瘤进展过程中,p53功能与多种转录和非转录活动有关,严格控制着细胞增殖、衰老、DNA修复和细胞死亡等生理过程。然而,越来越多的证据表明,p53在正常细胞和癌细胞的新陈代谢中也发挥着重要作用,其调节功能的异常与各种代谢改变密切相关,并且在肿瘤进展过程中的作用至关重要。最新的研究显示,其可通过抑制尿素循环(urea cycle,UC)发挥抗肿瘤的作用[7]。
近年来,尿素循环代谢异常与肿瘤发生发展的关系备受关注。ARG1是尿素循环关键酶之一,可将L-精氨酸代谢成L-鸟氨酸和尿素,其高表达与结肠癌预后不良有关[8]。L-鸟氨酸在胞质中被ODC(多胺生成限速酶)分解为腐胺,腐胺、精胺和亚精胺等多胺,在肿瘤细胞增殖过程中发挥重要作用。研究结果证明,ODC活性升高,可促进细胞增殖,加速肿瘤细胞的生长。二甲双胍可抑制结肠癌细胞的增殖已有报道,但是否可通过AMPK/p53信号通路调节ARG1、OTC及ODC活性抑制结肠癌HCT116细胞的增殖尚未见报道。因此,本研究以人结肠癌细胞株HCT116为研究对象,检测二甲双胍对肿瘤细胞增殖能力、细胞周期和凋亡的影响,初步探讨其调节尿素循环抑制肿瘤的机制。
1 材料
1.1 细胞株结肠癌细胞HCT116(p53野生型细胞)由课题组实验室保存备用。
1.2 主要试剂二甲双胍(纯度:99.98%,货号:HY-17471A)购自MCE公司;高糖培养基DMEM(SH30022.01)购自美国HyClone公司;南美胎牛血清(10270-106, Gibco)、胰蛋白酶(Trypsin 0.25% EDTA,25200-072,Gibco)购自美国赛默飞公司; p-AMPK(Thr172)、p-p53(Ser15)抗体购于武汉三鹰公司;p53、AMPKα、β-actin抗体购于美国CST公司,ARG1、OTC、ODC抗体购于美国Abcam公司,Cell Counting Kit-8(CCK-8,货号:CK04),BCA蛋白浓度测定试剂盒购自碧云天公司。
1.3 仪器低温高速离心机(平凡仪器,TGL-185);M450酶标测定仪、凝胶成像系统、Western blot电泳仪、电转仪(美国Bio-Rad公司);高速台式离心机(长沙平凡仪器仪表有限公司);DMi8倒置显微镜、倒置荧光显微镜(德国Leica公司)。
2 方法
2.1 细胞培养HCT116细胞培养于DMEM完全培养基中,内含10 % FBS、1 %浓度青-链霉素溶液,置于37 ℃、5 % CO2培养箱中培养,待细胞生长达到70 %时进行传代。
2.2 药物配置按照试剂商说明书提供的方法,用MCE摩尔计算器,根据实验需要称取二甲双胍,溶于适量DMEM中,然后用0.22 mm滤器过滤,现配现用。
2.3 CCK-8法检测HCT116细胞活力收集对数生长期的HCT116细胞,以5×103个细胞/孔接种于96孔板中,在细胞培养箱中孵育24 h,分别采用0、1、2.5、5、10、20、40和80 mmol ·L-1浓度的Met处理细胞,对照组加入等体积的DMEM完全培养基,每组设置5个复孔,放回孵育箱中继续培养24 h、48 h后取出,每孔加入10 μL CCK-8试剂,于37 ℃恒温箱中避光孵育2 h,酶标仪测定450 nm处的吸光度(OD)值,根据公式计算细胞存活率。存活率/% =[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。实验重复3次。
2.4 平板克隆形成实验取对数生长期细胞,0.25 %胰酶消化吹打形成单细胞悬液;以每孔500个细胞接种于六孔板中,24 h后实验组分别加入10、20、40 mmol ·L-1Met,对照组加入相应体积的DMEM完全培养基,作用48 h后更换为正常培养基,设置3个重复,连续培养2周。取出培养皿弃上清,用PBS洗两次,加入适量 4 %多聚甲醛固定15 min,洗去固定液,加入适量结晶紫染液染色20 min,洗去染色液,干燥后计数克隆形成细胞数。实验重复3次。
2.5 流式细胞术检测细胞凋亡分别收集不同浓度Met (0、10、20、40 mmol ·L-1)处理24 h的HCT116细胞,0.25 %胰蛋白酶消化成单细胞悬液,1000 r·min-1离心5 min,PBS漂洗细胞2次后行计数。收集1×106个细胞,取500 μL PBS重悬的细胞于1.5 mL EP管,按照Annexin V-荧光素(FTIC)/碘化丙啶(PI)细胞检测试剂盒说明书进行操作,用流式细胞仪进行检测并计算细胞凋亡率。实验重复3次。
2.6 流式细胞术检测细胞周期分别收集不同浓度Met处理24 h的HCT116细胞,同2.5方法收集细胞,取100 μL PBS重悬的细胞于1.5 mL EP管,加入500 μL预冷的75 %乙醇,边加边振荡,防止细胞聚集,4 ℃固定过夜。次日向各样本中分别加入一定浓度含有Triton X-100的RNase A溶液,37 ℃下反应20 min,过筛,再向每个细胞样品中加入碘化丙啶染色液500 μL,避光反应30 min后流式细胞仪检测细胞周期。实验重复3次。
2.7 免疫荧光染色在备有14 mm圆片的24孔板中接种2×104HCT116细胞,细胞贴壁后采用0、10、20和40 mmol ·L-1的Met处理细胞,24 h后吸出原培养液,PBS缓冲液洗净残留,4 %多聚甲醛室温固定20 min;加入封闭液(含0.2 % Triton X-100和4 %马血清的0.01 M PBS)37 ℃孵育30 min,然后用一抗(浓度1 ∶ 500)4 ℃冰箱孵育过夜。次日于37 ℃复温30 min,滴加稀释好的荧光二抗(Alexa Fluor 488标记山羊抗兔IgG(H+L),浓度1 ∶ 400),于37 ℃恒温箱避光孵育1 h。DAPI染核5 min后用PBS缓冲液洗净残留,最后用荧光防猝灭封片剂封片,在倒置荧光显微镜下观察并采集图片。实验重复3次。
2.8 免疫印迹实验检测相关蛋白的表达在收集各组细胞的EP管中加入预冷的细胞裂解液,冰上裂解30 min(每10 min 于涡旋振荡器上振荡5 s),以12 000×g离心力离心15 min。吸取上清液提取总蛋白质,用碧云天BCA蛋白浓度测定试剂盒测定蛋白质浓度,进行SDS-PAGE凝胶电泳,然后使用半干法将蛋白质转移至PVDF膜上。用5 %脱脂牛奶在37 ℃下封闭1 h,置于配置好的一抗(AMPK、p-AMPK、p53、p-p53、ARG1、OTC、ODC和β-actin,浓度均为1 ∶ 1 000)溶液中4 ℃过夜,次日,TBST洗膜3次,每次10 min,之后于二抗(浓度1 ∶ 10 000)溶液中孵育1 h,TBST洗膜3次,并在避光环境中将配制好的ECL发光液(A液B液按1 ∶ 1的比例混合)均匀的滴加在PVDF膜上(蜡板上操作),放入凝胶成像仪中曝光并采集图像,Image Lab图像分析软件进行条带灰度值的测量分析。独立重复试验3次。
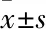
3 结果
3.1 Met抑制HCT116细胞的增殖CCK-8结果显示:24 h和48 h条件下,随Met(0、1.0、2.5、5.0、10.0、20.0、40.0、80.0 mmol ·L-1)浓度增加,HCT116细胞存活率逐渐下降,呈剂量依赖性(Fig 1),差异明显(P<0.01)。计算24 h的半数抑制浓度(IC50)约为40 mmol ·L-1,由于本研究是探究Met对HCT116细胞的增殖抑制作用,故后续实验组采取40 mmol ·L-1浓度的Met处理24 h。
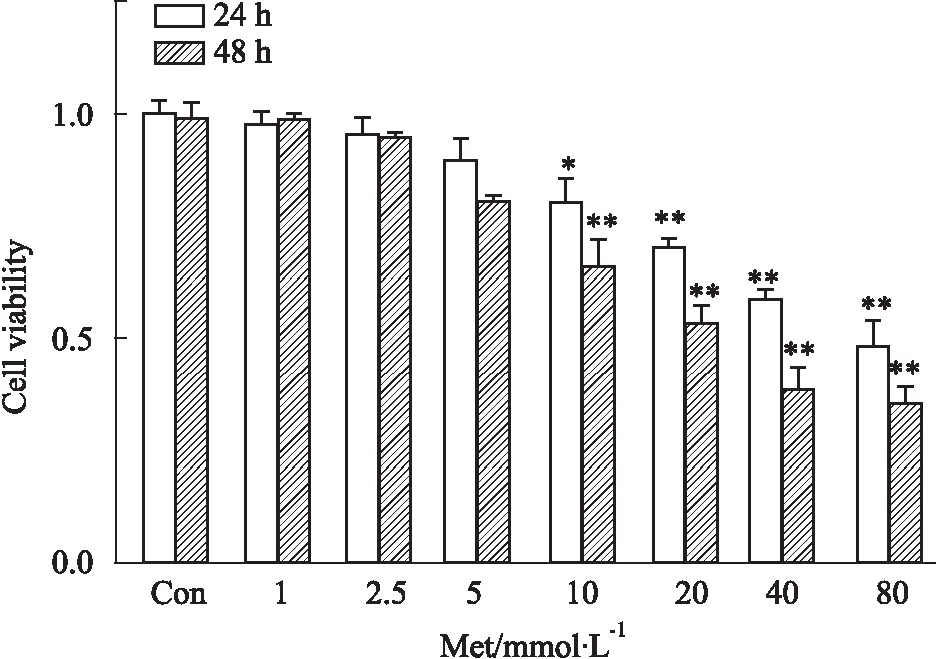
Fig 1 Effect of Met on HCT116 cells viability by CCK-8 assay n=3)
3.2 Met降低HCT116细胞克隆形成的能力与对照组相比,低(10 mmol ·L-1)、中(20 mmol ·L-1)、高浓度(40 mmol ·L-1)Met组平板克隆形成的细胞量随浓度梯度的增加而明显减少,差异有统计学意义(P<0.01),提示Met可抑制HCT116细胞增殖(Fig 2)。
3.3 Met促进HCT116细胞凋亡与正常对照组相比,不同浓度Met作用后,各组细胞凋亡率均显著升高,差异有统计学意义(P<0.01),提示Met可促进HCT116细胞凋亡(Fig 3)。
3.4 Met诱导HCT116细胞周期阻滞于G1期流式细胞技术检测细胞周期结果显示:与正常对照组相比,不同浓度Met组HCT116细胞G1期比率逐渐增高,差异有统计学意义(P<0.01),提示Met可诱导HCT116细胞周期阻滞于G1期(Fig 4)。
3.5 Met促进p-AMPK在HCT116细胞胞质和胞核中的表达免疫荧光染色结果显示:正常对照组的p-AMPK在细胞质呈微弱的绿色荧光,DAPI染胞核呈蓝色荧光;40 mmol ·L-1Met处理HCT116细胞24 h后,胞质中p-AMPK的绿色荧光强度明显增强,胞核中也有表达,差异具有统计学意义(P<0.01),提示Met激活了HCT116细胞胞质和胞核中p-AMPK的表达(Fig 5)。

Fig 2 Effect of Met on colony-formation ability of HCT116 cells n=3)**P<0.01 vs control
Fig 3 Effect of Met on apoptosis of HCT116 cells by FCM n=3)**P<0.01 vs control
3.6 Western blot法检测HCT116细胞中p-AMPK、AMPK、p53、p-p53、ARG1、OTC和ODC蛋白的表达不同浓度的Met处理HCT116细胞24 h后,Western blot检测细胞内的p-AMPK、AMPK、p53、p-p53、ARG1、OTC和ODC蛋白水平。结果显示,随着Met浓度的升高,总AMPK蛋白表达水平无明显改变,p-AMPK/AMPK(与免疫荧光结果一致),p53和p-p53蛋白水平呈浓度依赖性升高,而ARG1,OTC和ODC蛋白水平呈浓度依赖性下降,差异具有统计学意义(P<0.01)(Fig 6)。
4 讨论
二甲双胍具有良好的安全性和低成本的特点,是2型糖尿病(T2DM)的一线治疗药物。近期研究发现,使用二甲双胍的糖尿病患者在不同癌症类型中的存活率提高,提示二甲双胍具有潜在的抗肿瘤作用[6]。本研究CCK-8及细胞克隆形成实验结果发现:Met处理后,HCT116细胞存活力降低,具有时间和浓度依赖性;细胞克隆形成能力呈剂量依赖性下降,表明Met可抑制HCT116细胞的增殖。
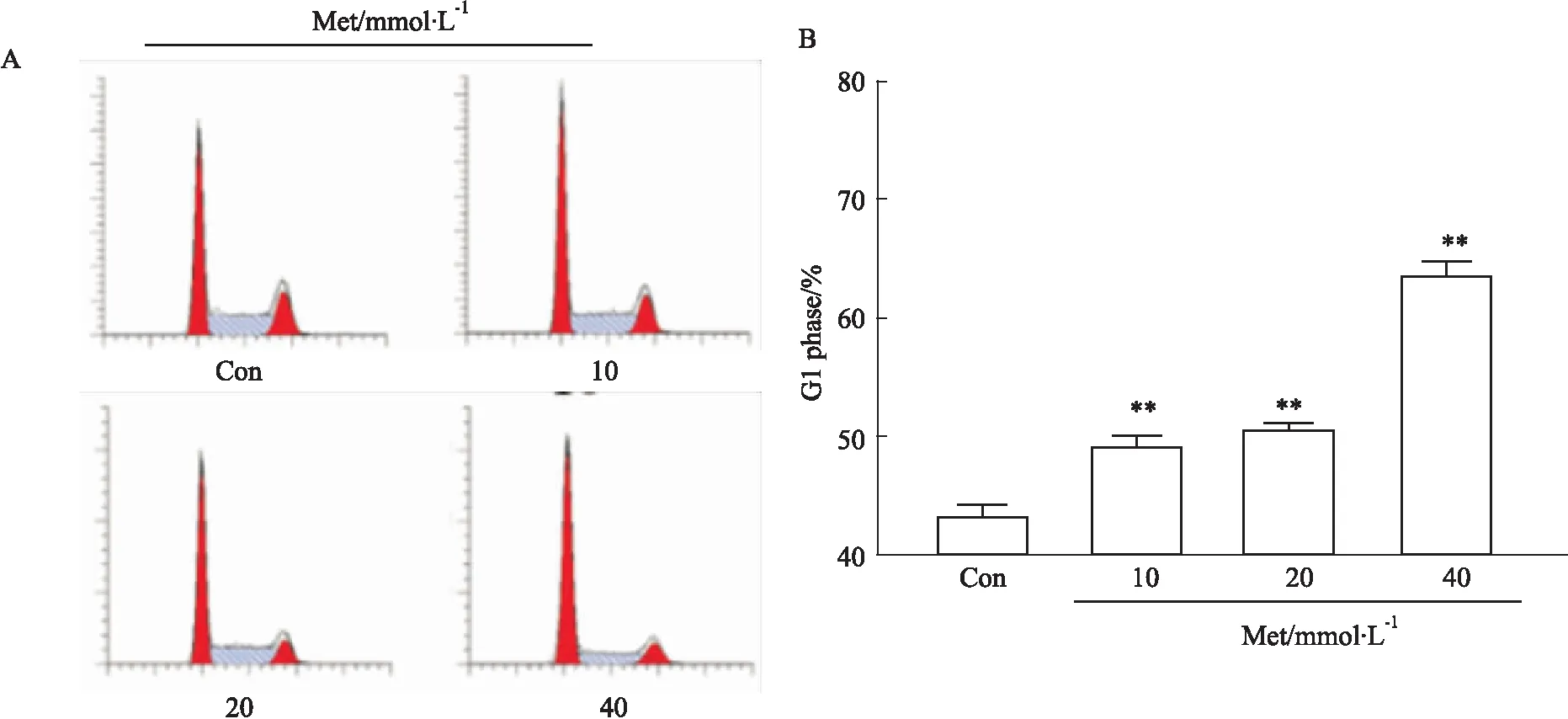
Fig 4 Effect of Met on cell cycle distribution of HCT116 cells by FCM n=3)**P<0.01 vs control
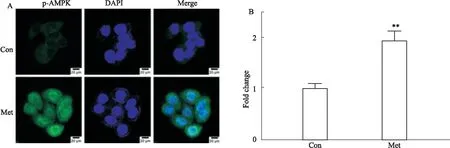
Fig 5 Effect of Met on expression and localization of p-AMPK in HCT116 cells n=3)**P<0.01 vs control
随后,二甲双胍对乳腺癌影响的研究表明,二甲双胍通过靶向AMPK信号通路抑制细胞的生长[9]。AMPK的激活可导致多种细胞事件,例如抑制细胞增殖、血管生成和脂肪酸合成以及诱导细胞周期停滞、自噬和凋亡。本研究免疫荧光结果及Western blot结果表明:Met可激活HCT116细胞中AMPK的表达发挥抑制结肠癌细胞增殖的作用。同时,AMPK调节p53的表达和磷酸化,AMPK在肝癌HepG2细胞中的激活通过稳定p53导致G 1细胞周期停滞[10]。提示AMPK/p53可能作为二甲双胍抗肿瘤的机制,而二甲双胍是否可以通过AMPK/p53信号抑制结肠癌细胞增殖未见报道。
p53参与多种细胞功能,包括细胞周期阻滞、衰老和凋亡,以及防止肿瘤的形成。本研究流式细胞术结果显示,Met处理后,细胞出现G1期周期阻滞,凋亡比率增加,呈浓度依赖性,提示Met可通过调节细胞周期诱导凋亡抑制结肠癌细胞的增殖。同时,Western blot实验结果表明:Met处理后HCT116细胞p53和p-p53的表达水平升高,证明Met可激活HCT116细胞中p53的表达。近年的研究发现,肿瘤抑制因子p53在细胞代谢调控中也发挥了重要作用[11]。然而,人们对p53依赖的限制肿瘤进展的代谢改变了解较少。最新的研究表明,p53可以通过下调尿素循环基因,抑制多胺生物合成而抑制肿瘤增殖。
肿瘤细胞不断修改各种代谢途径,以满足细胞和环境变化所决定的不断变化的代谢需求。为了实现这一目标,一种策略是减少分解代谢和氮的处理,在这一策略中,尿素循环酶的活性通常发生上调性改变。尿素循环是肝细胞处理蛋白质和氨基酸代谢所产生有毒氨的重要生理过程,最终产生尿素,随尿液排出体外[12]。尿素循环的抑制,可导致氨的堆积,有研究结果表明,二甲双胍可通过自噬缓解氨诱导的星形胶质细胞老化[13]。越来越多的研究结果表明,尿素循环酶的变化不仅与肿瘤的发生和发展有关,而且与乳腺癌、肝细胞癌和结直肠癌等的生存期差有关。关于结肠癌的临床研究显示:结肠癌患者的ASS1、ARG1、OTC等尿素循环基因水平发生上调改变,提示尿素循环调控异常与结肠癌病人预后有关[14]。Ma等[15]发现,ARG1的表达升高与结肠癌的预后不良有关,同时在急性髓系白血病及神经母细胞瘤、肺癌中也发现ARG1表达升高。基于以上研究结果,本研究对Met处理后HCT116细胞内尿素循环酶蛋白的表达水平进行了检测,结果表明:Met处理HCT116细胞后,尿素循环酶ARG1和OTC的表达下降,提示Met可以通过抑制尿素循环发挥抗结肠癌细胞增殖的作用。
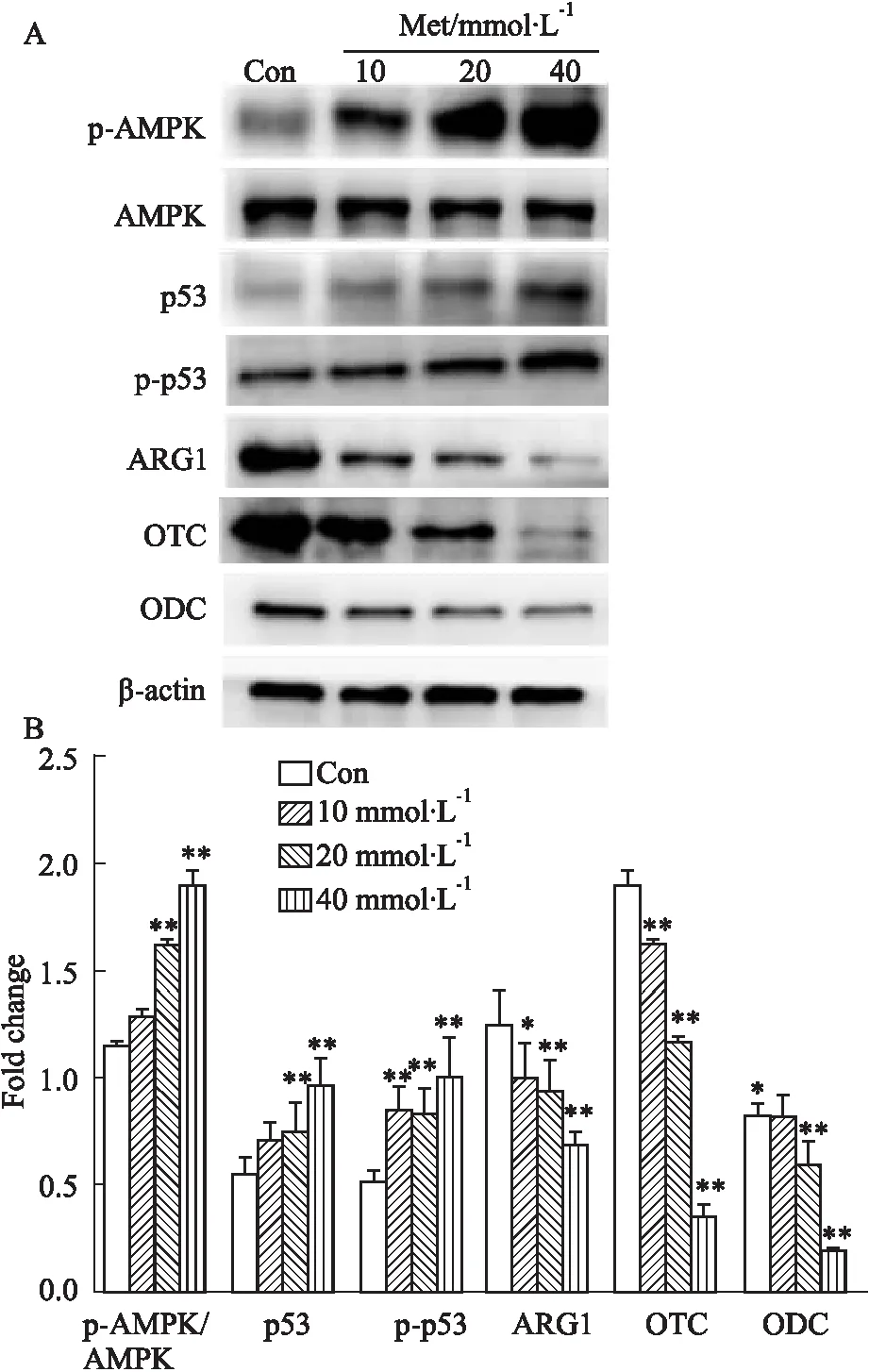
Fig 6 Effect of Met on expression of p-AMPK, AMPK, p53, p-p53,ARG1,OTC and ODC protein in HCT116 cells n=3)
同时,尿素循环的中间产物胞质鸟氨酸是多胺生物合成和肿瘤生长所必需的。多胺是聚阳离子化合物,在大肠直肠癌发生的几乎所有步骤中都起着关键作用。ODC作为多胺合成的限速酶,在肿瘤中经常出现功能失调,且在细胞增殖中起关键作用[16]。在肿瘤形成过程中,ODC激活导致多胺的浓度增加。与邻近的黏膜和同等的正常组织相比,结肠癌中的多胺含量及ODC活性更高[17]。ODC抑制剂二氟甲基鸟氨酸(DFMO)已经进入临床试验用于防止神经母细胞瘤的复发以及降低患结肠癌或胃腺癌的风险[18]。因此,抑制ODC活性从而发挥抗肿瘤作用可能是药物的作用靶点。本研究结果发现:Met可使HCT116细胞内ODC的表达水平下降。
综上所述:Met对HCT116细胞有良好的抗肿瘤活性,能诱导细胞凋亡,阻滞细胞周期,进而抑制肿瘤细胞的增殖。其机制可能是Met通过激活AMPK/p53,下调尿素循环基因ARG1和OTC,导致ODC活性下降,从而抑制HCT116细胞增殖。本研究结果为二甲双胍作为抗肿瘤药物提供新的思路,接下来课题组将对ARG1、OTC及ODC水平改变如何影响结肠癌HCT116细胞代谢的变化进行深入的研究。