马氏珠母贝双链RNA干扰实验条件优化
黎楚怡,熊新威,杜晓东,2
马氏珠母贝双链RNA干扰实验条件优化
黎楚怡1,熊新威1,杜晓东1,2
(1.广东海洋大学水产学院//2.广东省珍珠养殖与加工工程技术研究中心,广东 湛江 524088)
【】优化马氏珠母贝()双链RNA干扰实验的条件。注射不同次数的干扰探针进行不同时间的干扰,通过实时荧光定量检测基因的表达;通过扫描电子显微镜观察贝壳珍珠层内表面新生层的生长并分析不同组别贝壳的生长情况。注射60 μg探针1次时,实验组基因在外套膜套膜区相对表达量显著低于对照组,且实验组基因6 d的相对表达量显著低于4 d;注射60 μg探针2次时,8 d基因在外套膜套膜区的相对表达量显著低于对照组。扫描电子显微镜观察结果表明,所有实验组贝壳珍珠层均出现无序生长;与实验组4 d和8 d相比,6 d时新生珍珠层新生层边界完全被破坏,并且出现更多散乱的细小晶体。注射60 μg双链RNA探针1次并在6 d后收集样品,为马氏珠母贝双链RNA干扰实验探究基因功能的稳定高效条件。
马氏珠母贝;双链RNA干扰;优化
RNA干扰(RNA interference,RNAi)是指一种分子生物学上由双链RNA(double-stranded RNA,dsRNA)分子在转录水平诱发的基因沉默现象[1]。RNA干扰的作用机理:(1)起始阶段:外源dsRNA被Dicer酶切割成大小约21 ~ 23 bp的小干扰RNA(small interfering RNA,siRNA);(2)效应阶段:siRNA双链结合核酶复合物,形成RNA诱导的沉默复合体(RNA-induced silencing complex,RISC),RISC中siRNA变性解开双链,反义链结合在复合物上,并引导RISC与同源的靶mRNA结合,在核酸内切酶的作用下,自siRNA中点位置处将靶mRNA切断,阻断其翻译成蛋白质[2-3];(3)扩增阶段:以siRNA中的一条链为引物、靶mRNA为模板,在RNA介导的RNA聚合酶作用下,扩增靶mRNA,产生新的siRNA反作用于靶mRNA,使其降解[3]。
昆虫进行RNAi多数采用显微注射dsRNA、饲喂法。饲喂法主要通过将dsRNA导入细菌或混入食物、能表达dsRNA的转基因植物喂养昆虫[4-5];在抗病毒感染方面主要是针对病毒的保守序列、宿主细胞表面受体基因合成siRNA及构建表达载体,通过脂质体转染、显微注射及其构建逆转录病毒载体或腺病毒载体进入小鼠体内抑制病毒[6-7];在植物基因功能研究中通常构建含发卡结构的双链RNA(hairpin RNA,hpRNA)T-DNA质粒或含内含子的ihpRNA(intron-containing hairpin RNA),利用基因枪整合至细胞、农杆菌介导dsRNA转化整合至染色体[8-9];甲壳动物RNAi一般体外转录和载体构建合成dsRNA或siRNA并将其注射到血淋巴、肌肉或卵粒中,或将动物组织与双链RNA进行离体培养[10]。基因枪法只能使植物基因产生瞬时沉默效应,而农杆菌介导体内表达dsRNA可获得长效并稳定遗传的基因沉默效应[8];饲喂法因dsRNA或siRNA容易被降解,沉默效果较差,但不会对实验对象造成损伤,适用于动物体;注射法需要实验对象进行血液循环,使dsRNA或siRNA迅速到达靶组织,但是操作要求高,操作参数需要优化,体型小的昆虫等容易被注射操作的机械损伤而导致死亡[5]。双壳类软体动物的体型相对昆虫来说较大,双壳类软体动物具有开管式血液循环系统,血液可以浸入各个组织器官与其进行物质交换,双链RNA干扰探针通过注射法进入体内,可快速达到靶组织、靶器官对靶基因进行干扰。
Pif是马氏珠母贝中研究较为透彻的一个基质蛋白,RMKR是翻译加工中经常观察到的一个Kex2-like蛋白酶裂解位点,前体蛋白pif 177通过修饰切割形成Pif 80、Pif 97[11-12]。Pif 80、Pif 97分别位于Pif蛋白的C、N末端[13],多肽Pif 80-11促进文石在β-几丁质基质上成核[11];Pif 97蛋白具有VWFA(Von Willebrand factor type A domain)和CHIT_BIND_II(Chitin-binding type-2 domain),能结合几丁质框架并促使片层结构的形成[14]。郑哲[15]研究结果显示let-7e、miR-2305 的过表达能使基因表达的显著性下调,导致实验贝珍珠层结晶出现紊乱;董冰冰等[16]研究结果表明基因表达量呈现随pH降低而降低的变化趋势,海水酸化影响钙沉积,引起珍珠层形貌特征的变化。Suzuki M等[11]通过注射dsRNA干扰,其表达水平显著降低并观察到珍珠层无序生长。作为典型的矿化基因,其表达量高低已被用于评估珍珠贝在胚胎发育,壳损伤修复等过程是否发生了矿化的参考。
马氏珠母贝(),隶属于软体动物门,双壳纲,珍珠贝目,珍珠贝科,珠母贝属[17],是我国人工培育海水珍珠的主要经济贝类之一。贝壳是典型的生物矿化材料[15],RNA干扰技术是探究基质蛋白矿化功能的重要技术。然而在双壳贝类,已有研究表明,通过RNA干扰探究基因功能的方法参差不齐,还没有专门针对双链RNA干扰条件的研究可供参考。本研究选用马氏珠母贝典型矿化基因作为干扰对象,在实验室前期较成熟的RNA干扰条件下,比较3种不同干扰条件的干扰效果,明确马氏珠母贝双链RNA干扰的最佳条件,优化缩短RNA干扰的实验周期和RNA干扰探针用量,为后期马氏珠母贝基因功能的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 实验材料 本实验对象为1.5龄马氏珠母贝,壳长5 ~ 6 cm。材料来源于广东省湛江市雷州市覃斗镇后洪村。
1.1.2 实验试剂 Reverse Transcriptase M-MLV、Recombinant RNase Inhibitor (40 U/μL)、5XM-MLV Buffer、pMDTM 18-T Vector Cloning Kit、Premix TaqTM (TaKaRa TaqTM Version 2.0)购自大连宝生物公司,SMARTer™ RACE cDNA Amplification Kit购自Clontech Corporation,Trizol、SYBR® Select Master Mix购自Life Technologies Corporation,GeneJET Gel Extraction Kit购自Thermo Scientific、
1.2 方法
1.2.1 引物合成 根据已获得序列全长,利用Primer Premier 5 引物设计软件设计引物(实验所需用到的引物详见表1)。分别在上、下游引物的5′端加上T7RNA聚合酶的启动子序列(表1下划线部分,序列为GCGTAATACGACTCACTATAGGG),随后由上海生工公司合成引物。

表1 本实验所用引物及其序列
1.2.2 mRNA的提取及cDNA第一链的合成 运用Trizol法提取外套膜组织的总RNA,通过琼脂糖凝胶电泳验证其完整性,Nano Drop 2000核酸定量仪测定RNA浓度及纯度。参照Reverse Transcriptase M-MLV说明书,操作合成cDNA第一链。
1.2.3 探针制备 采用多聚酶链式反应扩增对中间片段进行扩增。先通过琼脂糖凝胶电泳检测产物,后根据纯化回收试剂盒说明书纯化目的基因;回收目的基因片段导入到pMD-18T载体中,再转化到DH5α感受态细胞中,挑取阳性单克隆菌落进行菌落PCR检测,对目的菌进行保种并送至生工生物工程(上海)股份有限公司分部广州测序部测序。对测序结果正确的目的菌进行质粒提取作为体外转录合成探针的模板。按照Thermo Scientific体外转录说明书进行探针的合成,1.0%琼脂糖凝胶电泳检测dsRNA的完整性(图1),用核酸定量仪检测dsRNA的浓度和纯度;用DEPC水将dsRNA的浓度稀释为600 ng/μL,-80 ℃保存备用。

图1 琼脂糖凝胶电泳检测dsRNA-Pif和dsRNA-RFP
1.2.4 RNA干扰 RNA干扰实验方法参照郑哲[15]、董冰冰等[18]文献提到方法的基础上进行修改。挑选规格一致健康的30只马氏珠母贝,随机分成3组,1组实验组(注射dsRNA-);一组阴性对照组(注射dsRNA-RFP)和一组空白对照组(注射DEPC水),每组10只,每只注射探针浓度为600 ng/μL,剂量为100 μL。实验统一使用工业生产使用的排贝法并采用微量注射器往闭壳肌中注射探针。
每组按照以下实验设计处理:
(1)注射一次探针,在4 d和6 d时分别将实验组和对照组8只马氏珠母贝迅速分离马氏珠母贝的外套膜区,将其放入液氮罐中速冻保存,并将对应的贝壳做好标记,置于封口袋中保存。
(2)以4 d为周期单独注射共2次,在8 d时分别将实验组和对照组8只马氏珠母贝迅速分离马氏珠母贝的外套膜区,将其放入液氮罐中速冻保存,并将对应贝壳做好标记,置于封口袋中保存。
实验收集的所有组织样品按照1.2.2的方法进行总RNA的提取及反转录成cDNA模板第一链,再利用实时荧光定量PCR技术检测基因的相对表达量,方法见1.2.5。挑取基因相对表达量出现下调的贝体贝壳,使用切割机将贝壳珍珠层和棱柱层交界部分以1 cm×1 cm的规格切块,随后用去离子水温和地冲洗干净,置于阴凉通风处晾干,经离子溅射仪溅射3 min,用扫描电子显微镜(Scanning electron microscope)观察贝壳内表面珍珠层结晶形貌的超微结构。
1.2.5 实时荧光定量PCR 以反转录得到的cDNA第一链作为模板,马氏珠母贝的β-actin基因作为实时荧光定量的内参基因,每个样品进行3个平行复孔的重复。采用2–ΔΔCT法对实时荧光定量PCR的数据进行处理,利用SPSS 19.0软件单因素方差分析对目的基因的表达量进行显著性差异分析,显著性水平为0.05。
2 结果与分析
2.1 RNA干扰后荧光定量
实时荧光定量PCR技术检测马氏珠母贝基因在外套膜区的相对表达量。注射一次探针后,实验组在4 d和6 d时基因的相对表达量较对照组出现显著性降低,且6 d时基因的相对表达量显著低于4 d(图2 A,表2)。以4 d为注射周期,注射2次探针后,在8 d时实验组基因的相对表达量显著低于对照组(图2 B,表2)。实验中,阴性对照组和空白对照组基因相对表达量均无显著性差异。
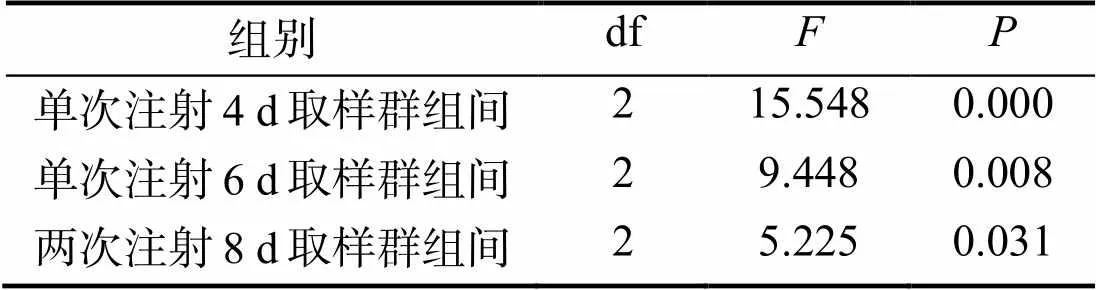
表2 单因素方差分析参数

标注不同字母表示组内存在差异显著(< 0.05),标注*和**表示组间存在差异显著(< 0.05)
Mean values with different letters are significant different in the group(<0.05); the labels * and ** are significant difference between the groups (<0.05)
图2 RNA干扰后4 d、6 d和8 d基因的相对表达量
Fig. 2 The relative expression ofgenes in 4 , 6 and 8 days after RNA interference
2.2 RNA干扰后贝壳的超微结构
通过扫描电子显微镜观察贝壳内层新生层,空白对照(DEPC组)和阴性对照组(RFP组)马氏珠母贝珍珠层结晶形态为清晰的椭圆型或多边形,界限清晰明显,各板块结晶排列紧密,结晶体和结晶层排列规则且表面光滑平整(图3_1,图3_2,图3_5,图3_6,图3_9,图3_10)。是参与珍珠层形成的基因,可控制文石在多糖基质的成核并形成多边形片结构[13, 19],经过注射dsRNA-探针进行干扰后珍珠层生长会出现紊乱。不规则、晶体的晶型基本被破坏(图3_7)且在3 000倍下可明显看见边界处出现很多不规则细小晶体(图3_8),干扰效果最为显著;4 d的珍珠层出现紊乱生长现象(图3_3),晶体晶型无序生长,排列不规则,3 000倍下边界没有细小晶体(图3_4),干扰效果较好;以4 d为注射周期,注射2次dsRNA-探针干扰后,8 d时贝壳珍珠层内表面形貌结构亦发生了紊乱生长(图3_11),3 000倍下边界还能区分部分珍珠质板层边界且出现少量细小晶体(图3_12),干扰效果较差。

1、5、9是空白对照组贝壳珍珠层的超微结构,2、6、10是阴性对照组贝壳珍珠层的超微结构,3、7、11是注射dsRNA-Pif后贝壳珍珠层的超微结构;4、8、12分别是对3、7、11珍珠层局部的放大图
3 讨论
双链RNA干扰是通过导入外源双链RNA,形成RISC复合物以切断体内目标基因mRNA序列,从而降低基因表达水平的一种技术,是研究基因功能的重要技术。目前在双壳类中主要方法是通过开贝钳撬开贝壳、注射探针,并于一定时间后进行取样检测。文献检索显示[11,20-24],进行RNA干扰时,在注射的浓度、剂量和干扰持续的时间上存在差异,没有专门的参考标准。
RNA干扰效果存在剂量效应。Suzuki等[11]采用浓度分别为5、15和30 μg的RNAi探针,结果显示随着探针浓度增加,基因表达水平降低;甲干初[20]实验结果显示注射40、80 μg RNAi探针基因表达量与对照组相比分别下降60%、65%,通过扫描电子显微镜观察发现注射40 μg的贝壳内表面边缘发生卷皱、晶体无序堆积,而注射80 μg的贝壳的晶体无序堆积更为明显;黄荣莲等[21]采用注射60 μg的RNAi探针,结果显示实验组马氏珠母贝外套膜边缘区和套膜区的表达量分别下调61.42%和45.15%,显微结构观察发现珍珠层、棱柱层晶体生长紊乱、排列混乱。通过对比甲干初、黄荣莲等贝壳微观结构发现,随着RNAi探针浓度增加,贝壳内表面新生层的晶体排列混乱程度、结晶板块的形态等超微结构加深,而基因表达量均可显著下调。尽管RNA干扰效果存在剂量效应,但浓度剂量越大,制备双链RNA干扰探针的成本就会越高。本实验室前期,通过文献调查,已成功将RNA干扰技术运用于马氏珠母贝基因功能研究,实验条件:RNAi探针用量为60 μg,注射2次,2次注射间隔周期为4 d,在距离第一次注射8 d时进行样品收集[21]。该方法虽然能够取得较好干扰效果,却存在实验周期长,成本较高等缺陷。目前2次注射仍是实验室前期常用实验条件,由于RNA干扰效果还存在时间依赖性,为探究在同样注射剂量条件下,能否在减少注射次数、缩短实验周期前提下达到同样实验效果。本实验在同样注射60 μg RNAi干扰探针的情况下,将单次注射并分别在4 d和6 d收集样品作为实验组;以2次注射后,距离第一次注射8 d取样作为阳性对照。
RNA干扰效果的时间依赖性。何国平等[22]实验结果显示mRNA和蛋白质表达在12 h时开始略有降低、48 ~ 72 h降低最明显,而在96 h恢复到正常表达水平;曾永秋等[23]实验结果显示在转染后12 h即对mRNA的表达产生抑制,48 h抑制率最高,72 h后抑制率下降。上述研究表明,RNA干扰效果由时间延长呈现由弱到强、再由强到弱的逐渐消失趋势[22]。为探究马氏珠母贝注射探针后的时间依赖性,本次实验注射了60 μg双链RNA干扰探针1次,检测了4 d和6 d时的干扰效果。结果显示,所有实验组基因的相对表达量均出现显著下调,贝壳珍珠层均出现紊乱生长。但6 d时,表达量显著低于4 d且珍珠层新生层的紊乱生长程度也较4 d时明显。这说明60 μg双链RNA干扰探针的注射剂量已经达到明显的干扰效果,且6 d时RNA干扰作用仍在持续。本研究还采用本实验室前期使用方法进行了一组实验,以比较两种方法差异。结果表明,注射2次探针时(4 d/次),8 d时基因的相对表达量出现显著下调,贝壳珍珠层出现紊乱生长。虽然8 d时基因相对表达量低于注射一次探针4 d和6 d,但是从对贝壳珍珠层影响程度来看,8 d的较注射一次探针6 d的弱。吴伟东等[24]实验结果表明在0.01 ~ 0.08 μmol/L范围随着dsRNA-eGFP浓度增加,RNAi效应明显增强,而增加到0.16 μmol/L并不能进一步增强抑制效应,说明浓度过高会导致干扰效应被减弱,甚至被消除。8 d珍珠层紊乱效果弱于6 d的现象可能是由于两次注射后,体内探针浓度过高,导致干扰效应被削弱。此外,还有可能是因为基因被长时间沉默,替补基因被激活,以至于导致基因的相对表达量更低下调而没有造成对应程度的微观结构变化。本实验结果表明注射1次探针且干扰6 d后进行取样时,实验组贝壳内表面珍珠层晶体明显出现紊乱且文石板层间出现大量不规则细小晶体,说明注射探针1次、干扰6 d后取样为最优条件。
综合分析,本研究认为注射60 μg探针1次,注射后6 d可收集样本进行检测。该方法成本低,周期短,效率高,可作为马氏珠母贝RNA干扰条件的规范标准,为后期马氏珠母贝基因功能的研究提供参考。
[1] 宋亚锋,李世昌. RNA干扰技术的研究进展[J]. 山西师大体育学院学报, 2007,22(S1): 103-105.
[2] BERNSTEIN E, CAUDY A A, HAMMOND S M, et al. Role for a bid entate ribonuclease in the initiation step of RNA interference[J]. Nature, 2001, 409(6818): 363-366.
[3] 陈颖, 朱明华. RNA干扰[J]. 中国生物工程杂志, 2003,23(3): 39-43.
[4] 李良德, 刘婕, 姜春来, 等. 昆虫RNAi效率的影响因素研究进展[J]. 生物技术通报, 2012(11): 38-42.
[5] 张涛, 郅军锐, 叶茂. RNAi在昆虫基因功能研究中的应用进展[J]. 山地农业生物学报, 2018, 37(6):63-69;91.
[6] 赵慧, 秦鄂德. RNAi抗病毒感染的研究进展[J]. 微生物学免疫学进展, 2005,33(1): 58-63.
[7] 康洁,刘福林. RNAi的抗病毒作用及其机制[J]. 现代免疫学, 2004,24(5): 439-441.
[8] 白描, 杨国顺, 陈石, 等. 植物RNAi的特点及其应用研究进展[J]. 生物技术通报, 2009(8): 6-10.
[9] 刁文一, 蒋建雄, 熊兴华, 等. RNAi在植物功能基因组中的应用[J]. 现代生物医学进展, 2006,6(2): 81-83.
[10] 邱锡尔, 朱冬发, 周彦琦, 等. 甲壳动物RNAi技术研究与应用进展[J]. 生物技术通报, 2015(3): 57-63.
[11] SUZUKI M, SARUWATARI K, KOGURE T, et al. An acidic matrix protein,, is a key macromolecule for nacre formation[J]. Science, 2009, 325(5946): 1388-1390.
[12] WANG X T, SONG X R, WANG T, et al. Evolution and functional analysis of thegene of the Pacific oyster[J]. Current Zoology, 2013, 59(1): 109-115.
[13] DU Y P, CHANG H H, YANG S Y, et al. Study of binding interaction betweenprotein fragment and aragonite[J]. Scientific Reports, 2016, 6: 30883.
[14] 宋小瑞. 长牡蛎贝壳形成相关蛋白及其基因的研究[D]. 青岛:中国科学院研究生院(海洋研究所), 2013.
[15] 郑哲. 马氏珠母贝珍珠质形成microRNA的筛选和功能研究[D]. 湛江:广东海洋大学, 2013.
[16] 董冰冰, 黄荣莲, 王庆恒, 等. 海洋酸化对马氏珠母贝珍珠层形成的影响[J]. 海洋科学, 2015, 39(8): 39-46.
[17] 王祯瑞. 中国动物志无脊椎动物(第三十一卷), 软体动物门, 双壳纲, 珍珠贝亚目[M]. 北京: 科学出版社, 2002:68-98.
[18] 董冰冰. 马氏珠母贝珍珠层基质蛋白基因的克隆与功能研究[D]. 湛江: 广东海洋大学, 2015.
[19] BAHN S Y, JO B H, CHOI Y S, et al. Control of nacre biomineralization byin pearl oyster[J]. Science Advances, 2017, 3(8): e1700765.
[20] 甲干初. 栉孔扇贝基质蛋白cfMSP-1的基因克隆鉴定与功能探究[D]. 北京: 清华大学, 2015.
[21] 黄荣莲, 范闪闪, 杜晓东. 马氏珠母贝贝壳基质蛋白基因的克隆和功能研究[J]. 广东海洋大学学报, 2019, 39(1): 22-29.
[22] 何国平, 张思仲, 王英成, 等. 短发夹RNA介导RNA干扰的时间和剂量效应研究[J]. 生物化学与生物物理进展, 2005, 32(3): 258-267.
[23] 曾永秋, 税青林, 赵矫, 等. 特异性siRNA抑制hTERT基因表达的位置及时间效应[J]. 遗传, 2008, 30(7): 857-862.
[24] 吴伟东, 方驰华. RNA干扰技术抑制哺乳动物细胞绿色荧光蛋白表达的研究[J]. 现代医院, 2007, 7(2): 4-8.
Optimization of Double-stranded RNA Interference Experiments of
LI Chu-yi1,XIONG Xin-wei1,DU Xiao-dong1,2
(1./2.,524088,)
The conditions of the double-stranded RNA interference experiment ofwere optimized.The pearl oysters were injected by the probe with a different number of times and different interfering times. The expression level ofgene was detected using Real-time fluorescence quantification PCR. The inner surface of shell nacreous layer was observed and the growing situation of a new layer in the different group was analyzed.When 60 μg probes were injected once, the relative expression level ofgene in the experimental group was significantly lower than that in the control group, and relative expression ofgene in the experiment group at the 6th day was significantly lower than that at the 4th day. When 60 μg probes were injected twice, the relative expression level ofgene in the experimental group was significantly lower than that in the control group on 8th day. The result of scanning electron microscopy indicated that all the new growth nacreous layers in the experimental group exhibited the disordered growth; compare with the 4th and 8th days, the ordered boundary on the new nacre was destroyed completely and more small crystal was arranged irregularly.The best stable and efficient conditions of the double-stranded RNA interference ofwere: inject 60 μg double-stranded RNA probes once and collect the sample at 6 days postinjection. These optimized conditions would contribute to the exploration of gene function in.
; double-stranded RNA interference; optimization
S917.4
A
1673-9159(2020)06-0009-07
10.3969/j.issn.1673-9159.2020.06.002
黎楚怡,熊新威,杜晓东. 马氏珠母贝双链RNA干扰实验条件优化[J]. 广东海洋大学学报,2020,40(6):9-15.
2020-06-20
广东省自然科学基金项目(2018A030310666, 2019A1515111026,2020A1515010691);广东省教育厅项目(2017KCXTD016)
黎楚怡(1997-),女,硕士研究生,研究方向为水产养殖学。Email:1322990177@qq.com
杜晓东,男,教授。E-mail:gdhddxd@hotmail.com
(责任编辑:刘岭)

