蛋白核小球藻富硒培养
黎钊坪,李雁群,3,李燕文,岳 瑶,郭桂筱,胡雪琼
蛋白核小球藻富硒培养
黎钊坪1,2,李雁群1,2,3,李燕文1,岳 瑶1,2,郭桂筱1,2,胡雪琼1,2
(1. 广东海洋大学食品科技学院// 2. 广东海洋大学食品科技学院海洋药物研究所//3.广东省水产品加工与安全重点实验室,广东 湛江 524088)
【】对蛋白核小球藻进行富硒混和培养研究,为富硒小球藻保健品食品的开发提供基础。采用碳氮比营养优化及pH培养条件优化的方式提高生物量及胞内蛋白含量,并在此基础上进行硒富集培养,以荧光分光光度法检测细胞硒含量。当碳氮比(质量比)20∶1时,生物量达到16.8 g/L,细胞蛋白质质量分数为31.46%;当碳氮比15∶1时,生物量为16.1 g/L,蛋白质含量为43.69%;当碳氮比10∶1时,生物量为14.7 g/L,蛋白含量为45.21%。按单位培养液蛋白质产量计,以碳氮比15∶1最佳。培养基起始pH值为5.5时,藻细胞生物量可以达到18.9 g/L,起始pH = 5.5 ~ 6.5范围内,适合小球藻生长。在富硒试验中,当培养基亚硒酸钠质量浓度达10 mg/L及以下,对小球藻细胞生长无明显影响,高于20 mg/L抑制生长,高于80 mg/L会严重抑制生长;亚硒酸钠质量浓度为10 mg/L时,藻细胞内的硒含量达到54.9 μg/g,总富集硒量为927.9 μg/L培养液,硒的吸收效率为20.3%。蛋白核小球藻能在混养培养下得到较高的生物量且具有较高的富硒能力。
微藻;蛋白核小球藻;富硒;混养
我国人均硒摄入量仅为26.33 μg/d,远低于WTO推荐日摄入量50~200 μg/d。硒缺乏会导致罹患克山病、心脑血管病、高血压等一系列疾病的风险上升[1-2]。因此,在日常膳食中,需要额外补充硒元素来保证每日最低摄入量。硒是超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及谷胱甘肽过氧化氢酶(GSH-Px)等多种酶的活性中心及辅助因子[3],能有效清除自由基、提高免疫力及预防疾病[4]。但硒在自然界中主要以无机形态存在,毒性较强且消化吸收程度低,需要通过生物作为载体,将无机硒转化为有机硒[5]。目前发现微藻能够吸收环境中的无机硒,通过富集和转化作用,变成有机硒[6-7]。因高溶解度,通常以亚硒酸钠为硒源。相比于陆生植物,水生生物对硒的吸收转化效率更高。
蛋白核小球藻()富含蛋白质、多不饱和脂肪酸、类胡萝卜素、生长因子等营养成分[8]。研究表明,小球藻作为营养补充剂,能有效提高人体维生素C摄入量[9],减少DNA损伤,具有良好的保健功能。小球藻作为硒转化的载体,有其独特的优势。Dai等[10]研究发现,富硒小球藻中的硒氨基酸的生物利用度达到49%,是硒酵母的两倍以上。其次,硒主要与蛋白质结合,蛋白核小球藻蛋白质含量丰富,达45%以上[11],是硒蛋白的优质来源[12]。
目前关于光自养条件下的小球藻富硒培养,在藻细胞耐受性[13]、相关酶活力、基因表达[14]等方面均有文献报导,光自养法培养存在生长周期长、易受污染、细胞密度低、离心成本高等缺点。在小球藻生产虾青素的研究方面,采用异养与自养相结合的混养方式能够在快速积累生物量的同时,增加虾青素的含量[15]。有文献报道,光照促进光合色素的合成,从而有利于增加藻细胞的硒耐受性[16]。通过混养进行富硒培养,可能实现在短时间内达到较高的藻密度并在高细胞密度条件下增加富硒的量,但是,目前关于用混养的方式培养富硒蛋白核小球藻的研究鲜有报导。本研究拟通过混养条件优化提高藻细胞密度及蛋白质含量,在实现高密度培养的情况下进行富硒培养,以期为高附加值藻品的开发奠定基础。
1 材料与方法
1.1 材料与仪器
蛋白核小球藻(FACHB-5)购自中国科学院水生生物研究所淡水藻藻种库。采用Basal培养基培养,组成为:KH2PO41 250 mg/L、MgSO4•7H2O 1 000 mg/L、EDTA 500 mg/L、H3BO3114.2 mg/L、CaCl2•2H2O 111 mg/L、FeSO4•7H2O 49.8 mg/L、ZnSO4•7H2O 88.2 mg/L、MnCl2•4H2O 14.2 mg/L、MoO27.1 mg/L、CuSO4•5H2O 15.7 mg/L、Co(NO3)2•6H2O 4.9 mg/L。葡萄糖、硝酸钠、硒标准品,分析纯,购自湛江安培试剂公司。亚硒酸钠,分析纯,购自国药试剂集团。硝酸、高氯酸、硫酸,分析纯,购自湛江科诚试剂有限公司。2,3-二氨基萘(DAN)试剂,购自麦克林有限公司。
HZQ-F280 恒温摇床培养箱,江苏省金坛市万花实验仪器厂;ME204E 电子分析天平(0.000 1 g),北京赛多利斯天平有限公司;X-30R 高速冷冻离心机,贝克曼库尔特商贸(中国)有限公司;XW-80A 漩涡振荡器,海门市其林贝尔仪器制造有限公司;VAPODEST 450 全自动凯氏定氮仪,格哈特(中国)有限公司;FDU-1110 冷冻干燥机,上海旦鼎国际贸易有限公司;F-7000FL 荧光分光光度计,High-Tech Science Corporation。
1.2 实验方法
1.2.1 蛋白核小球藻混养培养优化 碳氮比优化:在250 mL锥形瓶中加入100 mL Basal培养基,葡萄糖质量浓度为50 g/L,pH值为6.5。根据碳源和氮源的比例添加硝酸钠,使最终碳氮比(质量比)为10∶1、15∶1、20∶1、40∶1、60∶1,培养基在121 ℃灭菌15 min,冷却后在超净工作台中接种5 mL处于生长对数期的藻液,于温度(28.0 ± 0.5)℃、照度4 000 lx、150 r/min的恒温摇床中培养8 d。
pH值优化:在葡萄糖质量浓度为50 g/L、优化的碳氮比条件下培养,调节培养基初始pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5。
1.2.2 蛋白核小球藻混养富硒培养 在50 g/L葡萄糖浓度、优化碳氮比、优化pH的Basal培养基中加入质量浓度依次为0、2、5、8、10、20、40、60、80、100 mg/L的亚硒酸钠。
1.2.3 生物量测量及比生长速率计算 使用干重法测量生物量:每24 h取1 mL藻液,5 000 r/min离心5 min,蒸馏水洗涤2次,在鼓风干燥箱中50 ℃干燥,用分析天平称干重,小球藻生长d后的平均比生长速率μ按照公式(1)计算:
μ=[ln (W-0)] /× 100%, (1)
式中,μ是d的比生长速率,W是小球藻第天的生物量,0是初始生物量(接种生物量)。
1.2.4 藻蛋白含量测定 取培养8 d的藻样品5 000 r/min离心10 min,蒸馏水洗涤2次,冷冻干燥,干燥后,用全自动凯氏定氮仪测量,根据氮含量计算蛋白含量。
1.2.5 藻细胞硒含量测定 测定方法参考GB 5009.93—2017的荧光分光光度法测量:藻细胞富硒培养8 d后,5 000 r/min离心、蒸馏水洗涤2次、冷冻干燥。干燥后,称取0.5 g藻粉加入10 mL混合酸(硝酸和高氯酸体积比9∶1)和玻璃珠冷泡12 h,220 ℃消化,过程中及时补加硝酸,消化至溶液透明清亮且有白烟产生后,加热到体积剩余约2 mL,冷却,再加入5 mL盐酸溶液(6 mol/L),再次220 ℃消化至清亮透明且有白烟产生,在加热至剩余2 mL,冷却,加盐酸溶液(1.2 mol/L)定容至50 mL,取10 mL样液加入40 mL EDTA混合溶液,调pH至1.5~2.0,于暗处加入6 mL DAN试剂,沸水浴5 min,冷却后加入6 mL环己烷,摇4 min,用分液漏斗取环己烷层,荧光分光光度计测荧光光度值,用硒标准品作标准曲线,根据标准曲线计算硒含量。
1.2.6 单位培养液细胞富集硒总量 单位培养液细胞富集硒总量是指在小球藻培养液中富集到细胞内的硒的量,是指被细胞吸收进入胞内的硒的量,包括转化为有机硒的部分和暂时未转化的在胞内的硒。以式(2)计算:
=×, (2)
式中:为单位培养液细胞富集硒总量,μg/L;表示每克藻细胞的硒元素含量,μg/g;表示培养液藻细胞生物量,g/L。
1.2.7 小球藻对硒的吸收率计算 硒吸收率指小球藻对培养基中硒进行富集进入细胞,富集硒占培养基中所添加硒量的百分比,以式(3)计算:
= (×1)/(2×) × 100%, (3)
式中:表示硒吸收率,%;表示单位培养液藻细胞富集硒总量,μg/L;1表示亚硒酸钠的摩尔质量,173 g/mol;2表示为硒的摩尔质量,79 g/mol;表示培养基中添加的亚硒酸钠的质量浓度,μg/L。
1.3 数据处理
本研究实验数据为3组平行实验的平均值,数据采用SPSS 22.0进行显著性分析。用OriginPro 2018进行制图,<0.05表示差异显著。
2 结果与讨论
2.1 碳氮比对蛋白核小球藻生长及蛋白质的影响
充足的氮源能够保证藻细胞的正常代谢,提高蛋白质含量。硒在藻细胞内主要与氨基酸结合,形成硒蛋白,而与多糖及脂肪酸的结合较少。要得到高产量的富硒产品,主要是要提高藻细胞的生物量和蛋白质含量。
蛋白核小球藻在不同碳氮比条件下生长曲线如图1所示。培养1~3 d,不同碳氮比条件下蛋白核小球藻生物量相差很小,第3天后,碳氮比为60∶1组的细胞生长量比其他组明显更低,而碳氮比为40∶1组中第5天后小球藻的生长才开始放缓。可见,氮源不足会导致细胞生长缓慢,即使此时培养基仍然有充足的碳源也无法维持细胞数量增长。碳氮比为20∶1时,培养8 d藻细胞生物量达到16.8 g/L,为碳氮比营养条件试验的各培养基中的最高值。
图2为小球藻比生长速率随碳氮比的变化。由图2可知,与碳氮比为60∶1组相比,在碳氮比为10∶1、15∶1、20∶1和40∶1时,平均比生长速率出现显著性差异(<0.05),说明氮源的充足有利于蛋白核小球藻的生长,这符合细胞生长营养要求的一般规律,也与文献报道的研究结果一致[17]。
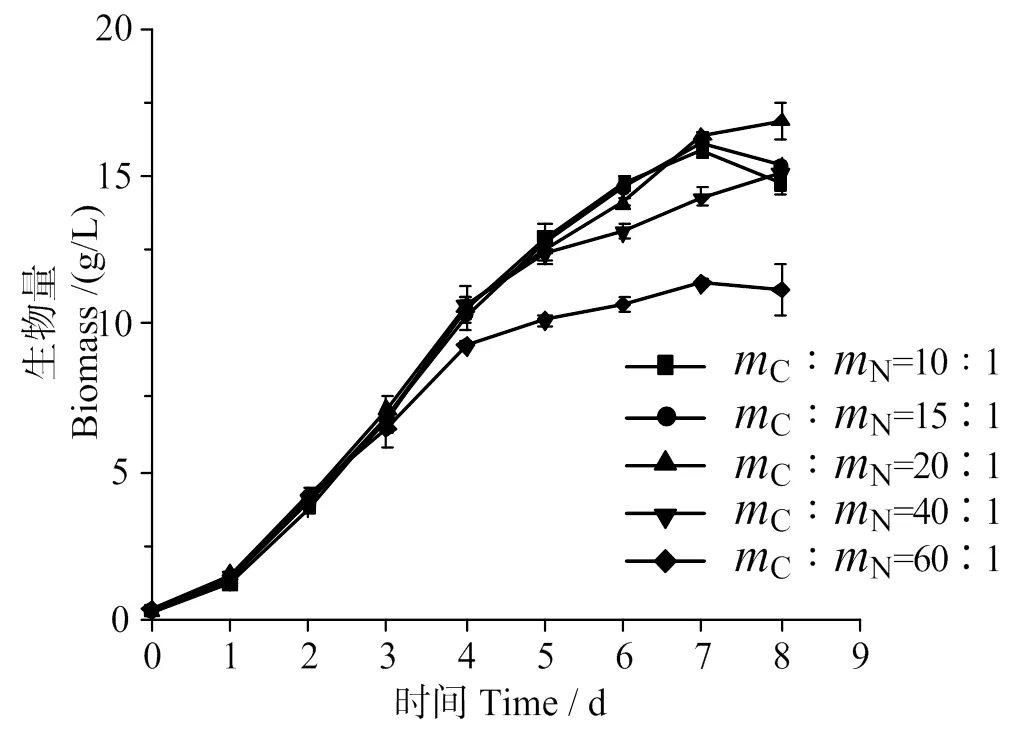
图1 碳氮比对蛋白核小球藻生长的影响

凡含相同字母表示差异不具统计学意义(P>0.05)
碳氮比对小球藻蛋白质含量的影响如图3所示。从图3可知,氮源的添加能大幅度的提高蛋白核小球藻细胞内蛋白质的含量。在碳氮比为10∶1的条件下,蛋白质的含量最高,达到45.21%,与文献报导的小球藻蛋白质含量40% ~ 47%[18-19]的结果相似。在综合蛋白核小球藻的生物量及胞内蛋白质含量后,选择碳氮比条件为15∶1,最高生物量能达到16.3 g/L,第8天生物量为15.3 g/L,细胞蛋白质含量为43.69%,培养液蛋白质产量达到6.70 g/L。
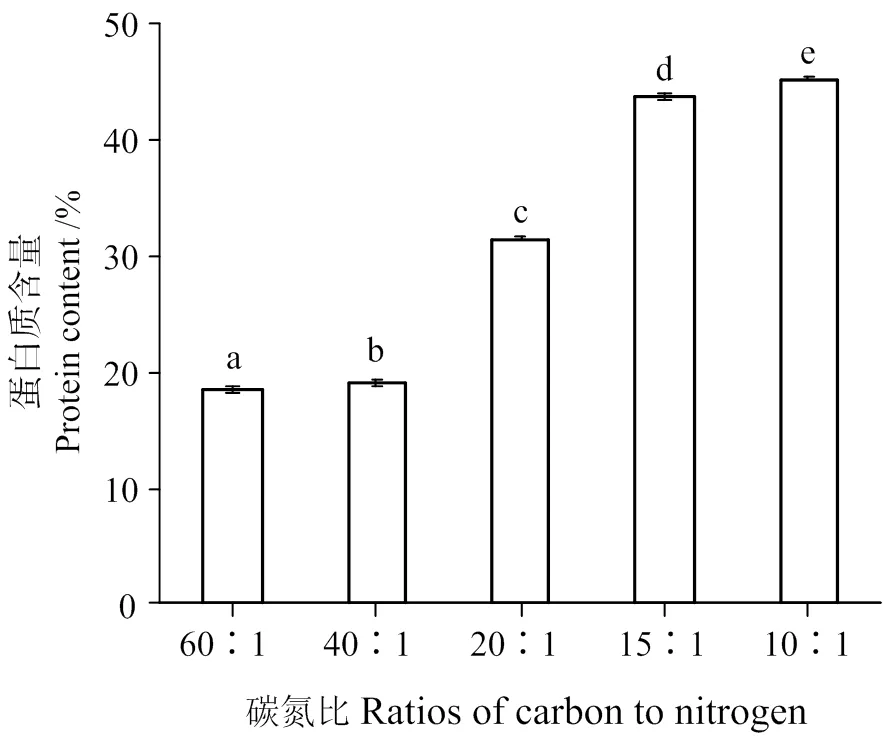
凡含相同字母表示差异不具统计学意义(P>0.05)
2.2 pH值对蛋白核小球藻生物量和比生长速率的影响
微藻的pH耐受性差异性很大,不同藻种有不同的pH范围。在自养培养时,CO2是唯一C源,酸性环境可提高CO2在水中以碳酸形式存在的比例,有利于细胞吸收,而过高的pH值则会降低CO2的可用性,超过细胞的适应范围还会抑制藻细胞的生长[20-21]。在本研究中添加葡萄糖后,可以葡萄糖为C源,初始pH不再是碳源供应的控制性因素,此时pH对蛋白核小球藻生长的影响体现在其他生理作用上。为了明确在混养条件下培养基pH对小球藻生长的影响,观察了不同起始pH条件的培养结果,结果如图4、5。图4为不同起始pH的藻生物量生长曲线,图5为不同pH条件下藻生物量的平均比生长速率。

图4 pH对蛋白核小球藻生长的影响
凡含相同字母表示差异不具统计学意义(P>0.05)
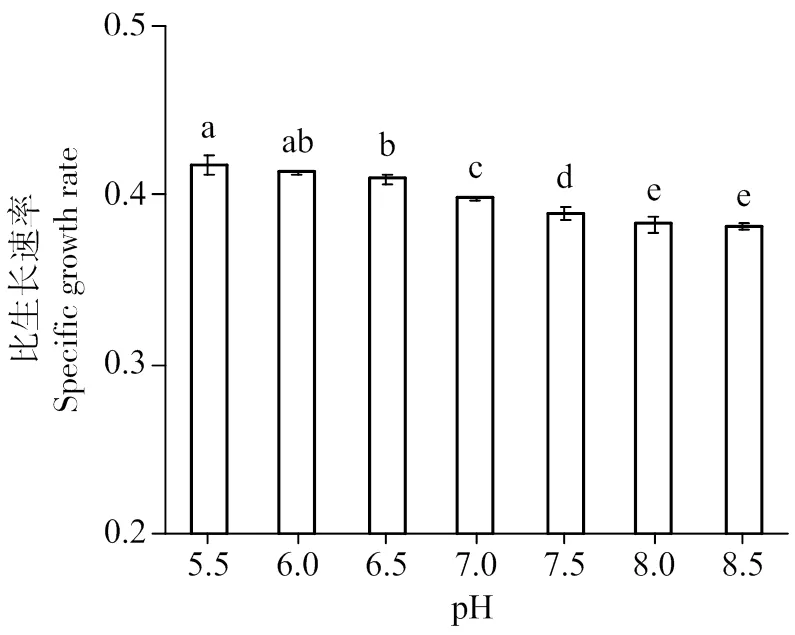
图4、5可知,初始pH 5.5最有利于藻细胞的生长,最高藻细胞浓度达到18.9 g/L,藻细胞的生长速率最高,比生长速率达0.42。当pH值大于6.5时,藻细胞的生长受到显著抑制(<0.05)。
培养基起始pH不仅影响微藻开始阶段的生长,还影响整个生长过程,在光自养培养条件下,如果仅以硝酸钠作为N源,当硝酸钠中的NO32-消耗后,剩余的Na+使培养基的pH升高。一般小球藻不适合在碱性条件生长[22],因此,在光自养条件下初始pH偏碱性一般不利于小球藻的生长。本研究起始pH在8.5的条件下,虽然生长量和生长速率不如在偏酸性条件好,但是也能支撑较高的生长量,生物量达到14.6 g/L,比生长速率为0.38,这可能是因为在混养条件下,由于葡萄糖作为碳源,细胞代谢产酸,中和了硝酸钠消耗产的碱。根据试验结果,本研究选择起始pH 5.5进行后续的富硒混养培养。
2.3 蛋白核小球藻硒耐受性
亚硒酸钠浓度从0到100 mg/L的不同培养基中蛋白核小球藻的生物量生长如图6所示,图7为在相同条件下相应的藻生物量比生长速率。
从图6、7可知,与不加硒的培养基对比,低浓度的亚硒酸钠(≤10 mg/L)对蛋白核小球藻的生长无显著影响(>0.05)。培养基中亚硒酸钠质量浓度为20 ~ 60 mg/L时,会抑制小球藻的生长,且浓度越高,对小球藻的抑制作用越明显。当亚硒酸钠的浓度超过80 mg/L时,完全限制藻细胞的生长,藻液在第5天出现红硒现象,小球藻细胞死亡。Zhao等[13]研究表明,在培养基中硒酸钠浓度<10 mg/L时,与不添加硒酸钠对照相比,蛋白核小球藻的生长无显著性差异,在亚硒酸钠浓度20 ~ 40 mg/L中培养,蛋白核小球藻的生长受到抑制,当亚硒酸钠浓度>60 mg/L时,藻细胞死亡。与Zhao等[13]研究结果相比,本研究显示出更高的耐受性。这可能是由于在本研究的混养模式下细胞生物量较高,培养液中的硒被吸收进入细胞的速度较快,培养液中的硒浓度较快降低到安全水平,减轻了亚硒酸钠对藻细胞生长的影响。在藻细胞内,硒主要与氨基酸结合。硒氨基酸主要有硒代甲硫氨酸(SeMet)及硒代半胱氨酸(SeCys),SeMet和SeCys是一些硒蛋白的合成前体物质,低浓度时,硒能够增加GSH-PX、SOD、CAT的活性[23],使光合色素含量增加[14],从而使藻细胞的抗氧化能力增强。但是过量的SeCys及SeMet会导致蛋白质的合成错误,使活性氧簇(ROS)的含量增加,对藻类产生毒性,因此硒对小球藻的生长具有双重作用,低浓度的硒能够促进小球藻的生长,而高浓度的硒则会抑制藻细胞的生长甚至导致死亡。
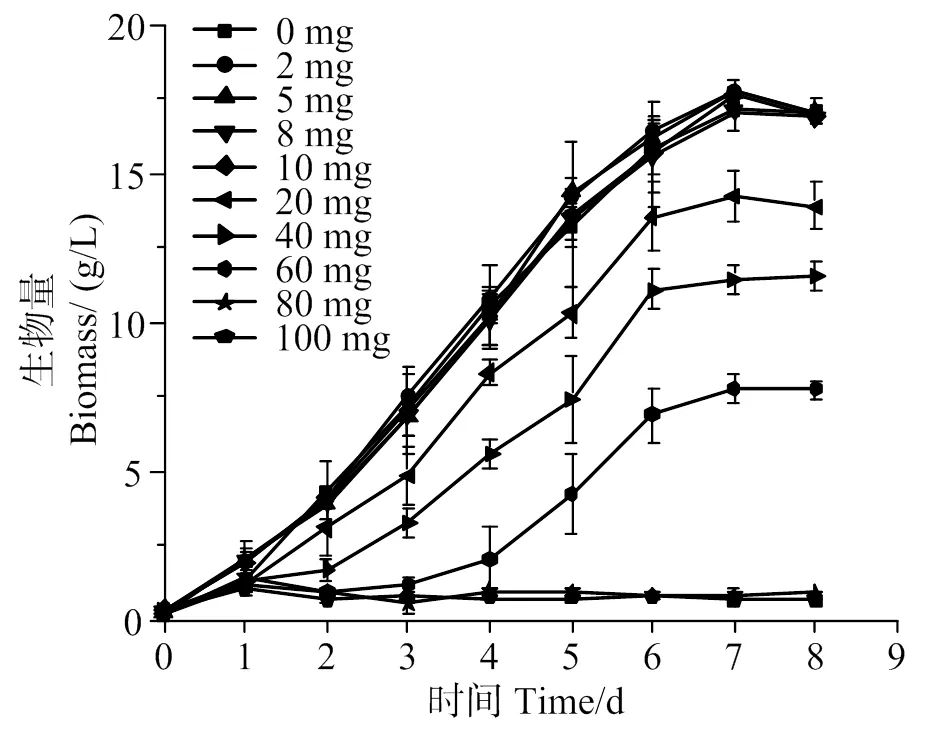
图6 蛋白核小球藻在不同含硒培养基中的生长曲线
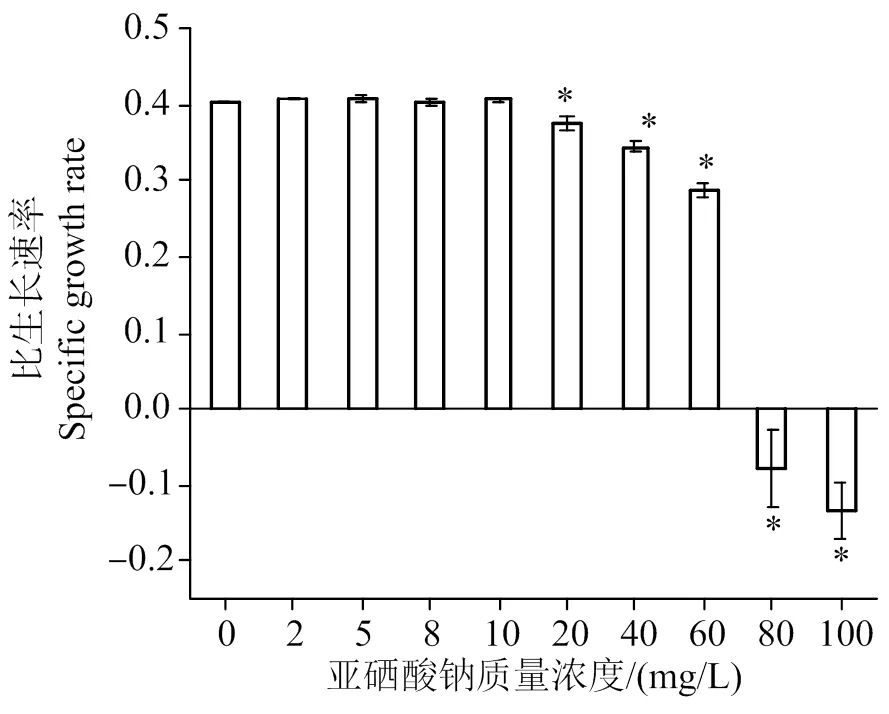
与空白组相比较,*表示差异具有统计学意义,P<0.05。
2.4 培养基亚硒酸钠浓度对小球藻细胞硒含量的影响
在不同含硒浓度的培养基中培养的小球藻细胞硒含量结果如图8所示。在亚硒酸钠质量浓度低于5 mg/L时,藻细胞富硒效果不明显。提高亚硒酸钠的浓度,细胞的硒含量逐渐增加。亚硒酸钠浓度质量为10 mg/L时藻细胞的硒含量达到54.9 μg/g,亚硒酸钠质量浓度为60 mg/L时藻细胞的硒含量达到299.3 μg/g,硒富集效果显著。此结果虽然比Zhong等[23]人在自养条件下获得的435 μg/g细胞硒含量低,但一般实验室光自养培养的细胞生物量浓度低于2 g/L(干物质)[24-25],大规模的开放池培养生物量浓度更低,一般不到1 g/L,而本研究在亚硒酸钠质量浓度10~40 mg/L的培养基中生物量在11.6~16.9 g/L之间。以此推算,单位培养液的胞内硒产量不超过870 μg/L。本研究采用混养培养策略,以亚硒酸钠质量浓度为10 mg/L的培养条件计,生物量浓度为16.9 g/L,胞内硒产量达到927.9 μg/L,因此本研究获得了较高的硒富集量。

图8 培养基亚硒酸钠浓度对蛋白核小球细胞硒含量影响
图9为不同浓度亚硒酸钠培养下单位体积培养液藻细胞富集的总硒含量变化。在亚硒酸钠质量浓度为8 ~ 40 mg/L时,随着浓度的增加,单位培养液细胞富集硒总量增加,在亚硒酸浓度为40 mg/L时,单位培养液中细胞富集硒总量达到最高,达2 466.2 μg/L。超过此浓度后,单位体积细胞总硒含量下降,这是由于藻细胞生物量浓度降低,虽然细胞硒含量高,但单位体积细胞总硒含量下降。

图9 在不同的培养基硒酸钠浓度条件下培养液细胞富集硒总量
图10为在不同亚硒酸钠浓度的条件下亚硒酸钠的吸收率变化。在亚硒酸钠浓度为10 mg/L时,硒吸收效率最高,达到20.3%。这是添加的硒被富集的效率,与单个细胞达到的硒含量有关也与培养液细胞生物量生长水平有关。从目前的文献报道看,就蛋白核小球藻来说,由于光自养培养生物量低,藻的硒吸收率不足5%[13, 22-26],培养后产生大量的含硒废水。混养培养相对比光自养培养,生物量浓度更高,从而总的细胞硒吸收率更高。硒吸收率提高可以减少生产中亚硝酸盐的浪费以及减轻含硒废水处理负担。当然,即使混养培养,大部分硒还留在培养基中没有被藻细胞吸收,因此在如何进一步提高吸收率和培养基的循环利用[27]等方面需要进一步开展研究。另外,与光自养相比,混养培养中需要加入有机碳源,本实验采用葡萄糖作为碳源,成本较高,需要进一步研究如糖蜜[28]作为碳源的富硒培养,以降低生产成本。

图10 蛋白核小球藻硒吸收率
3 结论
蛋白核小球藻在混养时,需要添加适量的碳氮源及调整初始pH,碳氮比在10∶1~15∶1、pH值在5.5 ~ 6.0的范围内小球藻的生物量及蛋白质含量较高,碳氮比为15∶1的营养条件可以获得更好的经济性。培养基中硒质量浓度≤10 mg/L时不影响蛋白核小球藻的生长,超过则会对小球藻生长产生逐渐增加的抑制作用,生产中亚硒酸钠添加浓度可以定为10 mg/L。添加硒酸钠的浓度达到10 mg/L时,培养液藻对硒吸收率达到最高20.3%,可以获得927.9 μg/L的细胞内硒。
[1] 聂婷婷, 李晖. 硒与心血管疾病相关性的研究进展[J]. 中国食物与营养, 2019, 25(9): 9-13.
[2] HATFIELD D L, TSUJI P A, CARLSON B A, et al. Selenium and selenocysteine: roles in cancer, health, and development[J]. Trends in Biochemical Sciences, 2014, 39(3): 112-120.
[3] KUL’CHITSKII N A, NAUMOV A V. Modern state of markets of selenium and selenium-based compounds[J]. Russian Journal of Non-Ferrous Metals, 2015, 56(4): 409-416.
[4] ADADI P, BARAKOVA N V, MURAVYOV K Y, et al. Designing selenium functional foods and beverages: a review[J]. Food Research International(Ottawa, Ont.), 2019, 120: 708-725.
[5] GUPTA M, GUPTA S. An overview of selenium uptake, metabolism, and toxicity in plants[J]. Frontiers in Plant Science, 2016, 7: 2074.
[6] GOJKOVIC Ž, GARBAYO I, ARIZA J, et al. Selenium bioaccumulation and toxicity in cultures of green microalgae[J]. Algal Research-Biomass Biofuels and Bioproducts, 2015, 7: 106-116.
[7] KIELISZEK M, BŁAŻEJAK S, GIENTKA I, et al. Accumulation and metabolism of selenium by yeast cells[J]. Applied Microbiology and Biotechnology, 2015, 99(13): 5373-5382.
[8] LIU J, CHEN F. Biology and industrial applications of: advances and prospects[J]. Advances in Biochemical Engineering/ Biotechnology, 2016, 153: 1-35.
[9] LEE S H, KANG H J, LEE H J, et al. Six-week supplementation withhas favorable impact on antioxidant status in Korean male smokers[J]. Nutrition, 2010, 26(2): 175-183.
[10] VU D L, SAURAV K, MYLENKO M, et al. In vitro bioaccessibility of selenoamino acids from selenium (Se)-enriched Chlorella vulgaris biomass in comparison to selenized yeast; a Se-enriched food supplement; and Se-rich foods[J]. Food Chemistry, 2019, 279: 12-19.
[11] 桂林, 史贤明, 李琳, 等. 蛋白核小球藻不同培养方式的比较[J]. 河南工业大学学报(自然科学版), 2005, 26(5): 52-55.
[12] 倪婕, 余炼, 唐亚倩, 等. 亚硒酸钠对蛋白核小球藻生长及生物转化的影响[J]. 现代食品科技, 2019, 35(11): 176-181.
[13] ZHAO Y F, SONG X S, CAO X, et al. Toxic effect and bioaccumulation of selenium in green alga[J]. Journal of Applied Phycology, 2019, 31(3): 1733-1742.
[14] OZAKMAN G, YAYMAN S G, SEZER ZHMUROV C, et al. The influence of selenium on expression levels of the rbcL gene in[J]. 3 Biotech, 2018, 8(4): 1-7.
[15] SUN Z, ZHANG Y, SUN L P, et al. Light elicits astaxanthin biosynthesis and accumulation in the fermented ultrahigh-density[J]. Journal of Agricultural and Food Chemistry, 2019, 67(19): 5579-5586.
[16] BABAEI A, RANGLOVÁ K, MALAPASCUA J R, et al. The synergistic effect of Selenium (selenite, -SeO32-) dose and irradiance intensity incultures[J]. AMB Express, 2017, 7:56.
[17] 魏东, 张会贞, 陈娇敏. 优化营养方式强化蛋白核小球藻生物量及蛋白质和叶绿素生产[J]. 现代食品科技, 2017, 33(4): 160-167.
[18] MAAITAH M, HODAIFA G, MALVIS A, et al. Kinetic growth and biochemical composition variability ofin olive oil washing wastewater cultures enriched with urban wastewater[J]. Journal of Water Process Engineering, 2020, 35: 101197.
[19] 骆小英, 陈俊辉, 魏东. 蛋白核小球藻高效同化硝态氮联产微藻蛋白[J]. 生物工程学报, 2020, 36(6): 1150-1161.
[20] QIU R H, GAO S, LOPEZ P A, et al. Effects of pH on cell growth, lipid production and CO2addition of microalgae[J]. Algal Research-Biomass Biofuels and Bioproducts, 2017, 28: 192-199.
[21] SONG C F, HAN X X, QIU Y T, et al. Microalgae carbon fixation integrated with organic matters recycling from soybean wastewater: Effect of pH on the performance of hybrid system[J]. Chemosphere, 2020, 248: 126094.
[22] ZHENG Y B, LI T T, YU X C, et al. High-density fed-batch culture of a thermotolerant microalgafor biofuel production[J]. Applied Energy, 2013, 108: 281-287.
[23] ZHONG Y, CHENG J J. Effects of selenite on unicellular green microalga: bioaccumulation of selenium, enhancement of photosynthetic pigments, and amino acid production[J]. Journal of Agricultural and Food Chemistry, 2017, 65(50): 10875-10883.
[24] FAN J H, CUI Y B, ZHOU Y, et al. The effect of nutrition pattern alteration ongrowth, lipid biosynthesis-related gene transcription[J]. Bioresource Technology, 2014, 164: 214-220.
[25] WANG S K, WU Y, WANG X. Heterotrophic cultivation ofusing sucrose as the sole carbon source by co-culture with[J]. Bioresource Technology, 2016, 220: 615-620.
[26] SUN X, ZHONG Y, HUANG Z, et al. Selenium accumulation in unicellular green algaand its effects on antioxidant enzymes and content of photosynthetic pigments[J]. PLoS One, 2014, 9(11): e112270. DOI:10.1371/journal.pone.0112270.
[27] 符虹宇, 李雁群, 蔡奇珍, 等.蛋白核小球藻培养液的循环利用[J]. 广东海洋大学学报, 2019, 39(4): 49-55.
[28] GAURAV K, SRIVASTAVA R, SHARMA J G, et al. Molasses-based growth and lipid production by: a potential feedstock for biodiesel[J]. International Journal of Green Energy, 2016, 13(3): 320-327.
Cultivation offor Selenium Enrichment
LI Zhao-ping1,2, LI Yan-qun1,2,3, LI Yan-wen1, YUE Yao1,2, GUO Gui-xiao1,2, HU Xue-qiong1,2
(1.,//2.//3.,524088,)
To perform background study for the development of selenium-enriched food ofthrough mixotrophic cultivation ofexposed in the selenium-enriched media.Optimization ofC∶Nand pH were used to increase the biomass production and cell protein content, and the selenium in the media was enriched by the addition of sodium selenite. The selenium content ofwas determined by fluorescence spectrophotometry.Biomass of 16.8 g/L and 31.46% of cell protein content was obtained whenC∶N= 20∶1, 16.1 g/L of biomass and 43.69% of cell protein content were obtained whenC∶N= 15∶1, and 14.7 g/L of biomass and 45.21% of cell protein content were obtained whenC∶N=15∶1. Based on the protein productivity in cultivation broth,C∶N=15∶1 was considered the optimal nutrient condition. The yield could reach 18.9 g/L at 5.5 of the initial pH of medium, and the growthofwas normal pH 5.5 - 6.5. In selenium-enriching experiments, 10 mg/L and lower concentrations of selenite in the media exhibited no significant effect on the growth of thecells. However, 20 mg/L and higher concentrations of sodium selenite inhibited the cell growth, and the sodium selenite >80 mg/L caused a lethal effect on the algal growth. At the 10 mg/L in media, the selenium content in algal biomass reached to 54.9 μg/g and the total absorbed selenium in the biomass was 927.9 μg/L, and the absorption rate of selenium reached at 20.3%.High selenium-enriching capacity ofcan be obtained under the mixotrophic cultivation.
Microalgae;; selenium enrichment; mixotrophic cultivation
S968.4
A
1673-9159(2020)06-0035-08
10.3969/j.issn.1673-9159.2020.06.008
黎钊坪,李雁群,李燕文,等. 蛋白核小球藻富硒培养[J]. 广东海洋大学学报,2020,40(6):35-42.
2020-07-09
广东省国际合作项目(2017A050501038)
黎钊坪(1996-),男,硕士研究生,研究方向为微藻生物活性物质研究与开发。E-mail:954952267@qq.com
李雁群(1963-),男,博士,教授,研究方向为发酵过程。E-mail:liyq2004@126.com
(责任编辑:刘朏)

