携带AFP的rAAV感染树突状细胞对肝癌细胞杀伤作用的实验研究
王 斌,付 尧 ,齐 红 ,于 鸿 ,魏天雪,刘玉侠*
(1.吉林省肿瘤医院,吉林 长春130012;2.吉林省肿瘤防治研究所)
原发性肝癌是世界范围内常见的恶性肿瘤之一,具有发病率高,病死率高的特点。我国发病率约约占恶性肿瘤的第5位,死亡率居第3位[1]。肝癌的治疗首选手术,但由于临床所见肝癌多已进入中晚期,而且肝癌病人约80%伴有肝硬化,能够实施根治性切除术的肝癌只是少数[2]。近年来,随着分子生物学和免疫学技术的不断发展进步以及对肿瘤发病机制的不断认识,利用免疫及基因工程手段对肿瘤进行治疗已在肝癌的治疗中取得一定效果[3]。本实验选用重组人相关病毒-rAAV作为载体,将肝癌相关抗原AFP转染其中,并用其感染树突状细胞(DC),探讨携带AFP的rAAV对DC抗肝癌作用的影响。
1 材料与方法
1.1 实验仪器PCR仪:ABI VeritiTM;离心机:Eppendorf 5424R;恒温振荡器:上海知楚;低温高速离心机:SORVALL公司;超速离心机:Beckman 公司;HERA CEEL 240iCO2培养箱:Thermo Scientific公司;全自动酶标仪:芬兰雷勃公司;流式细胞仪:BD公司;荧光显微镜:Olympus。
1.2 试剂DNA 引物primer:武汉金开瑞公司合成;Restriction enzyme:NEB;Universal DNA purification Kit:北京天能生物;DMEM:Hyclone 公司;胎牛血清,IMDM培养基:Gibco公司;淋巴细胞分离液:天津灏洋生物制品科技责任有限公司;GM-CSF,TNF-α,IL-4: Peprotech公司;IL-2:北京四环生物制药有限公司;MTT:Sigma公司。
1.3 人肝癌细胞株SMMC-7721;293细胞吉林省肿瘤防治研究所保存。
1.4 方法
1.4.1合成AFP基因引物并扩增 根据NCBI找到AFP基本信息(ID 174),合成NM-001354717.1CDS序列,并进行扩增。
1.4.2构建AFP基因过表达AAV2载体 将合成的AFP基因和pAAV-IRES-hrGFP腺相关病毒载体进行酶切,获取的目的基因与载体进行连接并转化到感受态细胞进行扩增,对阳性质粒测序验证。
1.4.3包装腺相关病毒 将质粒 pAAV-IRES-hrGFP、pAAV-RC2和Helper混匀,将脂质体Lip2000和目的基因混合,之后将质粒和脂质体混合物添加到293细胞中,进行腺相关病毒的浓缩和纯化。
1.4.4浓缩及纯化腺相关病毒 通过反复冻融法提取rAAV,用氯仿等浓缩和纯化rAAV溶液。并将纯化的AAV病毒液分装,储存于-80℃备用。
1.4.5Q-PCR检测病毒滴度 取病毒样品经核酸酶和蛋白酶K处理后,进行Q-PCR检测:取7个pAAV-IRES-hrGFP载体标准品浓度梯度(10-1…10-7),3个重复;3个病毒样品浓度梯度(10-1,10-2, 10-3),两个重复;3个阴性对照。结果根据标准品质粒浓度和分子量大小,计算标准品的Copies和病毒粒子拷贝数。
1.4.6制备树突状细胞并进行鉴定 见参考文献[4]。
1.4.7转染AFP的rAAV(rAAV-AFP)感染DC 向培养并鉴定的DC中加入转染AFP的rAAV,培养1天后进行杀伤实验。
1.4.8感染rAAV-AFP及未感染rAAV-AFP的DC对肝癌细胞SMMC-7721的杀伤实验 培养肝癌细胞株SMMC-7721至对数生长期,计数为5×104个/ml,加入到96孔细胞培养板,100 μl/孔,待贴壁后,按以下设计分组进行体外杀伤实验。效应细胞(DC、DC+rAAV-AFP)与靶细胞(SMMC-7721)的比例为50:1,每组设6复孔。
第一组:DC;第二组:DC+SMMC-7721;第三组:DC+rAAV-AFP;第四组:DC+rAAV+SMMC-7721;第五组:SMMC-7721。
以上实验在37℃,5%CO2培养箱培养24 h,培养结束前4 h,加入20 μl MTT(5 mg/ml)继续培养。培养结束,用酶标仪在492 nm测OD值。
1.4.9杀伤活性计算方法 杀伤活性=[(1- 实验组OD值-效应细胞OD值)/靶细胞OD值]×100%。

2 结果
2.1 AFP基因扩增结果根据NCBI找到的AFP基本信息(ID174),合成了NM-001354717.1CDS序列,成功扩增AFP基因(1 356 bp)。
2.2AFP转染至AAV-IRES-hrGFP腺相关病毒,构建AFP基因过表达AAV2载体。见图1。
图1 AFP转染至pAAV-IRES-hrGFP腺相关病毒构建的AAV2表达载体
2.3 Q-PCR测定病毒滴度及AFP表达水平结果
2.3.1病毒滴度测定结果 根据Q-PCR测定结果,绘制原始曲线、溶解曲线以及标准曲线,计算出AAV2对照病毒滴度为1.35E+10,AFP过表达病毒滴度为6.75E+10。
2.3.2Q-PCR测定AFP表达水平 见图2。从定量PCR测定的结果表明,AFP的表达水平显著上调。
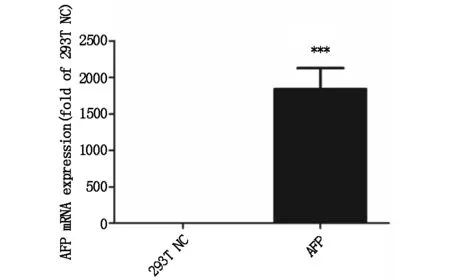
图2 Q-PCR测定AFP表达结果
2.4 DC以及rAAV-AFP感染的DC对肝癌细胞SMMC-7721杀伤活性实验及分析见表1。结果表明,转染AFP的rAAV可以提高DC对SMMC-7721的杀伤活性。
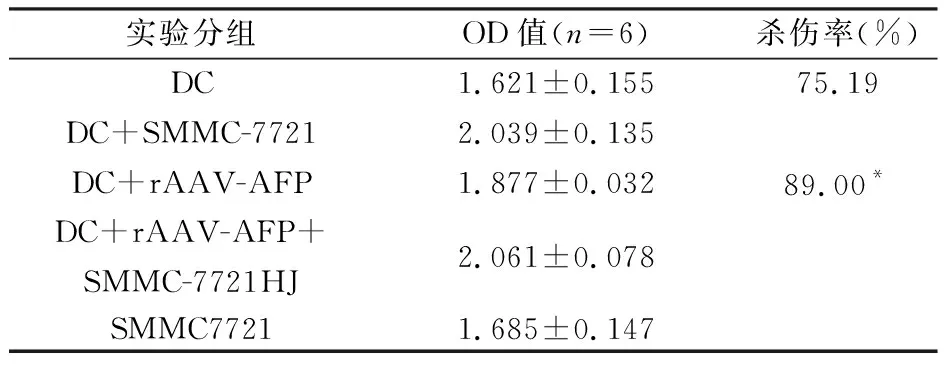
表1 DC、DC+rAAV-AFP对SMMC-7721的杀伤活性
3 讨论
腺相关病毒(AAV),属于微小病毒科(parvovirus),为无包膜的单链线状DNA病毒,需要辅助病毒(通常为腺病毒)参与复制。重组腺相关病毒载体(rAAV)源于非致病的野生型腺相关病毒,由于其安全性好、宿主细胞范围广(分裂和非分裂细胞)、免疫源性低,在体内表达外源基因时间长等特点[5,6],被广泛用于体内实验研究。腺相关病毒载体整合率远低于慢病毒载体,但其可以以染色体外形式长期(数月至数年)存在于非分裂细胞中,从而实现外源基因长期表达。
常用腺相关病毒载体系统AAV Helper-Free System,能产生AAV2血清型病毒而无需辅助病毒。该系统包含3个质粒:1个重组表达质粒和2个辅助质粒。它可以将目的基因克隆至重组pAAV载体上;将AAV感染必须的腺病毒基因(E2A、E4及VA等)构建至辅助质粒pHepler上,将AAV复制基因rep和capsid结构基因cap构建至质粒pAAV-RC上。所以,本实验选择该病毒作为载体。
免疫疗法在肿瘤治疗中的作用近年来得到了广泛认可。作为恶性肿瘤的辅助疗法,为肿瘤治疗提供了新模式[7]。树突状细胞是目前为止发现的功能最强的、也是唯一能激活初始型T细胞的专职抗原递呈细胞(APC),DC能摄取、加工和递呈抗原。同其他的抗原递呈细胞相比,树突状细胞最大的特点是能够显著刺激初始型T细胞增殖,促进细胞毒T细胞(CTL)和T辅助细胞(Th)的生成,启动T细胞介导的免疫反应。以DC为基础,转导特异的肿瘤抗原基因制备DC疫苗,有可能成为一种高效、低毒的肿瘤治疗方法[8]。
AFP是一种在胎儿时期高表达,在出生后表达降低或消失的基因[9,10]。在肝癌组织中及肝癌患者的外周血中,甲胎蛋白往往有异常的表达增高[11,12],在急性期时AFP浓度甚至高达1 g/L[13]。可以作为肝癌的诊断指标,近年来也作为肝癌的特异性抗原用于肝癌的免疫及基因治疗研究。
本实验选择人外周血分离的单核细胞,通过用IL-4,GM-CSF,TNFα等细胞因子诱导DC的生成,通过合成了甲胎蛋白(AFP)引物并对其进行体外扩增,测序,然后将其转染至腺相关病毒AAV2,用转染AFP的rAAV感染DC并将被感染的DC在体外与表达AFP的肝癌细胞株SMMC-7721共同培养,同时用未感染rAAV-AFP的DC做对照,检测其在体外SMMC-7721的杀伤作用,评价携带AFP的rAAV对DC体外抗肿瘤的效果。从实验结果可以看出,携带AFP的rAAV对DC体外对人肝癌细胞SMMC-7721(CTL)的杀伤活性明显高于未感染rAAV-AFP的DC(P<0.05),证明转染AFP的rAAV可以明显增强DC的抗肿瘤功能,为以腺相关病毒为载体的肝癌免疫基因治疗提供了实验基础。
——一道江苏高考题的奥秘解读和拓展

