MiRNA-570通过靶向和下调KLF9来促进肝癌的增殖
何 奕,王 伟,陈 坡,杨 硕,彭向东
(1湖南省肿瘤医院头颈内科,湖南 长沙 410013;2.中南大学湘雅三医院药学部,湖南 长沙 410013)
肝细胞肝癌( hepatocellular carcinoma,HCC)是一种常见的消化道恶性肿瘤,其死亡率高居恶性肿瘤第3位。我国每年死于肝癌的人数约38.3万,占全球肝癌死亡人数的51%,严重威胁我国人民健康[1]。因此,揭示肝癌的分子机制具有重要意义。MicroRNA(MiRNA)是非编码的单链RNA,在肿瘤的发生和发展中具有至关重要的作用[2]。
miRNA被认为是诊断、治疗和预后肝癌的新型非侵入性标志。Wang等证明,miR-616的过度表达可刺激肝癌增殖[3]。Liu等人提出miR-661在影响肝癌的EMT中的作用,从而触发了肿瘤细胞的远处转移[4]。MiRNA-570是在胃癌和肝细胞癌中上调的23个核苷酸的miRNA[5]。但是,miRNA-570在肝癌中的作用尚不清楚。Kruppel样因子(KLFs)属于一种具有锌指结构的转录因子,广泛参与细胞性能和胚胎发育。KLF9是KLF家族的成员之一,其影响许多类型的肿瘤细胞的增殖和凋亡[6]。本研究主要探讨miRNA-570在肝癌进程中的生物学作用及其与KLF9的相互作用。我们的结果有望为改善肝癌的治疗效果提供了新思路。
1 材料和方法
1.1 样品采集
2017-01~2019-12收治的40例肝癌患者中手术切除肝癌组织和邻近的正常组织。患者未接受术前抗肿瘤治疗,也没有其他恶性肿瘤病史。收集纳入的肝癌患者的临床数据。所有受试者自愿参加研究并签署书面知情同意书。本研究得到医院伦理委员会的批准。
1.2 细胞培养和转染
细胞库(中国上海)提供肝癌细胞系(HEPG2,SMMC7721和Hep3b)和正常人肝细胞系(HL-7702),并在Dulbecco改良的Eagle培养基(DMEM; Gibco,Rockville,MD,含10%胎牛血清(FBS; Gibco,Rockville,MD,USA),100Ul/mL青霉素和0.1mg/mL链霉素的酶在37°C的5%CO2培养箱中培养,并使用Lipofectamine 2000(Invitrogen,Carlsbad,CA,USA)进行转染。6h后,更换完全培养基。收获转染的细胞24~48h用于体外实验。
1.3 实时定量聚合酶链反应(qRT-PCR)
裂解细胞以收获总RNA,并进行反转录以提取互补的脱氧核糖核酸(cDNA)。使用SYBR PrimeScript RT-PCR(TaKaRa,中国大连)在cDNA上进行qRT-PCR。ABI 7300 PCR系统。将相对水平相对于3-磷酸甘油醛脱氢酶(GAPDH)的相对水平标准化。引物序列如下:miRNA-570:F:5′-CGAAAACAGCAATTACCTTTGC-3′,R:5′-TAGCAAAATTGAGGCCAAGG-3′; KLF9:F:5'-ACAGTGGCTGTGGGAAAGTC-3',R:5'-TCACAAAGCGTTGGCCAGCG-3'。 U6:F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACGCTTCACGAATTTGCGT-3′。GAPDH:F:5'-AGGTCGGTGTGAACGGATTTG-3',R:5'-TGTAGACCATGTAGTTGAGGTCA-3'。
1.4 细胞活力检测(CCK-8)
将细胞以每孔1×104个细胞的密度接种于96孔板中,并培养过夜。使用CCK-8试剂盒在指定的时间点记录450nm处的吸光度(A)。绘制细胞活力曲线。
1.5 细胞周期测定
收集1×106个细胞,用磷酸盐缓冲盐水(PBS)洗涤两次,并固定在预冷的70%乙醇中。随后,将细胞与RNase孵育15min,将50μg/mL碘化丙啶孵育30min。使用流式细胞仪(FACSCalibur; BD Biosciences,美国)测定细胞周期。
1.6 蛋白质印迹
使用放射免疫沉淀测定法(RIPA)从细胞中提取总蛋白,并通过双辛可宁酸(BCA)方法(Beyo-time,中国)进行定量。加载蛋白质样品进行电泳,然后将其转移到聚偏二氟乙烯(PVDF)膜上(Millipore,MA,美国)。将膜用5%脱脂乳封闭,以封闭非特异性部位。2h后,将膜与一抗和二抗一起孵育。通过增强化学发光(ECL)暴露条带,并通过图像软件(NIH,Bethesda,MD,USA)进行分析。
1.7 双荧光素酶报告基因基因检测
构建了KLF9的野生型和突变型荧光素酶质粒。用0.5μg野生型/突变型KLF9和20 nM miRNA-570 mimic / NC共转染24孔板中每孔2×105细胞的细胞。 48h后,裂解细胞以测定相对荧光素酶活性(Promega,美国)。
1.8 统计学方法
2 结果
2.1 肝癌中MiRNA-570的上调
肝癌中miRNA-570的上调通过qRT-PCR在40个匹配的肝癌组织和邻近的正常组织中测定了miRNA-570的水平。结果表明,与邻近正常组织相比,肝癌组织中的miRNA-570明显上调。此外,miRNA-570在肝癌细胞系中高表达。在选择的三种肝癌细胞系中,HEPG2和SMMC7721细胞表达的miRNA-570最低和最高。以上数据说明了miRNA-570可能参与了肝癌并在肝癌中高表达。见图1。
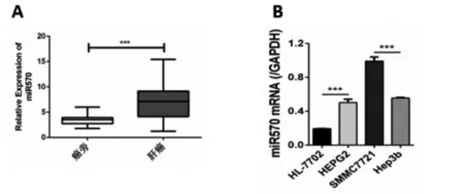
图1 肝癌中miR-20a-5p的上调A:癌旁正常组织和肝癌组织中的MiR570;B:HEPG2,SMMC7721和Hep3b和HL-7702细胞中MiR570表达水平。
2.2 MiRNA-570促进了肝癌的生存能力
分别在HEPG2和SMMC7721细胞中构建了MiRNA-570过表达和敲低模型。通过qRT-PCR验证了miRNA-570模拟物和抑制剂的转染效率。在用miRNA-570模拟物转染的HEPG2细胞中,其存活率、S期细胞比例显著增强。miRNA-570抑制剂转染SMMC7721细胞降低了其活力和S期细胞比例。见图2。
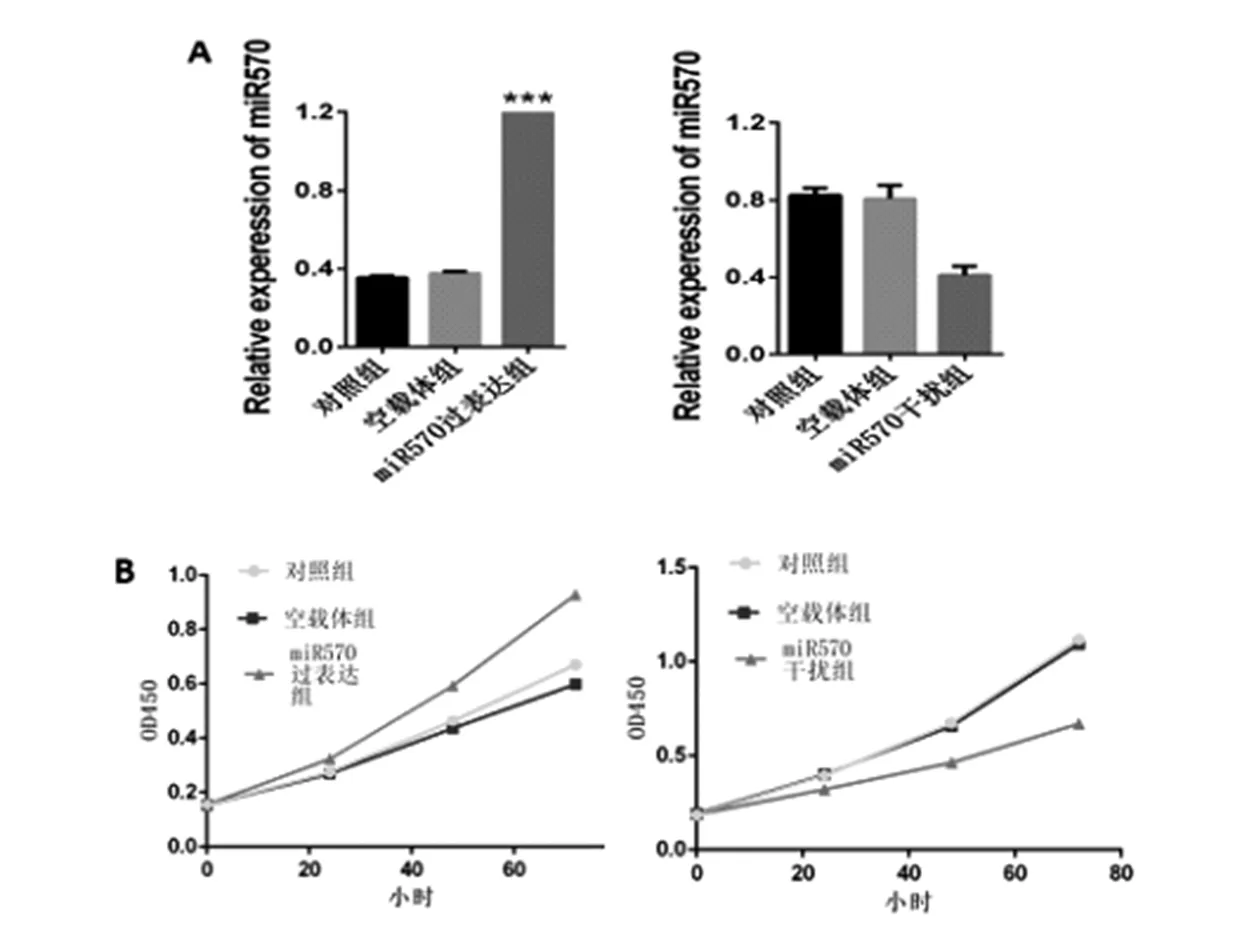
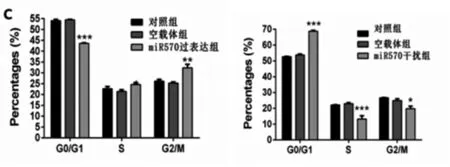
图2 MiR570增加肝癌细胞的生存能力A:miR570模拟物和抑制剂在HepG2和SMMC7721细胞中的转染效率。 B:对照组、空载体组或miR570过表达组转染的HepG2细胞中的细胞活力(左)。在对照组、空载体组或mi570干扰组转染的SMMC7721细胞中的细胞活力(右)。 C:对照组、空载体组或miR570过表达组转染的HepG2细胞中G2,S和G1期细胞的百分比(左)。转染了对照组、空载体组或mi570干扰组的SMMC7721细胞中G2,S和G1期细胞的百分比(右)。
2.3 KLF9是MiRNA-570的直接靶标
通过TargetScan中的生物信息学预测,发现miRNA-570可以与KLF9 3’UTR结合(图3A)。荧光素酶活性显着降低,从而验证了miRNA-570和KLF9之间的结合关系(图3B)。与邻近的正常组织相比,肝癌组织中的KLF9被下调(图3C)。此外,在miRNA-570和KLF9之间的表达水平被鉴定为负相关(图3D)。在HEPG2细胞中miRNA-570的过表达下调了KLF9的mRNA和蛋白水平,而在SMMC7721细胞中miRNA-570的敲低则上调了KLF9的水平(图3E)。见图3。

图3 KLF9是miR570的直接靶标A:KLF9和miR570启动子区域的结合位点。 B:共转染的293T细胞中的荧光素酶活性。 C:qPCR癌旁组织和肝癌组织中的KLF9水平(25对样本)。 D:miR570和KLF9的表达水平呈负相关。 E:对照组、空载体组或miR570过表达组转染的HepG2细胞和对照组、空载体组或miR570干扰组转染的SMMC7721细胞中KLF9的mRNA水平。
3 讨论
我国肝癌发病率仍维持在较高水平,且预后较差,5年相对生存率仅12.1%[7]。在肝癌的发病过程中,多种基因和信号通路失调。miRNA可以识别并特异性靶向mRNA 3’UTR[8],从而降解mRNA或抑制其翻译以介导转录后调控。在肝癌中发现了大量异常表达的miRNA。这些miRNA与肝癌的发生和发展密切相关,例如miR-675-5p20,miR-50421和miR-193a-3p22。在本文中,我们观察到miRNA-570在肝癌组织和细胞系中高表达。这种过表达加速了HEPG2细胞的增殖和侵袭,并降低了G1期的细胞比例。相反,敲低miRNA-570却产生了相反的结果。因此,认为miRNA-570是肝癌中的癌基因。据报道,miRNA通过直接调控靶基因的表达可以发挥一定的调控作用。通过在线预测,观察到miRNA-570和KLF9的启动子区域中存在结合位点。然后,双重荧光素酶报告基因分析进一步证实了它们的结合关系。KLF9位于人类染色质9q1324上。KLF9被确定为潜在的抑癌基因,在肝癌和大肠癌中被下调。Sun等发现肝癌组织中KLF9的下调与p53水平密切相关[9]。此外,KLF9可以通过抑制AKT途径来抑制前列腺癌的恶性生长。一项相关研究表明,miR-889通过靶向KLF928来影响肝癌的增殖和侵袭能力[10]。因此,KLF9在肝癌中具有临床意义。我们的结果表明KLF9在肝癌中被下调,并被miRNA-570负调控。总的来说,miRNA-570通过靶向和下调KLF9在肝癌中发挥致癌作用。上述结果表明miRNA-570在肝癌中被上调,这通过靶向KLF9来增加肝癌细胞的增殖和侵袭性。

