抑制PDGFRα 活化对小鼠脑损伤后胶质细胞增殖和瘢痕形成的影响
裴丹,刘学
(锦州医科大学人体解剖学教研室,辽宁 锦州 121000)
中枢神经系统(central nervous system,CNS)损伤往往伴随着血脑屏障(blood-brain barrier,BBB)破坏,浸润的粒细胞和CNS 固有的胶质细胞过度增殖并分泌各种细胞因子和生长因子引发炎症反应[1]。在损伤的CNS 各种轴突生长抑制因子,如硫酸软骨素蛋白多糖(chondroitinsulphateproteoglycans,CSPGs),聚集在损伤周围形成瘢痕区[2]。抑制瘢痕形成可能是中枢神经损伤后促进轴突再生的新方法。与配体发生特异性结合的血小板衍生生长因子受体α(platelet-derived growth factor receptor α,PDGFRα),使受体二聚化暴露活性位点从而激发酪氨酸激酶的活性,激活受体的自体磷酸化[3]。作用于核内蛋白的转录因子,使细胞发生一系列的表型改变,促进细胞的生长、分裂[4]和增殖。小鼠脑损伤后在损伤周围会出现磷酸化的血小板衍生生长因子受体α(phosphorylated platelet-derived growth factor receptor α,p-PDGFR α)表达水平升高,而p-PDGFRα 表达水平升高是否也与胶质细胞增殖及瘢痕形成有关尚未见相关报道。因此,本研究进一步探讨PDGFRα 与细胞增殖及瘢痕形成的相关性,并观察PDGFRα 抑制剂AG1296 对细胞增殖和瘢痕形成的影响,以期为神经损伤后的再生修复治疗提供理论和实验依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器48 只8 周龄SPF 级雄性BALB/c 小鼠(中国医科大学实验动物部),体质量为25~35 g,动物生产许可证号:SYXK(辽)2013-0001。兔抗p-PDGFRα 和兔抗PDGFRα(美国Santa Cruz 公司),鼠抗GAPDH单克隆抗体(美国Proteintech 公司),辣根酶标记的羊抗兔和羊抗鼠IgG(北京中杉金桥生物技术有限公司),兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、兔抗离子钙接头蛋白分子1(ionized calcium binding adaptor molecule 1,IBA-1)、兔抗Ⅳ型胶原蛋白(type Ⅳcollagen,Col Ⅳ)、兔抗NG2、兔抗纤连蛋白(fibronectin,FN)和兔抗CD45(英国Abcam 公司)。小鼠脑立体定位仪(型号DW-2000,成都泰盟科技有限公司),高压灭菌器(型号VPV-5032,长春百奥技术有限公司),塑料薄膜封口机(型号SF300,温州兴业机械设备有限公司),转膜仪(美国Bio-Rad公司),恒温水浴箱(型号HHS21-6-S,上海跃进公司),水平摇床(型号WD-9405A,北京六一仪器厂)。
1.2 实验动物模型的制备及分组按照白丹等[5]的方法制备小鼠黑质纹状体通路损伤模型。用10%水合氯醛按体质量0.03 mL·g-1腹腔注射麻醉后固定在小鼠脑功能立体定位仪上。门齿栏设置成比耳屏线低3 mm。剪掉头皮顶部毛后消毒并在中央纵向切开,清除颅顶骨膜,在前囟点右后方1.5 mm 处用牙钻缓慢钻出一个约1 mm×2 mm 的长方形缺口,暴露大脑。将宽度为1.5 mm 的切刀固定在直线型立体框架内,在右侧颅骨中线外侧0.5 mm,前囟点后1.5 mm 处,距离大脑表面深度5.5 mm 插入切刀。然后缓慢拔出刀片,止血缝合。将模型小鼠按照损伤后注入物质不同分为2 组:黑质纹状体路部分切断+PDGFRα 抑制剂AG1296注入组(AG1296 组),24 只小鼠,手术后连续3 d内应用微量注射器沿损伤处注入AG1296,每日5 μL(5 mmol·L-1);二甲基亚砜(DMSO)对照组(DMSO 组),24 只小鼠,手术后连续3 d 应用微量注射器注入同等剂量的DMSO。
1.3 取材及制片2 组小鼠损伤后分别在1、4、7 和14 d 取脑,每次取6 只小鼠。各组每个时间点取3 只小鼠行心脏灌流冲洗,以损伤侧小鼠大脑半球的损伤部位为中心,取前后2 mm 脑组织迅速放入-80℃冰箱保存备用。剩余3 只小鼠行心脏灌流固定用于免疫组织化学染色,取脑组织4%多聚甲醛后固定过夜,逐级脱水,二甲苯透明,浸蜡,包埋。5 μm 厚度水平连续切片,贴到多聚赖氨酸预处理的玻片烘干备用。
1.4 免疫组织化学染色检测各组小鼠脑组织中p-PDGFRα、GFAP、IBA-1、NG2、CD45、FN 和ColⅣ的蛋白表达石蜡切片脱蜡水化,用0.01 mol·L-1的柠檬酸盐缓冲液微波沸腾修复,过氧化氢阻断,非免疫动物血清封闭,一抗p-PDGFRα(1∶100)、GFAP(1∶1 000)、IBA-1(1∶200)、NG2(1∶200)、CD45(1∶100)、FN(1∶200)和ColⅣ(1∶500),按比例稀释后滴至切片组织处4℃孵育过夜,生物素标记的二抗(S-P试剂盒C 溶液),孵育10 min。链霉菌抗生素-过氧化物酶溶液(S-P 试剂盒D 溶液)孵育10 min 后DAB 溶液显色,显微镜下观察。自来水冲洗,梯度酒精脱水干燥,二甲苯透明,中性树胶封片。光学显微镜下观察免疫阳性产物的位置、分布、染色强弱及阳性细胞数,图像用NIS-Elements F 系统拍片后以TIF 文件保存。
1.5 Western blotting 法检测各组小鼠脑组织中p-PDGFR-α、PDGFR-α、GFAP 和IBA-1 蛋白表达水平用0.9%生理盐水冲洗剪碎脑组织,添加组织质量4 倍的含1% PMSF 的RIPA 裂解液后,超声粉碎机粉碎,4℃裂解30 min。4℃、12 000 r·min-1离心30 min,取上清液即为所得组织蛋白,BCA蛋白试剂盒进行蛋白定量,配置上样体系,上样体积10 μL,加入5×loading buffer 2 μL,剩余体积用PBS 缓冲液补齐,100℃、5 min 蛋白变性后-80℃保存。配置8%和10%分离胶,微量注射器加样,浓缩胶内电泳电压设为80 V,分离胶内电泳电压设置为120 V。转膜后用含5%血清的TBST 溶液37℃封闭1 h,加入一抗稀释液GAPDH(1∶10 000)、p-PDGFR-α(1 ∶200)、PDGFR-α(1 ∶200)、GFAP(1∶50 000)和IBA-1(1∶1 000),4℃冰箱内摇床上孵育过夜,洗膜后二抗工作液(1∶5 000)摇床孵育2 h。TBST 漂洗后,ECL 发光用Bio-Rad凝胶电泳图像分析仪进行采图。
1.6 统计学分析采用SPSS 19.0 统计软件进行统计学分析。2 组小鼠脑组织中p-PDGFRα、GFAP 和IBA-1 蛋白表达水平以表示,所有实验重复3 次。多组间样本均数比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠脑损伤后脑组织中p-PDGFRα 蛋白表达水平采用免疫组织化学染色和Western blotting 法检测2 组小鼠脑损伤1、4、7 和14 d 后p-PDGFRα 蛋白表达。免疫组织化学染色检测结果显示:各时间点 AG1296 组小鼠脑组织中p-PDGFRα 蛋白棕黄色阳性表达细胞数较DMSO组明显减少(图1)。Western blotting 法检测结果显示:在相对分子质量为185 000 标记处可见p-PDGFRα 蛋白的免疫印迹条带(图2);定量分析结果:各时间点AG1296 组小鼠脑组织中 p-PDGFRα 蛋白表达水平明显低于DMSO组(P<0.05 或P<0.01)(图3)。


图2 Western blotting 法检测2 组小鼠脑损伤后脑组织中p-PDGFRα 蛋白表达电泳图Fig.2 Electrophoregram of expressions of p-pDGFR α protein in brain tissue of mice after injury in two groups detected by Western blotting method
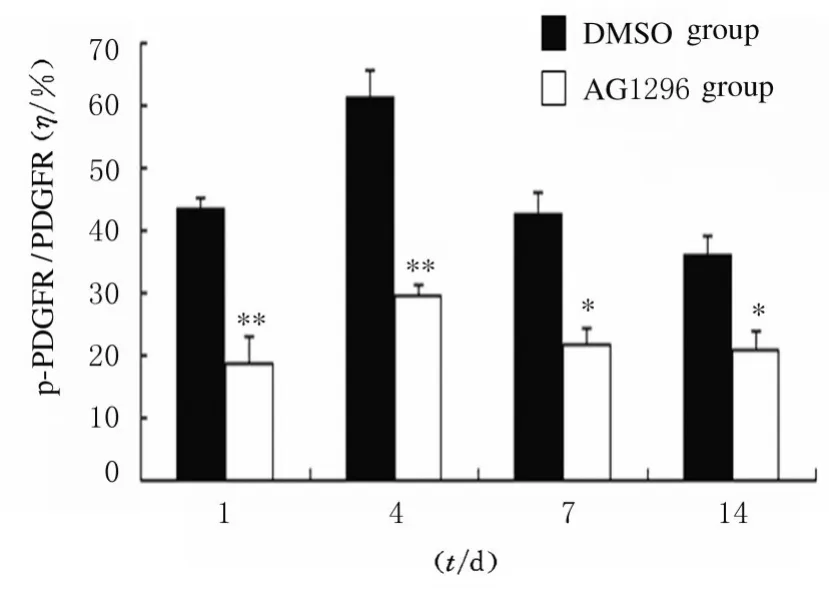
图3 2 组小鼠脑损伤后不同时间点脑组织中p-PDGFRα 蛋白表达水平Fig.3 Expression levels of p-PDGFRα protein in brain tissue of mice after brain injury
2.2 各组小鼠脑损伤后脑组织中GFAP 和IBA-1蛋白表达水平免疫组织化学染色检测结果显示:与DMSO 组比较,AG1296 组小鼠脑损伤后1、4、7 和14 d 损伤部位周围棕黄色星形胶质细胞数明显减少,并且细胞体积变小,突起变短(图4)。与DMSO 组比较,AG1296 组小鼠脑损伤部位周围小胶质细胞IBA-1 阳性细胞数明显减少(图5)。Western blotting 法检测结果显示:在相对分子质量为48 000 和17 000 标记处可见GFAP 和IBA-1 蛋白的免疫印迹条带(图6);定量分析结果:AG1296 组GFAP 和IBA-1 蛋白相对表达水平明显低于DMSO 组(P<0.05 或P<0.01)(图7)。


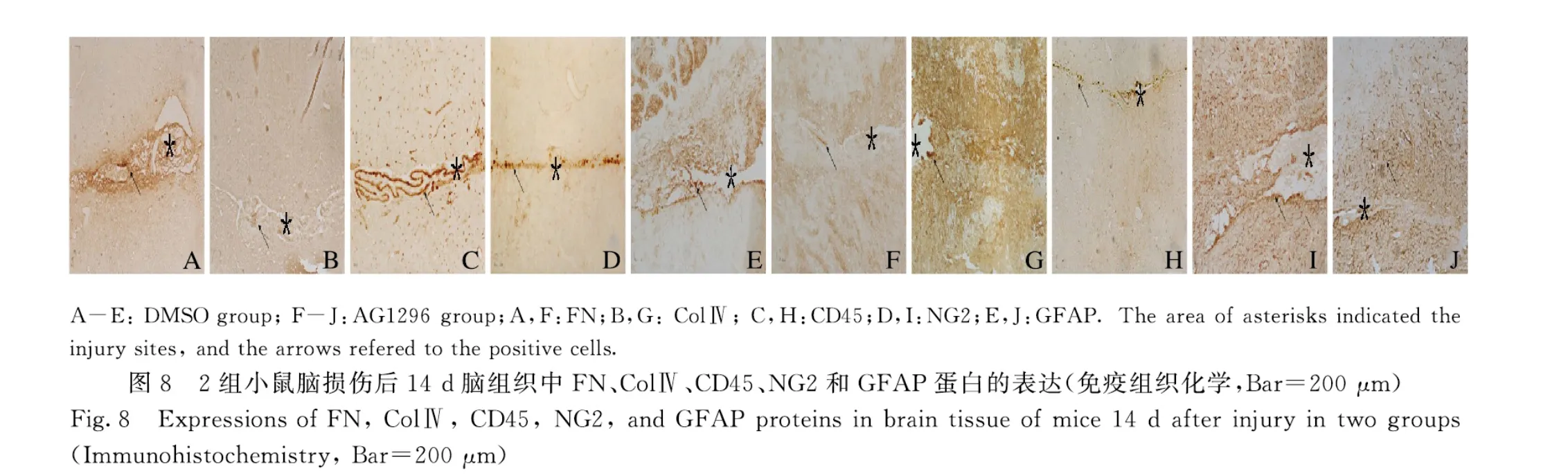
2.3 各组小鼠脑损伤后14 d 脑组织中FN、ColⅣ、CD45、NG2 和GFAP 蛋白表达免疫组织化学染色结果显示:损伤14 d 后,DMSO 组小鼠脑组织中可见FN 阳性细胞聚集在损伤中心部位(图8A),ColⅣ阳性细胞也密集地沉积在损伤的中心部位(图8B),表明纤维瘢痕形成在损伤中心部位;大量CD45 阳性细胞聚集在损伤区周围(图8C),NG2 阳性细胞即少突胶质前体细胞数在损伤位置大量增多(图8D),激活的星形胶质细胞(GFAP 阳性细胞)在损伤周边明显增多并且其突起形成境界膜包围着纤维瘢痕(图8E)。AG1296 组小鼠脑组织中,FN 阳性细胞在损伤中心区明显减少(图8F),ColⅣ阳性细胞只有少量沉积在损伤的中心部位(图8G),表明纤维瘢痕形成明显减少,在纤维瘢痕区,损伤空洞消失,仅留一条缝隙;CD45 阳性细胞少量存在于损伤区周围(图8H),NG2 阳性细胞在损伤部位的周边明显减少(图8I),激活的星形胶质细胞(GFAP 阳性细胞)虽然分布整个损伤区,但并未形成明显境界膜(图8J)。

图6 Western blotting 法检测2 组小鼠脑损伤后脑组织中GFAP 和IBA-1 蛋白表达电泳图Fig.6 Elecrophoregram of expressions of GFAP and IBA-1 proteins in brain tissue of mice after injury in two groups detected by Western blotting method
3 讨论
成年的哺乳动物中枢神经创伤性损伤后横断的轴突几乎无再生能力,各种抑制因子在损伤周围阻止离断的轴突生长。本研究结果显示:DMSO 组小鼠脑组织中FN 阳性细胞聚集在损伤中心部位,ColⅣ阳性细胞也密集沉积在损伤的中心部位,表明纤维瘢痕形成在损伤中心部位,大量CD45 阳性的粒细胞聚集在纤维瘢痕位置。研究者[6]发现:在脊髓损伤模型的纤维化组织中有巨噬细胞、淋巴细胞和成纤维细胞。研究[7-8]表明:瘢痕是脑损伤后主要阻止轴突再生的因素,脑损伤形成瘢痕表达各种潜在的轴突生长抑制因子,包括CSPGs、核因子E2 相关因子 2(NF-E2-related factor 2,Nrf2)[9-12]、黏蛋白-C 和信号素3A,上述因子均可能是阻碍轴突再生的化学因素。LI 等[13]和AHMED 等[14]报道:在损伤的脊髓组织中加入ColⅣ的抑制剂DPY 可以抑制纤维瘢痕的形成,促进轴突再生穿过损伤区,并能促进脊髓损伤后轴突再生和功能恢复。本研究结果显示:给予AG1296后14 d,小鼠脑损伤部位脑组织中FN、ColⅣ和CD45 阳性细胞数较DMSO 组减少,表明小分子抑制剂AG1296 可以减少细胞增殖,进而减少纤维瘢痕的形成。本课题组将在后续实验中进一步验证抑制剂AG1296 是否可以促进损伤后轴突再生和功能的恢复。
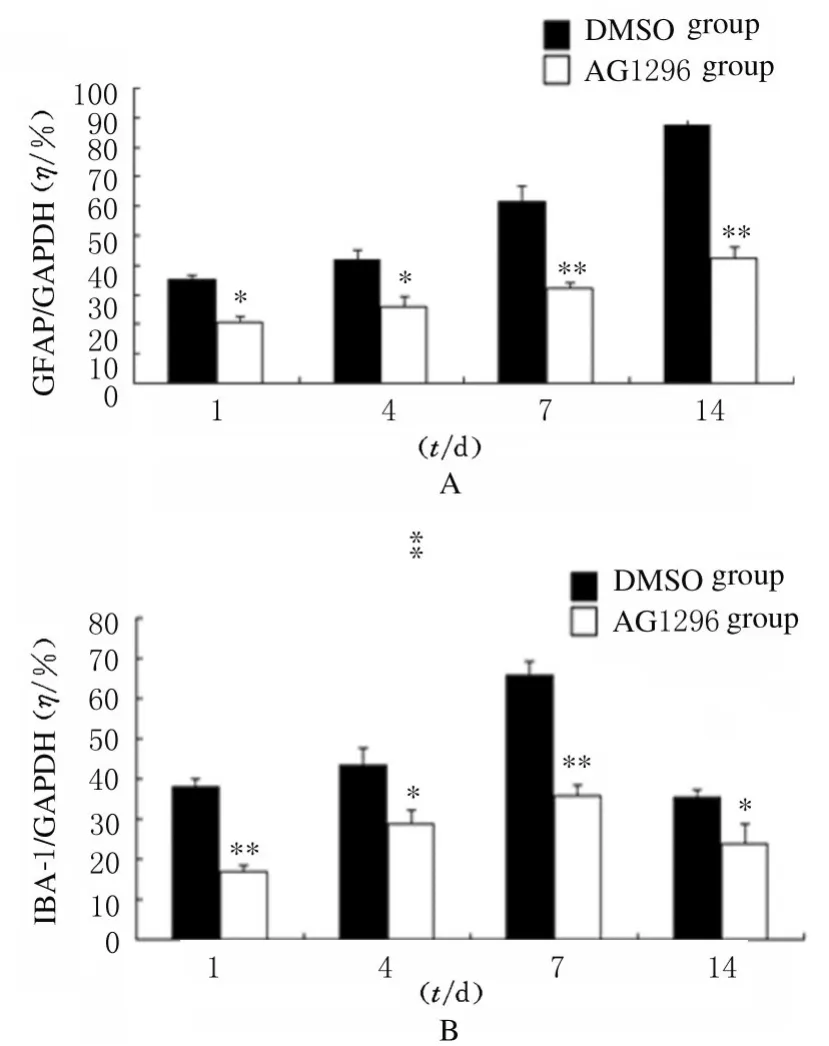
图7 2 组小鼠脑损伤后脑组织中GFAP 和IBA-1 蛋白表达水平Fig.7 Expression levels of GFAP and IBA-1 proteins in brain tissue of mice in two groups after injury
已有研究[15-18]表明:小鼠脑损伤后多种细胞因子刺激胶质细胞激活并增殖,如转化生长因子β(transforming growth factor β,TGF-β)、细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)、沉默调节蛋白1(recombinant sirtuin 1,Sirt1)和c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)。通过调控Sirt1[19]抑制胶质细胞的激活可以促进神经元的恢复。本研究结果显示:小鼠脑损伤后激活PDGFRα,并且引起反应性的星形胶质细胞、小胶质细胞和NG2 阳性的少突胶质前体细胞明显增多,胶质细胞的轴突最终封闭病变部位形成胶质界膜。这一结果导致即使神经纤维增生也无法穿透胶质界膜,进而影响损伤神经的修复;给予小分子 PDGFR α 抑制剂 AG1296 后,AG1296 组小鼠脑组织中GFAP 和IBA-1 蛋白表达水平明显降低,星形胶质细胞和小胶质细胞增殖明显减少,尽管损伤周围的胶质细胞仍然很多,但胶质界膜基本消失,NG2 蛋白免疫组织化学阳性表达的少突胶质前体细胞也明显减少,表明AG1296可以抑制PDGFRα 的活化,减少胶质细胞反应和脑损伤后胶质瘢痕的形成及炎症细胞的扩散。因此,在脑损伤后期抑制PDGFRα 信号的持续激活可能是减少细胞增殖,减少瘢痕形成,从而促进神经轴突再生的关键。从PDGFRα 信号通路与瘢痕组织形成的相关性入手研究中枢神经损伤后的神经再生机制具有重要意义,而其作用的具体机制仍需进一步深入研究。

