片仔癀对LncRNA-ANRIL 介导大肠癌淋巴管新生的影响
逯 遥 ,张 敏 ,刘 洁 ,毛倩倩 ,曹治云 ,林久茂 *
1 福建中医药大学中西医结合研究院,福建 福州350122;
2 福建省中西医结合老年性疾病重点实验室,福建 福州350122;
3 中西医结合基础福建省高等学校重点实验室(福建中医药大学),福建 福州 350122
大肠癌(colorectal cancer,CRC)包括结、直肠癌,是最常见的消化道恶性肿瘤之一。 据美国癌症协会的最新统计数据,全球每年新增大肠癌发病例数接近109.6 万,且造成超过50%(>50 万)患者的死亡[1],造成大肠癌高死亡率的原因是大多数患者在诊断时已是晚期且伴有转移不适合手术。 淋巴结转移是大肠癌最常见和最早出现的转移方式,大肠癌淋巴管新生是其淋巴结转移及其复发的主要因素和机制[2],其发生机制涉及多个癌基因和抑癌基因的表达及长链非编码RNA(long non-coding RNA,LncRNA)表观遗传学调控等,是一个多基因、多途径、多步骤的协同积累过程[3]。 血管内皮生长因子-C(VEGF-C)是目前公认最主要的促淋巴血管生成因子,而抑制大肠癌细胞VEGF-C 的表达,可抑制其淋巴管新生,进而防止大肠癌细胞的转移[4-5]。 长链非编码RNA-ANRIL(LncRNA-ANRIL)是长度为3.8 kb 的一种LncRNA,与肿瘤的发生、发展及转移密切相关[6]。最新研究表明,在结直肠癌患者中LncRNA-ANRIL 显著过表达,且ANRIL 高表达患者的5 年生存率明显低于ANRIL 低表达患者,有趣的是还发现ANRIL 高表达的患者也有较高的VEGF-C 表达, 因此推测LncRNA-ANRIL 可通过调控促淋巴管新生关键因子VEGF-C 的表达促进大肠癌淋巴管新生,从而导致大肠癌淋巴管转移[3]。
片仔癀(Pien Tze Huang,PZH)对多种恶性肿瘤的临床疗效显著,且无明显毒副作用[7]。实验研究发现PZH 可通过抑制VEGF-C 信号通路抑制大肠癌淋巴管新生,同时通过调控多条信号通路,诱导大肠癌细胞凋亡,抑制大肠癌细胞增殖、转移和血管新生等[4,8-10],但其作用机制仍未阐明,以及未见从LncRNA-ANRIL 方面探讨PZH 抑制肿瘤淋巴管新生的报道。 因此,本文在此基础上研究PZH 抑制LncRNA-ANRIL 介导大肠癌淋巴管新生的作用机制。
1 实验材料
1.1 药物和细胞株
PZH 由漳州片仔癀药业股份有限公司提供(批号:1808087);人大肠癌 HCT-116 细胞,购自中国科学院上海生命科学研究院细胞资源中心;人淋巴内皮细胞(HLEC),购自广州吉尼欧生物科技有限公司,细胞均保存于福建中医药大学中西医结合研究院医学实验中心液氮中。
1.2 实验试剂
RPMI1640 培养基(批号:C11875500BT)、胎牛血清(FBS,批号:10099141)、0.25% EDTA-胰酶(批号:25200072),购自美国 Life 公司;青-链霉素混合液(双抗,批号:sv30010)、磷酸盐缓冲液(PBS,批号:SH30256.01B),购自美国 Hyclone 公司;ECM 培养基(批号:28475)、P/S 溶液(批号:27670)、ECGS(批号:27888)、FBS(批号:27849),购自 Scien Cell生物技术公司;CCK-8(批号:k1018-1),购自美国APExBIO 公司;结晶紫粉末(批号:C8470),购自北京索莱宝科技有限公司;Transwell 小室(批号:3422),购自美国Corning 公司;管腔形成试剂盒(批号:ECM625),购自德国 Merck Millipore 公司;聚氰基丙烯酸正丁酯(BCA)蛋白定量检测试剂盒(批号:23227)、SYBRTMSelect Master Mix 试剂(批号:4472908)、Lipofectamine RNAiMAX 转染试剂(批号:13778-030),购自美国 Thermo 公司;Super ECL Star(超敏化学发光检测试剂盒)(批号:S-6009),购自中国宇恒生物公司;细胞裂解液(Pierce RIPA Buffer,批号:AR0102-100),购自中国博士德生物工程有限公司;磷酸酶抑制剂(PhosStop,批号:4906837001 ) 、 蛋 白 酶 抑 制 剂 (Cocktail, 批 号4693124001),购自瑞士Roche 公司;苯甲基磺酰氟(PMSF,批号:ST506),购自中国碧云天生物技术有限公司;SDS-PAGE 配胶试剂盒(批号:CW0022M),购自北京康为世纪生物科技有限公司;β-actin(批号:60008-1-Ig)、GAPDH 抗体(批号:60004-1-lg)、VEGF-C 抗体(批号:22601-1-AP)、二抗(鼠抗)(批号:SA00001-1)和二抗(兔抗)(批号:SA00001-2),均购自武汉三鹰生物技术有限公司;逆转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,批号:RR047A),购自宝日医生物技术(北京)有限公司;Si-NC 和Si-ANRIL 的序列,购自上海吉玛制药有限公司。
1.3 主要仪器
CO2培养箱(美国 Thermo 公司);超净工作台(苏州净化设备公司);倒置显微镜系统(德国Leica仪器有限公司);Countes®全自动细胞计数仪(美国Life 公司);连续波长多功能酶标仪(奥地利TECAN公司);电泳仪、电泳槽、小型转膜仪、化学发光成像系统(美国Bio-Rad 公司);7500 Fast 荧光定量PCR仪(美国 ABI 公司)。
2 实验方法
2.1 药物及试剂的配制
PZH 在研钵中研成细粉末后,用PBS 配制成25 mg/mL 溶液,超声溶解 30 min,用 0.45 μL 孔径的滤膜过滤,经高压灭菌后于-20 ℃贮存备用。 RPMI 1640 完全培养基含10% FBS 和1%双抗,4 ℃冰箱保存备用。 ECM 完全培养基含5%FBS 和1%P/S溶液、1%ECGS,4 ℃冰箱保存备用。
2.2 细胞培养
HCT-116 细胞用RPMI1640 完全培养基培养,置于37 ℃、5%CO2饱和湿度的培养箱中培养,细胞单层贴壁生长,待细胞密度达到80%~90%时,加入1 mL 0.25%胰蛋白酶消化,后加入2 mL 的完全培养基终止消化后,1 000 r/min 离心 3 min,弃上清收集沉淀细胞,用完全培养基重悬制成新细胞悬液后传代。HLEC 于ECM 完全培养基中培养,按1.0×105个 /mL 接种到 6 孔板中(2 mL/孔),此时培养 基为转染后收集的肿瘤培养上清(tumor culture su-pernatants,TSNs), 分为 Si-NC 组、Si-ANRIL 组、Si-NC+PZH(0.25 mg/L)组,每组 3 个重复。
2.3 细胞活力检测
HCT-116 细胞按 1.5×105个 /mL 接种于 96 孔板中(100 μL/孔),当细胞汇合度达到 50%~60%时,吸走孔中原培养基,每孔加入100 μL 含有不同浓度 PZH(终浓度分别为 0、0.25、0.50、0.75 mg/mL)的完全培养基继续培养24 h 后,吸弃培养基,每孔加入 100 μL 浓度为 0.5 mg/mL MTT 溶液继续培养4 h 后,吸弃 MTT 溶液,每孔加入 100 μL DMSO 后,置于酶标仪(波长570 nm)测光密度(A)值。 HCT-116 细胞转染SiRNA 36 h 后,弃掉培养基,按照说明书将CCK-8 溶液加入到每孔中,继续培养2 h后,在 450 nm 波长下测 A 值。 HLEC 按1.0×105个 /mL接种于 96 孔板中(100 μL/孔),在TSNs 中培养 24 h后,CCK-8 检测细胞活力,操作步骤同上,每个浓度做6 个复孔。
细胞活力(%)=实验组 A 值/对照组A 值×100%
2.4 RT-qPCR 检测 LncRNA-ANRIL 的表达
取对数生长期的HCT-116 细胞按1.0×105个/mL接种于 6 孔板中(2 mL/孔),待细胞汇合度达到50%~60%时,将细胞分成对照组和PZH 组,PZH 组每孔加入不同浓度 PZH(0.25、0.50、0.75 mg/mL)溶液后,继续培养24 h 后,每孔加RNAiso Plus 1 mL提取RNA,每组做3 个复孔。 NanoDrop1000 核酸检测仪对RNA 的浓度进行测定,应用PrimeScriptTMmiRNA RT-qPCR kit 进行 Poly(A)加尾反应和反转录反应。 RT-qPCR 反应体系 10 μL,即 cDNA 溶液2 μL,SYBRTMSelect Master Mix 5 μL,PCR Forward Primer (10 μmol/L) 0.8 μL,DEPC 2.2 μL,于 7500 Fast PCR 仪进行RNA 表达分析。 通过阈值分析比较,采用循环数(Ct)法对数据进行分析处理。定量采用 2-ΔΔCt法,GAPDH 为内参,计算 LncRNA-ANRIL 的相对表达量。HCT-116 细胞转染SiRNA 后检测LncRNA-ANRIL 表达操作步骤同上。 LncRNAANRIL 正向引物:5’-CCGCTCCCCTATTCCCCTTA-3’,反向引物:5’-CCTGATTGGCGGATAGAGCA-3’;GAPDH 正 向 引 物 :5’-GGAGCGAGATCCCTCCAA AAT-3’,反向引物:5’-GGCTGTTGTCATACTTCTCA TGG-3’。
2.5 细胞转染
取对数生长期HCT-116 细胞按1.5×105个/mL接种于 6 孔板中(2 mL/ 孔),培养 24 h 后,用Lipofectamine RNAi MAX 转染试剂沉默LncRNAANRIL 的表达,转染体系如下:6 孔板终体积为1 mL,Si-NC 和 Si-ANRIL 的浓度为 50 nmol/L,2.5 μL/孔,加于 6 孔板,Lipofectamine RNAi MAX 3 μL/孔。于转染后6 h 换成RPMI1640 完全培养基继续培养,转染36 h后做后续检测:① 倒置显微镜对细胞的形态变化进行观察并拍照;② RT-qPCR 检测LncRNA-ANRIL 表达;③CCK-8 实验检测细胞活力;④Western blot 检测细胞促淋巴管新生因子VEGFC 蛋白表达。 Si-NC 序列:正向 5’-UUCUCCGAAC GUGUCACGUTT-3’,反向 5’-ACGUGACACGUUCG GAGAATT-3’;Si-ANRIL 序列:正向 5’-GCAUAUG UCUUUCUGGUAUTT-3’,反向 5’-AUACCAGAAA GACAUAUGCTT -3’。细胞活力检测做6 个重复,其余做3 个重复。
2.6 Western blot 实验
采用 Western blot 法,将不同浓度 PZH 干预HCT-116 细胞24 h 后和HCT-116 细胞敲减LncRNA-ANRIL 后的细胞裂解、变性,上样量为每孔50 μg蛋白,电泳条件:10 min 30 V、30 min 80 V、60 min 120 V,转膜条件:40 min 100 V。 5%的脱脂奶粉封闭 1 h 后,加入 VEGF-C 抗体、GAPDH 抗体或 βactin 抗体,于4 ℃摇床孵育过夜,然后加入第二抗体室温孵育1 h 后,TBST 漂洗3 次,用超敏化学发光检测试剂,在Bio-Rad 化学发光成像系统进行成像。
2.7 肿瘤培养上清的制备
HCT-116 细胞分为 Si-NC、Si-ANRIL、Si-NC+PZH 3 组,细胞转染同前所述,分别于转染后6 h 换成RPMI1640 完全培养基继续培养,于6 h 后再次换液,其中Si-NC+PZH 组更换为含PZH 0.25 mg/mL的培养基,再继续孵育24 h 后收集细胞培养上清液,即肿瘤培养上清,以3 000 r/min 离心15 min,去除细胞碎片及杂质后用于培养HLEC。
2.8 Transwell 小室实验检测细胞迁移和侵袭能力
① 迁移实验:HLEC 用TSNs 干预培养24 h 后,吸弃各孔溶液,分别进行消化,用不含FBS 的培养基重悬细胞,按每孔0.2 mL 含5×104个细胞种于Transwell 上室,下室加入 0.7 mL 完全 ECM 培养基后,置于 37 ℃、5% CO2培养箱中;9 h 后上室和下室分别用0.2 mL 和0.7 mL 4%多聚甲醛固定15 min,吸弃4%多聚甲醛后,用结晶紫染色液染色20 min,吸弃结晶紫,用棉签小心擦去Transwell 上室的细胞,最后在倒置显微镜拍照。 ② 侵袭实验:将细胞接种至有Matrigel 基质胶的Transwell 上室,其余操作步骤同迁移实验操作步骤。 每组均做3 个重复迁移和侵袭实验。
2.9 管腔形成实验检测细胞管腔形成能力
预先铺好基质胶于48 孔板中,基质胶用稀释液按照 1∶9 稀释,100 μL/孔铺胶,放于 37 ℃、5% CO2培养箱凝 1~2 h。HLEC 用 TSNs 干预培养 24 h 后,重新消化、离心、重悬、计数以 5×105/mL 接种于预铺好的培养板中,3~5 h 拍照,随机选取3 个视野,采集图像。 每组做3 个重复。
2.10 统计学方法
3 结 果
3.1 不同浓度PZH 抑制大肠癌细胞HCT-116 的活力、LncRNA-ANRIL 及 VEGF-C 的表达
MTT 实验结果显示:与对照组比较,PZH(0.25、0.50、0.75 mg/mL)组的细胞活力明显降低(P<0.01)。 PZH 组抑制率分别为(18.46±3.84)%、(36.43±3.49)%、(54.09±2.03)%,见图 1A。 RT-qPCR 结果显示:与对照组比较,PZH 可降低HCT-116 中 LncRNA-ANRIL 的表达(P<0.01),见图1B,以上结果均呈浓度依赖性。Western blot 结果显示:与对照组比较,PZH(0.25、0.50、0.75 mg/mL)组可下调HCT-116 细胞中VEGF-C 的蛋白表达,见图1C。
3.2 LncRNA-ANRIL 沉默对大肠癌细胞活力和VEGF-C 蛋白表达的影响
HCT-116 细胞转染 SiRNA 后,RT-qPCR 检测结果显示:Si-ANRIL 组 LncRNA-ANRIL 表达[(0.50±0.18)%]显著低于 Si-NC 组[(1.07±0.34)%](P<0.05),见图 2A。 倒置显微镜观察结果显示:Si-ANRIL 组细胞密度明显较Si-NC 组少,见图 2B。 CCK-8 检测结果显示:Si-ANRIL 组的细胞活力显著低于 Si-NC 组(P<0.01),见图 2C。Western blot 分析结果显示,沉默LncRNA-ANRIL后可明显下调促淋巴管新生因子VEGF-C 的蛋白表达,见图2D。
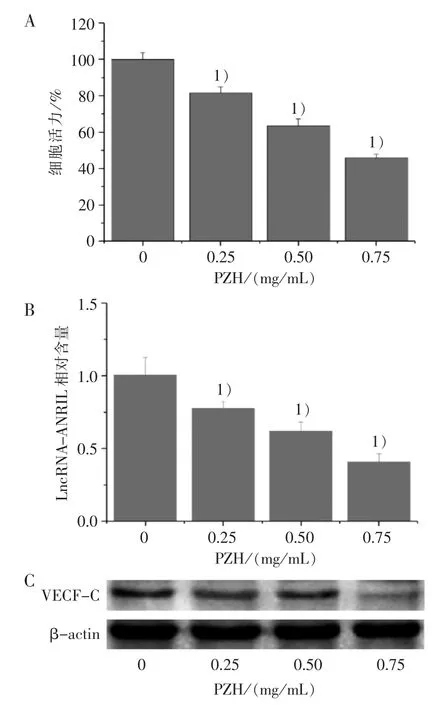
图 1 PZH 抑制 HCT-116 细胞活力、LncRNA-ANRIL 和VEGF-C 蛋白的表达Figure 1 PZH inhibited proliferation of HCT-116 cells,and expression of LncRNA-ANRIL and VEGF-C
3.3 PZH 对 LncRNA-ANRIL 介 导 的 HLEC 活力的影响
HLEC 培养于 TSNs 中,CCK-8 实验结果显示:与 Si-NC 组比较,Si-ANRIL 组和 Si-NC+PZH 组的细胞活力显著降低(P<0.01),2 组抑制率分别为(8.07±1.89)%和(10.87±4.10)%,见图 3。
3.4 PZH 对 LncRNA-ANRIL 介 导 HLEC 迁 移能力的影响
HLEC 培养于TSNs 中,迁移实验结果显示:与Si-NC 组比较,Si-ANRIL 组 和 Si-NC+PZH 组的迁移数量显著减少,2 组的迁移率分别为(83.06±3.70)%、(71.77±8.50)%,见图 4。
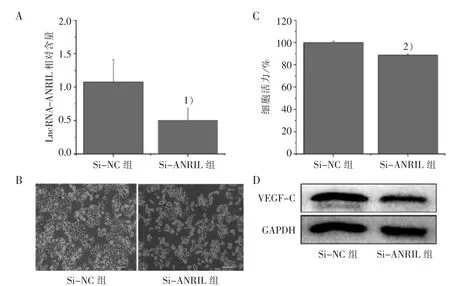
图2 LncRNA-ANRIL 沉默抑制HCT-116 细胞活力及VEGF-C 蛋白表达(×200)Figure 2 Silencing LncRNA-ANRIL inhibits cell viability and protein expression of VEGF-C in HCT-116 cells (×200)
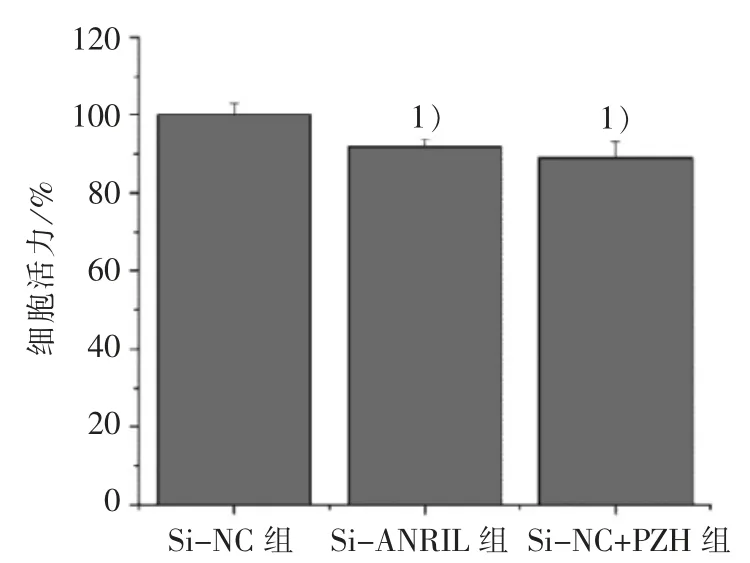
图3 PZH 对LncRNA-ANRIL 介导的HLEC 活力的影响Figure 3 Effect of PZH on LncRNA-ANRIL mediated HLEC viability
3.5 PZH 对 LncRNA-ANRIL 介导 HLEC 侵袭能力的影响
HLEC 培养于TSNs 中,侵袭实验结果显示:与Si-NC 组比较,Si-ANRIL 组和 Si-NC+PZH 组的侵袭数量显著减少(P<0.01),分别为(67.39±5.75)%和(57.25±1.26)%,见图 5。
3.6 PZH 对 LncRNA-ANRIL 介导 HLEC 管腔形成能力的影响
HLEC 培养于TSNs 中,管腔形成实验结果显示:与 Si-NC 组比较,Si-ANRIL 组和 Si-NC+PZH 组的管腔形成数量显著减少(P<0.01),见图6。
4 讨 论
大肠癌作为我国发病率第4 位、死亡率第5 位的恶性肿瘤,每年发病例数约28.2 万,每年死亡病例约 13.61 万,严重危害国人生命健康[11]。以手术为主的综合治疗是目前大肠癌治疗的主要手段,但仍有50%的患者在根治术5 年内发生转移和复发[12],其中淋巴结转移是大肠癌最常见和最早出现的转移方式,而淋巴管新生是其淋巴结转移及其复发的主要因素和机制[2]。 淋巴管新生主要指在某些病理状态时,淋巴内皮细胞受趋化因子作用而迁移至局部组织,然后在内皮生长因子作用下增殖形成新的淋巴管,包括淋巴内皮细胞迁移、增殖和管腔形成等过程[4,13]。
LncRNA-ANRIL 与肿瘤的发生、发展及转移密切相关,在肿瘤增殖、侵袭和迁移过程中发挥重要作用,其可通过上调VEGF-C 的表达促进大肠癌淋巴管新生,从而导致大肠癌淋巴管转移[14-15]。如SUN等[3]研究发现LncRNA-ANRIL 在大肠癌中高表达,且其增高与淋巴结转移及预后不良密切相关;通过慢病毒转染下调LoVo 和HCT116 中ANRIL 的高表达,发现细胞迁移和侵袭活性明显降低,同时也可以抑制人淋巴内皮细胞的管腔形成能力和侵袭能力;此外,在小鼠模型中,ANRIL 下调后,肿瘤生长率和肿瘤大小降低,淋巴结转移率降低,LMVD 和VEGF-C、VEGFR-3 和 LYVE-1 的表达。 结果表明下调LncRNA-ANRIL 可抑制大肠癌淋巴管生成和转移。
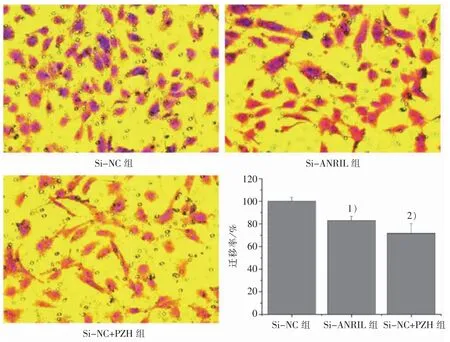
图4 PZH 对LncRNA-ANRIL 介导HLEC 迁移能力的影响(×200)Figure 4 Effect of PZH on LncRNA-ANRIL mediated migration in HLEC (×200)
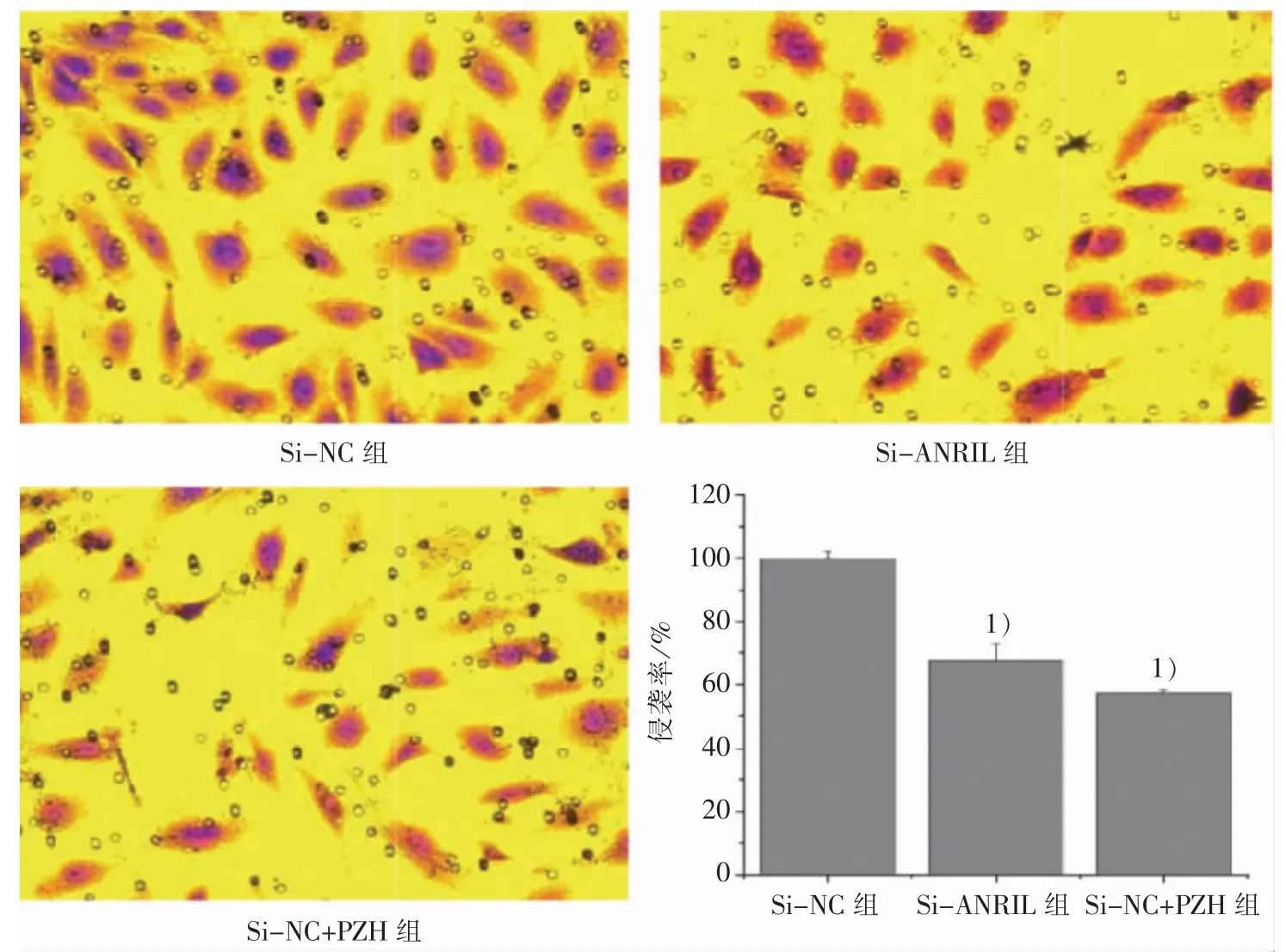
图5 PZH 对LncRNA-ANRIL 介导HLEC 侵袭能力的影响(×200)Figure 5 Effect of PZH on LncRNA-ANRIL mediated invasion in HLEC (×200)
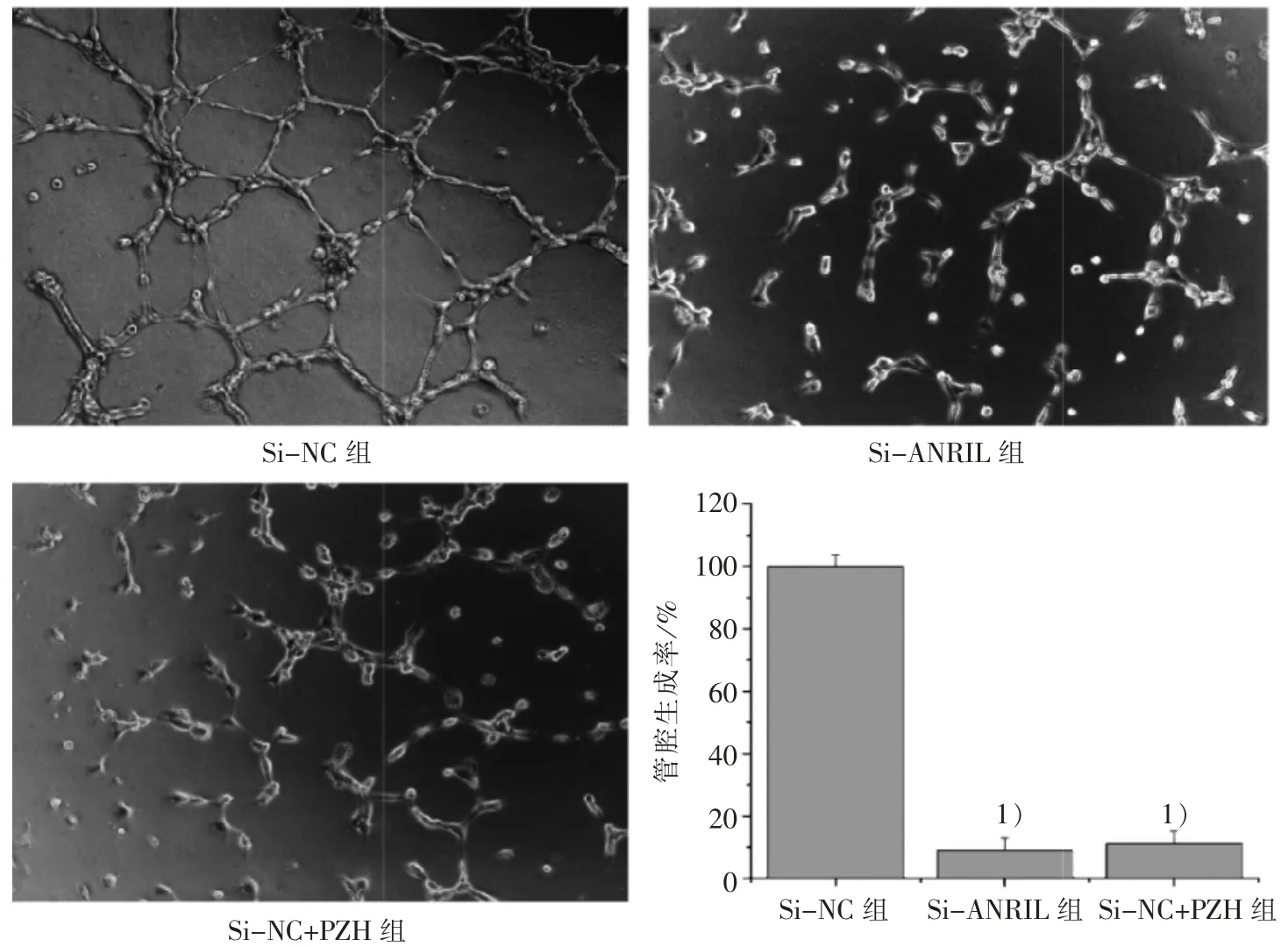
图6 PZH 对LncRNA-ANRIL 介导HLEC 管腔形成能力的影响(×200)Figure 6 Effect of PZH on LncRNA-ANRIL mediated tube formation in HLEC (×200)
随着我国现代化诊疗技术的飞速发展,针对恶性肿瘤的放化疗和分子靶向药物已广泛应用于临床,但是近年来其耐药和毒副作用也日益显现,因此临床疗效确切、毒副作用小的中药复方逐渐受到国内外研究者的重视[16]。 PZH 是由三七、牛黄、蛇胆、麝香等多种名贵中药材精制而成的复方制剂,具有清热解毒、消肿散结、活血化瘀、扶正祛邪的功效;在治疗大肠癌等恶性肿瘤方面有明确的疗效,且无明显的毒副作用[4,9-10]。本课题组前期实验研究发现PZH 可通过抑制VEGF-C信号通路抑制大肠癌淋巴管新生,然而PZH 在抑制大肠癌淋巴管新生方面的具体作用机制尚未明确。
本研究中我们用不同浓度的PZH 干预大肠癌细胞 HCT-116,MTT 实验表明 PZH 可抑制 HCT-116 细胞的活力,RT-qPCR 显示 PZH 可显著下调LncRNA-ANRIL 的表达,Western blot 检测结果表明PZH 可抑制HCT-116 细胞中促淋巴管新生关键因子VEGF-C 蛋白的表达,以上结果提示PZH 抗肿瘤淋巴管新生可能与调控LncRNA-ANRIL 和VEGF-C的表达相关。 进一步通过观察HCT-116 细胞LncRNA-ANRIL 沉默后对其细胞活力、形态及对促淋巴管新生关键因子VEGF-C 蛋白表达的影响,结果显示LncRNA-ANRIL 沉默后可显著降低HCT-116 细胞密度、活力及VEGF-C 蛋白表达,证实了LncRNA-ANRIL 对VEGF-C 表达的调控作用。在此基础上我们又收集了HCT116 细胞LncRNA-ANRIL 沉默和加入PZH 后的TSNs 对HLEC进行干预培养,并观察其对HLEC 活力、迁移能力、侵袭能力和管腔形成能力的影响。 研究结果显示:与Si-NC 组比较,Si-ANRIL 组和 Si-NC+PZH 组显著抑制了HLEC 的活力、迁移和侵袭、管腔形成能力,表明PZH 具有抑制LncRNA-ANRIL 介导大肠癌淋巴管新生的作用。 综上所述,PZH 抑制大肠癌淋巴结转移的机制,与其抑制LncRNA-ANRIL 表达进而降低VEGF-C 表达,从而抑制大肠癌淋巴管新生有关。
——淋巴管系统

