原发性肝癌患者超声造影定量灌注参数与分化程度及微血管密度的关系
汪 玲,陆英慧,王天佑
1)驻马店市中心医院超声科 河南驻马店 463000 2)郑州大学第一附属医院超声科 郑州 450052
原发性肝癌(primary hepatocellular carcinoma,PHC)发病率位居恶性肿瘤前列,侵袭性强,预后差。已证实[1]肝脏恶性肿瘤侵袭性生长、转移与肿瘤内新生血管生成有关。肿瘤微血管密度(microvessel density,MVD)是评估血管生成及癌细胞转移、复发的指标,MVD定量信息多通过术后病理标本免疫组化染色获取,有创,操作复杂[2]。目前寻求快捷、无创、可重复性好的评估肿瘤血管生成的方法已成为研究者关注的重点。超声是肝脏疾病影像学筛查的首选手段,但二维灰阶超声仅可获取形态学信息,无法获取肿瘤供血及血管信息;彩色多普勒超声及能量多普勒超声可明确肝脏结节血流动力学信息,但受探测深度、血液流速、穿透力、仪器敏感性等影响[3]。而超声造影(contrast-enhanced ultrasound,CEUS)配合Sono Vue新型造影剂可强化血液超声信号,获取微循环分布信息,清晰显示肝脏血流灌注情况,通过时间-强度曲线(time-intensity curve,TIC)可定量评估组织微循环、血流灌注。但对CEUS血流灌注参数与病灶分化程度及MVD的关系尚未见报道。为明确CEUS血流灌注参数评估PHC的价值,我们对120例PHC患者CEUS影像学资料进行了回顾性分析,并与术后病理分化判定结果和MVD进行对照,旨在了解CEUS定量评价PHC血流灌注的价值,为PHC诊疗提供依据。
1 对象与方法
1.1研究对象收集2016年3月至2019年1月于驻马店市中心医院行CEUS检查的120例PHC患者的临床资料。纳入标准:超声筛查存在肝脏肿物,距皮肤位置<8.0 cm,不与心脏、膈肌或大血管相邻;术前未接受介入治疗或其他抗肿瘤治疗;术后病理证实为PHC;能顺利完成CEUS检查,无禁忌;临床及影像学资料完善。排除标准:心、肺、肾器质性功能障碍;其他恶性肿瘤。其中男78例,女42例;年龄37~78岁;120例患者共149个病灶,病灶直径1.5~9.6(4.8±1.2) cm;单发结节101例,多发结节19例。
1.2超声检查方法采用美国GE LOGIQ9彩色多普勒超声诊断仪,4C造影探头,探头频率2.0~4.0 MHz,反向脉冲谐波显像(pulse inversion harmonic imaging,PIH)模式,内置低机械指数(0.1~0.6),自动追踪增强定量分析软件进行声学定量TIC分析。采用意大利米兰Bracco SPA公司Sono Vue造影剂,以生理盐水5 mL溶解后配制成六氟化硫(sulfur hexafluoride 6,SF6)微泡混悬液,每次造影剂量2.4 mL(SF6质量浓度5 g/L)。检查时患者仰卧位,先行二维超声扫描全肝,标记可疑病灶位置、大小、数目、形态、内部回声,界定病灶大小、液化坏死范围;以彩色多普勒成像及能量多普勒成像获取病灶内部血供情况;选取最佳切面,切换至CEUS模式,经肘静脉快速注入造影剂2.4 mL,用5 mL生理盐水冲洗,进入造影状态,连续观察6 min,实时动态存储并存盘。造影完毕后,启动软件,取样框放置于病灶中心或回声增强最明显区域,获取TIC,记录始增时间(造影剂病灶内出现时间)、达峰时间(TIC曲线顶峰对应时间)、始退时间(回声强度低于周围肝组织时间)、增强时间(达峰时间-始增时间)、廓清时间(始退时间-达峰时间)、始增强度(造影剂病灶内出现时增强强度)、峰值强度(TIC曲线峰值对应增强强度),参照文献[4]计算平均血流密度(mean blood flow density,MFD,MFD为增强面积与肿瘤有效面积比值,计算3次,取均值)。并根据动脉相早期PHC肿瘤血管形态、分布情况、强化特点等对血管灌注显像进行分型[5]。蛛网样:多个分支自中央或周边侵入病灶内,血管扭曲变形、粗细不均,呈枯树枝状,呈网状快速弥散;放射样:造影剂自病灶中心呈环状迅速向周边填充,周边及内部未见扭曲血管;混合型:蛛网样、放射样同时存在。
1.3分化程度及MVD测定将手术切除的PHC组织常规制片。将标本切片,脱蜡水化, PBS冲洗3次×5 min,微波热抗原修复,山羊血清封闭,滴入鼠抗人α-SMA单克隆抗体50 μL,4 ℃孵育过夜,滴加生物素标记二抗,洗涤后滴加50 μL辣根酶标记链霉卵白素工作液,洗涤后,显色剂显色,苏木素复染,脱水,中性树胶封片,镜下观察染色结果,阳性染色呈棕黄色。MVD测定:40倍光镜下取3个血管高密度区,再于400倍镜下计数阳性染色血管数,取3个视野均值作为MVD值。按照Edmondson-Steiner分级法[6]判定分化程度。
1.4统计学处理采用SPSS 21.0进行数据分析。不同分化程度PHC CEUS血流灌注参数的比较、不同灌注模式PHC患者MVD的比较均采用单因素方差分析及LSD-t检验;不同分化程度PHC动脉相造影剂灌注模式的比较采用χ2检验;各血流灌注参数与MVD的关系采用Pearson相关进行分析。检验水准α=0.05。
2 结果
2.1PHC患者CEUS灌注特点120例PHC患者共149个病灶动脉相呈高强化特点,其中107个病灶呈均匀高强化,8个病灶呈周围高强化,34个病灶呈不均匀高强化特点;门静脉相138个病灶呈低强化特点,11个病灶呈等强化;延迟相149个病灶均呈低强化特点,其中30个病灶动脉相呈高强化表现,门静脉相、延迟相呈低强化特点。
2.2不同分化程度PHC病灶动脉相CEUS血流灌注参数比较术后病理确定高分化病灶49个,中分化54个,低分化46个。低分化组、中分化组增强时间、始退时间、廓清时间均短于高分化组,MFD高于高分化组;低分化组增强时间、始退时间、廓清时间短于中分化组,MFD高于中分化组,见表1。
2.3不同分化程度PHC病灶动脉相造影剂灌注模式对比高分化PHC动脉相以放射样灌注模式为主,中分化以混合样为主,低分化以蛛网样为主,见表2。
2.4不同动脉相造影灌注模式PHC病灶MVD比较混合样、放射样MVD分别为(51.03±8.65)、(42.15±7.97),低于蛛网样灌注模式的(65.41±12.36)(F=54.482,P<0.001),放射样的MVD又低于混合样(P<0.05)。
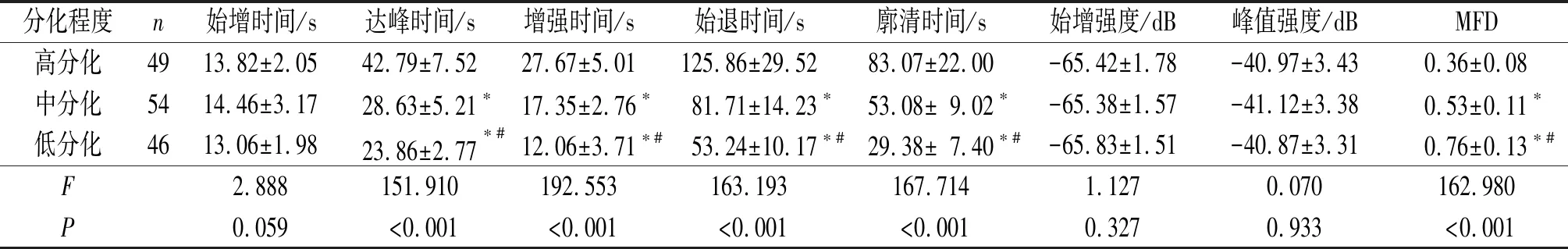
表1 不同病理分化程度PHC动脉相CEUS血流灌注参数比较

表2 不同分化程度PHC动脉相造影剂灌注模式对比 例
2.5PHC病灶动脉相血流灌注参数与MVD的相关性分析见表3。可知,MFD与MVD呈正相关,增强时间、达峰时间、廓清时间均与MVD呈负相关。
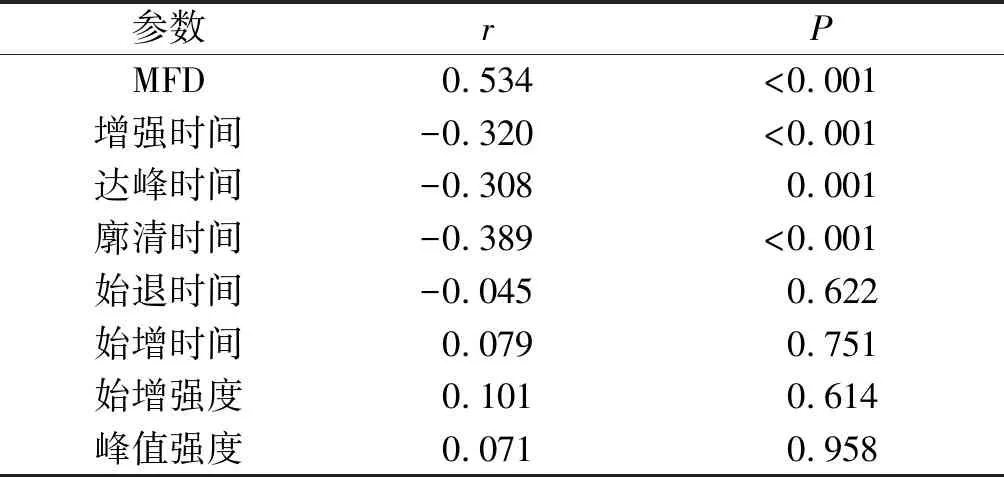
表3 PHC动脉相血流灌注参数与MVD相关性分析结果 (n=149)
3 讨论
肿瘤新生血管是维持癌细胞营养物质摄取、促进其增殖、诱导癌细胞转移的前提。血管新生诱导的血流动力学变化,不仅为恶性肿瘤影像学的改变提供了形态学依据,同时也为血流动力学功能性成像奠定基础[7]。一般认为肿瘤血管生成因子活性越高,新生血管越多,进入微泡数量越多,所产生回声信号越多,造影血流信号显示越丰富[8-9]。目前CEUS对肝脏病变定性诊断已相对成熟,但对PHC的CEUS血流灌注定量参数与病理特点的关系报道较少。PHC血供多来源于肝动脉,是CEUS动脉期均匀增强的理论基础。本研究发现动脉相107/149个PHC病灶均呈均匀快速高增强特点,病理提示癌细胞纤维化、坏死及透明性变形;8/149个病灶呈周边高强化,病理提示内部大面积坏死或纤维化;而门静脉相、延迟相大部分病灶均呈低强化特点;原因为PHC主要由肝动脉供血,门静脉较少参与供血,非坏死性低密度区由膈下动脉、肠系膜上动脉侧支循环供血,血管少,示踪剂难以进入。
在定量血流灌注参数方面,本研究发现不同分化程度PHC病灶的达峰时间、增强时间、始退时间、廓清时间存在差异,低分化PHC达峰时间、增强时间、始退时间、廓清时间均较短,中分化次之,高分化最长,其中低、中分化PHC“快进快出”特点较为突出,而高分化PHC“快进慢出”特征更明显,与尹珊珊等[10]研究结果相同。分析原因主要为:分化程度差、增殖速度较快的PHC血供来源于肝动脉,新生血管快速在肿瘤内部形成微血管网,肿瘤直接侵袭血管壁形成动静脉瘘,导致血液流速增加,廓清速度加快,呈现快进快出特点;而高分化PHC多由肝动脉、门静脉双重供血,造影剂微泡自门静脉持续进入肿瘤,同时高分化PHC含大量Kupffer细胞可吞噬微泡,导致微泡滞留肿瘤内部时间延长[11]。此外,我们以MFD作为CEUS监测微血管的指标,反映癌灶对血供的需求,一般恶性程度越高,肿瘤增长及增殖速度越快,所需血供增加,单位体积内血管数量(即MFD)越多,CEUS增强越明显。研究结果显示:低分化、中分化PHC MFD高于高分化病灶,低分化病灶又高于中分化病灶,分析可能是因为低、中分化PHC癌细胞增殖活跃,侵袭性高,新生血管活性高,肿瘤单位面积内微血管数量增多,管腔增大,MFD上升;而中高分化PHC增殖活性较低分化低,故MFD较低分化PHC低。
同时我们还发现,低分化PHC CEUS动脉相造影灌注模式以蛛网样为主,中分化以混合样为主,低分化以放射样为主,提示PHC血管造影灌注模式特点与分化程度相关,反映了PHC生长、侵袭模式[12]。随着PHC分化程度的降低,肿瘤微血管构筑类型发生改变,侵袭性上升,单位体积内微血管数量上升,血管通透性提升,血流速度加快,主要分布于癌灶周边及被膜下侧,故呈蛛网样分布。进一步分析发现,蛛网样灌注模式PHC MVD较高,其次为混合样与放射状,与病理特点呈现较强的相关性,即分化程度越低,新生血管生成越多,血管密度增加。相关性分析发现,PHC患者CEUS参数MFD与MVD呈正相关,增强时间、达峰时间、廓清时间均与MVD呈负相关,提示PHC定量血流灌注参数可反映肿瘤微血管形成状况,可成为评估PHC血管生成的有效指标。
综上所述,PHC CEUS血流灌注参数与病理特点存在密切关系,而随着CEUS技术的不断进步,CEUS有望与免疫组化病理学筛查结合作为活体PHC血管生成评估的新依据。