苦参素对实验性自身免疫性脑脊髓炎大鼠脑内缝隙连接蛋白Cx43和Cx32表达的影响
楚尧娟,马雯迪,王梦茹,豆萌萌,杜书章,朱 琳
郑州大学第一附属医院药学部 郑州 450052
多发性硬化(multiple sclerosis,MS)是一种以中枢神经系统炎性脱髓鞘为特点的自身免疫性疾病,以完全或部分可逆性神经功能障碍为主要特征,具有空间多发性和时间多发性。目前MS是不可治愈的,虽然已有10多种药物可以降低MS的复发频率和严重程度,但是没有药物能够完全预防或逆转MS渐进性的神经系统退行性病变[1]。由于缺乏特异性治疗手段,该病给患者及其家庭、医疗系统和社会带来了沉重的负担[2],因此迫切需要探索更为有效的MS治疗方法。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是目前公认的研究MS的经典动物模型[3]。有研究[4]证实缝隙连接(gap junction,GJ)在EAE损伤中起重要作用,缝隙连接蛋白(connexin,Cx)是GJ的构成蛋白,其中Cx43主要分布在星形胶质细胞,Cx32主要分布在少突胶质细胞[5]。
苦参素又名氧化苦参碱,是从苦参、广豆根等豆科槐属植物中提取的天然化合物,具有抗炎、免疫调节、抗病毒、抗肿瘤等药理作用[6],且不良反应较少,在临床上具有明确的应用价值。课题组前期研究[7-8]发现苦参素能明显改善EAE小鼠的临床症状,对EAE具有一定的防治作用。本研究通过观察苦参素对EAE大鼠脑内Cx43、Cx32表达的影响,探讨苦参素防治EAE的作用机制,为MS的治疗提供新的靶点和实验依据。
1 材料与方法
1.1药品、试剂与仪器苦参素注射液(批号160919204,规格2 mL,0.6 g/支,以氧化苦参碱计)购自江苏正大天晴药业股份有限公司。完全弗氏佐剂(美国Sigma公司),卡介苗(北京生物制品研究所),兔抗鼠Cx43、Cx32荧光一抗(美国Abcam公司),羊抗兔Cy3荧光二抗(武汉三鹰生物工程有限责任公司),浓缩型DAPI显色试剂盒(北京赛驰生物技术有限公司),苏木精(北京索莱宝公司),伊红(上海试剂一厂),激光共聚焦显微镜(日本Olympus株式会社)。
1.2实验动物分组、造模及给药健康雌性Wistar大鼠40只,SPF级,6~8周龄,体重180~200 g(动物批号:37009200001109);健康雌性豚鼠10只,体重300~350 g[动物批号:SCXK(鲁)20130001];均购自济南朋悦实验动物繁育有限公司。参照文献[9]提供的方法制备豚鼠全脊髓匀浆,与等体积含有1 g/L结核分枝杆菌的完全弗氏佐剂混合,制成稳定的油包水型抗原乳剂。采用随机数字表法将40只大鼠分为正常组、模型组、苦参素治疗组、苦参素预防组,每组10只。模型组、苦参素治疗组和预防组大鼠用体积分数10%水合氯醛(3 mL/kg)麻醉后,分4点在四肢足垫皮下注射抗原乳剂(0.5 mL/只),诱导EAE模型。苦参素预防组于免疫后第1天起腹腔注射苦参素注射液250 mg/kg,1次/d;苦参素治疗组于免疫后第11天起腹腔注射苦参素注射液250 mg/kg,1次/d;正常组和模型组于免疫后第1天起腹腔注射等体积生理盐水,1次/d。
1.3神经功能评分大鼠免疫后每天由两名实验人员分别记录神经功能评分,采用5分评分法[10]:0分,无任何临床症状;1分,尾部无力;2分,后肢无力;3分,尾部及双后肢瘫痪;4分,四肢均瘫痪;5分,濒死状态或死亡。神经功能评分达到或超过1分,判断为EAE发病。
1.4脑组织病理学检查免疫后第18天,用100 g/L水合氯醛(3 mL/kg)麻醉大鼠后,用预冷的生理盐水进行心脏灌注,直至右心耳流出的液体变透明,肝脏变为土白色,然后分离全脑,放入40 g/L多聚甲醛中固定24 h,梯度乙醇脱水,浸入二甲苯3 h,石蜡包埋,制成5 μm厚的组织切片。40 ℃水中铺片后,置于45 ℃温箱烘烤,去除水分后4 ℃保存备用。组织切片分别进行勒克斯光蓝(LFB)和HE染色,于光学显微镜下观察染色结果,并参照以下评分标准[11]进行评分。HE染色:0分,无炎性细胞;1分,存在少量炎性细胞;2分,存在大量炎性细胞聚集;3分,存在大量血管袖套样病变。LFB染色:0分,无髓鞘脱失情况;1分,1个小范围髓鞘脱失;2分,存在2~3个小范围髓鞘脱失;3分,1~2个大范围髓鞘脱失;4分,广泛存在大范围髓鞘脱失。
1.5免疫荧光单标法检测脑组织Cx43、Cx32蛋白的表达取石蜡组织切片,PBS冲洗5 min×3次,柠檬酸抗原修复10 min,PBS冲洗5 min×3次,体积分数3%H2O2封闭内源性过氧化物酶20 min,PBS冲洗5 min×3次,滴加山羊血清50 μL封闭内源性生物素20 min,甩掉血清后,滴加荧光一抗(按1∶200稀释),50 μL/片,4 ℃过夜,PBS冲洗5 min×3次,滴加荧光二抗50 μL/片,37 ℃反应2 h,PBS冲洗5 min×3次。切片脱水至透明后封片,荧光显微镜下观察染色结果并采集图像,用Image Pro Plus 6.0对蛋白表达情况进行定量分析。
1.6统计学处理采用SPSS 23.0进行数据分析,应用重复测量数据的方差分析比较各组大鼠神经功能评分的变化,应用单因素方差分析和LSD-t检验比较各组大鼠炎症浸润、髄鞘脱失评分和脑组织中Cx43、Cx32蛋白表达的变化。检验水准α=0.05。
2 结果
2.1各组大鼠神经功能状况的比较结果见表1。参与造模的大鼠均表现出EAE疾病发展进程,神经功能评分增加(P<0.05);与模型组比较,苦参素预防组和治疗组大鼠的神经功能评分均降低(P<0.05),且苦参素预防组表现出的发病延迟和症状缓解情况优于治疗组,预防组和治疗组大鼠的神经功能评分差异有统计学意义(P<0.05)。
2.2各组大鼠脑组织病理学表现LFB和HE染色结果(图1,表2)显示,正常组大鼠脑组织髓鞘完整,几乎无炎性细胞浸润,无空泡状改变;模型组大鼠脑组织出现了大小不等的脱髓鞘区域,有大量的炎性细胞浸润,并且出现空泡状改变;苦参素预防组和治疗组大鼠脑组织髓鞘脱失和炎性细胞浸润情况较模型组明显减轻。与模型组相比,苦参素预防组与治疗组的组织病理学评分均降低;与苦参素治疗组相比,预防组的组织病理学评分降低。
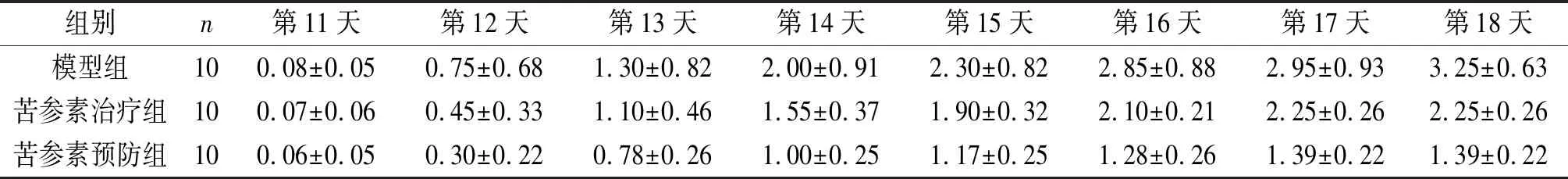
表1 各组大鼠神经功能评分的比较
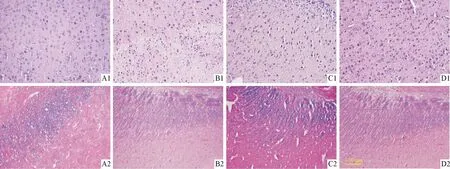
A:正常组;B:模型组;C:苦参素治疗组;D:苦参素预防组;1:LFB染色;2:HE染色
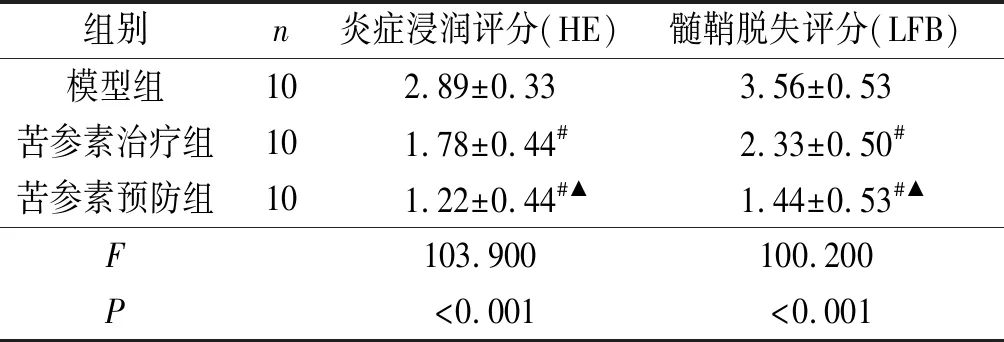
表2 各组大鼠脑组织病理学表现的比较
2.3各组大鼠脑组织中Cx43、Cx32蛋白表达的比较免疫荧光单标染色结果(图2,表3)显示,与正常组比较,模型组大鼠脑组织中Cx43蛋白表达水平升高,Cx32蛋白表达水平降低;与模型组相比,苦参素预防组与治疗组大鼠Cx43蛋白表达水平降低,Cx32蛋白表达水平升高;苦参素预防组Cx43蛋白表达水平低于治疗组,而Cx32蛋白表达水平高于治疗组。
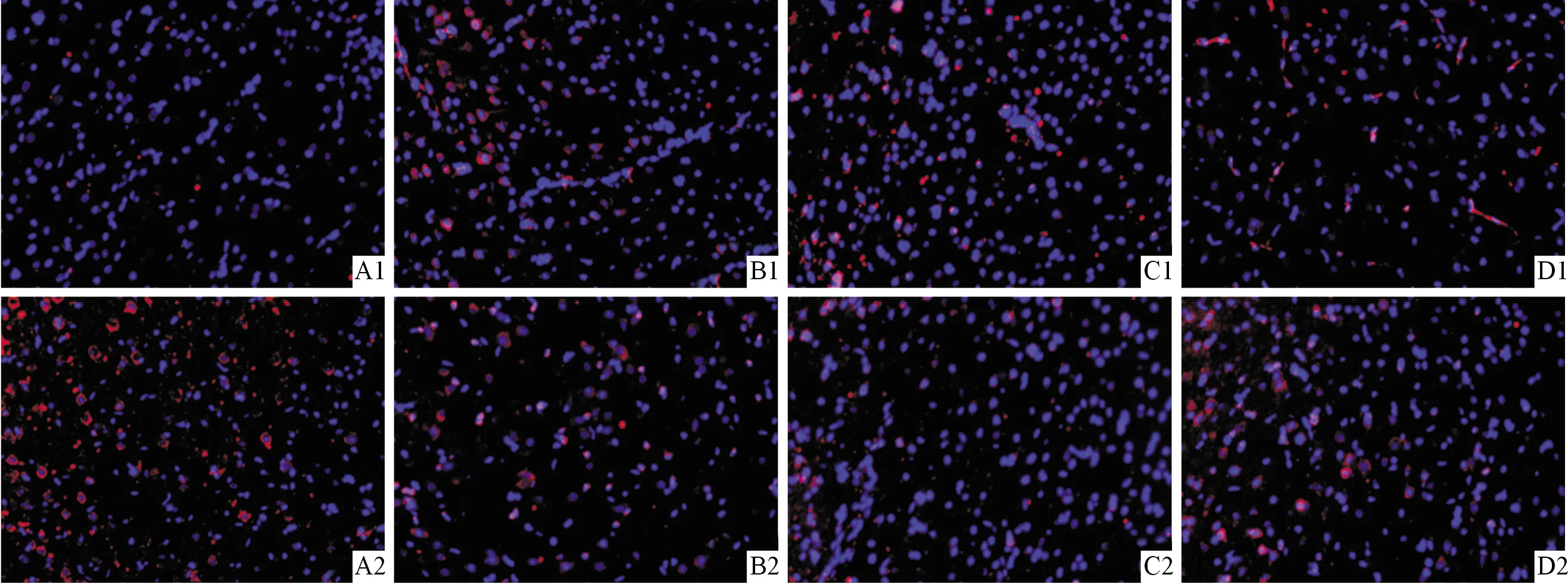
A:正常组;B:模型组;C:苦参素治疗组;D:苦参素预防组;1:Cx43;2:Cx32

表3 各组大鼠脑组织中Cx43、Cx32蛋白表达的比较
3 讨论
GJ是相邻细胞膜对应面上一对接合体构成的通道,是细胞间唯一能直接交换物质和信息的通道,主要功能是通过电偶联和代谢偶联两种方式,介导细胞间电和化学信号的传递,允许离子(Ca2+、Na+、K+)、谷氨酸(Glu)、谷胱甘肽、环单磷酸腺苷(cAMP)、三磷酸肌醇(IP3)、ATP等小分子通过[12],在细胞新陈代谢、增殖和分化、转运能量、维持组织内环境稳定[13]等多个方面具有重要作用。GJ的开闭受多种因素调控,如pH值、Ca2+浓度、膜电位、生长因子和蛋白激酶数量等[14];病理情况下,如脑缺血、炎症、细胞外低钙时,GJ开放增多,可引起静息膜电位紊乱、ATP和Glu等有害物质释放、水分摄取增加,从而导致细胞水肿破裂等[15]。有研究[4]发现,EAE发生后GJ开放增多,提示GJ在神经元和髓鞘损伤中起关键作用。Cx是GJ的构成蛋白,EAE发生后,Cx43表达增加,Cx32表达降低[16],对Cx功能的进一步研究,有可能对MS的预防和治疗提供一个新的方向。
本课题组前期研究[17]发现,苦参素能升高Wistar大鼠血清中IL-4、IL-5和IL-10等细胞因子的表达,提示苦参素可能通过调节免疫发挥防治EAE的作用。Kan等[10]发现苦参素能通过抑制Nogo-A诱导的神经再生抑制通路而促进受损髓鞘的再生。最新研究[18]发现,苦参素能抑制EAE大鼠脑中星形胶质细胞增生。星形胶质细胞的GJ对维持神经元内环境的稳定具有重要作用。Cx43是星形胶质细胞中含量最多的Cx,由Cx43组成的GJ可调控细胞内外Glu、ATP、K+、H+浓度、转运能量和代谢物质、介导自分泌和旁分泌信号[19]。Cx43主要与星形胶质细胞激活/增生有关[20]。Cx32主要表达在少突胶质细胞上,在维持髓鞘的结构和功能中起关键作用,主要与脱髓鞘损伤程度有关[20],敲除Cx32会导致轴突水肿和严重的脱髓鞘[21]。本研究结果显示,与正常组相比,模型组大鼠脑组织中Cx43的表达水平升高,而Cx32的表达降低,这与Markoullis等[16]的研究结果一致。经过苦参素治疗和预防后,EAE大鼠神经功能评分降低,组织病理学的结果也与其一致,炎性细胞浸润、脱髓鞘现象明显减少。脑组织中Cx43表达降低,而Cx32的表达升高,提示苦参素可能通过抑制Cx43的表达,改善星形胶质细胞GJ的功能,减少Glu、ATP等毒性物质的释放;同时通过上调Cx32的表达,减轻轴突变性和脱髓鞘程度,进而减轻EAE的神经损伤。
综上所述,苦参素可能通过抑制缝隙连接蛋白Cx43和上调Cx32的表达,改善EAE的相关症状,减轻脑组织中的炎性浸润和脱髓鞘程度。