FHIT及Apollon蛋白在结直肠癌组织中的表达特征及预后预测价值
徐纪中,袁维堂,王贵宪,周全博,胡晟云
郑州大学第一附属医院结直肠肛门外科 郑州 450052
结直肠癌(colorectal cancer,CRC)是临床常见消化道恶性肿瘤。据调查[1],世界范围内CRC每年新发病例约800万,发病率和死亡率均位居恶性肿瘤前列,近年来随着人们生活节奏的加快及饮食结构的改变,其发病率呈逐年升高趋势。CRC起病隐匿,早期症状不典型,故多数患者确诊时已至局部晚期或发生远处转移,尤其以肝转移最为常见,导致根治术、放化疗效果不理想,预后较差[2]。随着分子生物学研究的进展,人们发现抑癌基因失活及凋亡抑制基因过度表达在恶性肿瘤发生、发展及转移过程中起重要作用。脆性组氨酸三联体(fragile histidine triad,FHIT)基因是一种包含人类染色体脆性位点的抑癌基因,目前已有报道[3]其在肺癌、胃癌等多种恶性肿瘤组织中异常表达。另有研究[4]表明,凋亡抑制蛋白Apollon过度表达可促进细胞的恶性变。FHIT和Apollon蛋白在肿瘤发生、发展过程中均起重要作用,但关于其对CRC转移病程影响的研究尚少。本研究对既往收治的163例CRC患者的临床资料进行回顾,分析FHIT和Apollon蛋白在CRC组织中的表达情况,重点探讨其与CRC转移及预后的关系。
1 对象与方法
1.1研究对象回顾性分析2012年7月至2014年6月我院收治的163例CRC患者的临床资料。其中男84例,女79例;年龄35~71(58.7±6.2)岁;肿瘤部位:结肠138例,直肠25例;肿瘤直径≤5 cm者92例,>5 cm者71例;分化程度:高分化72例,中分化59例,低分化32例;浸润深度:肌层65例,浆膜外60例,浆膜层38例;Dukes分期:A、B期46例,C、D期117例;组织学分型:管状/乳头状腺癌118例,黏液腺癌30例,印戒细胞癌15例;有淋巴结转移117例;有同时性结直肠癌肝转移(SCRLM)93例,无SCRLM 70例。研究获得医院伦理委员会审批。
CRC患者均符合以下纳排标准。纳入标准:①接受CRC根治术治疗。②术后病理检测确诊为CRC,SCRLM经病理学检查肝转移灶来源于CRC。③术前均未进行化疗。④临床资料完整。排除标准:①合并其他部位原发性恶性肿瘤。②术后随访资料缺失。③有严重贫血、感染或凝血功能障碍。
1.2FHIT及Apollon蛋白表达的检测收集CRC癌组织、癌旁组织(距离病灶<3 cm,非正常组织),均采用体积分数10%中性甲醛固定,修整为1 cm3组织块,经梯度乙醇脱水、二甲苯固定后,石蜡包埋,制作4 μm厚连续切片。切片经二甲苯脱蜡、梯度乙醇水化、热修复后,用体积分数3%过氧化氢孵育,PBS洗涤,封闭液封闭;每张切片加入1∶100稀释的兔抗人FHIT、Apollon多抗(北京中杉金桥生物技术有限公司)37 ℃孵育1 h,加入生物素标记的二抗继续孵育30 min;DAB显色,苏木精复染,中性树胶封片,光学显微镜下观察染色结果。FHIT蛋白定位于细胞质,Apollon蛋白定位于细胞质和(或)细胞核。采用双评分半定量分析法[5]判定蛋白表达情况。200倍镜下每张切片随机选取5个视野:按染色强度评分,无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞百分数评分,无阳性细胞为0分,≤10%为1分,≤50%且>10%为2分,≤75%且>50%为3分,>75%为4分。两项评分乘积≤1判定为阴性,≥2判定为阳性。
1.3资料的收集及分析收集CRC患者性别、年龄、肿瘤部位、分化程度等临床及病理资料。采用门诊或电话方式进行随访,以接受手术治疗为随访起始时间,以患者死亡、失访或研究截止时间(2019年7月)为终点事件,计算总生存时间。
1.4统计学处理采用SPSS 19.0分析处理数据。CRC及癌旁组织中FHIT、Apollon阳性率的比较采用配对χ2检验,不同临床病理特征CRC组织中FHIT、Apollon阳性率的比较采用χ2检验或精确概率法,采用列联系数c评估CRC组织中FHIT、Apollon表达的关联性;采用Kaplan-Meier法绘制不同FHIT、Apollon表达特征的CRC患者的生存曲线并进行log-rank检验;检验水准α=0.05。
2 结果
2.1CRC组织中FHIT及Apollon蛋白的表达CRC组织中,FHIT和Apollon蛋白阳性率分别为32.5%和84.7%,癌旁组织中分别为67.5%和48.5%。与癌旁组织比较,CRC组织中FHIT蛋白阳性率降低,Apollon蛋白阳性率升高,见表1、2。CRC组织中FHIT与Apollon蛋白表达存在负关联,见表3。
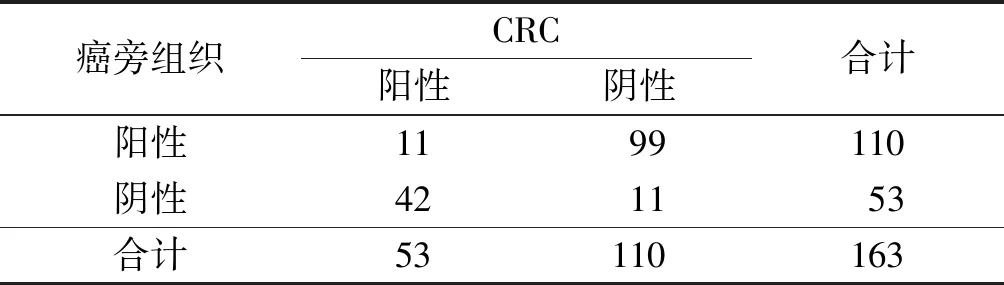
表1 CRC与癌旁组织中FHIT蛋白表达的比较 例

表2 CRC与癌旁组织中Apollon蛋白表达的比较 例
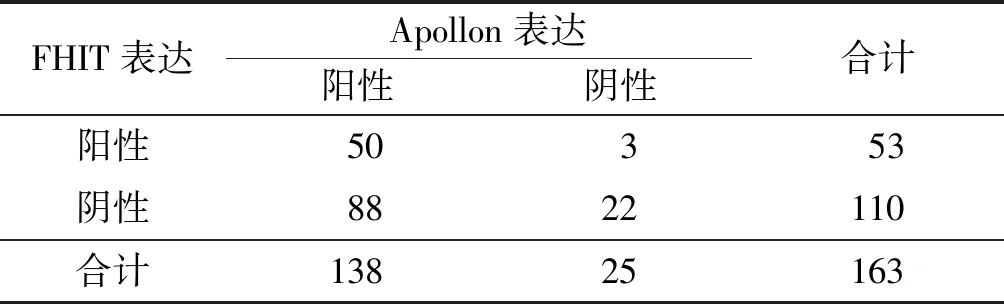
表3 CRC组织中FHIT与Apollon蛋白表达的关联性分析 例
2.2不同临床病理特征CRC组织中FHIT及Apollon蛋白表达的比较与浸润至肌层或浆膜外、Dukes分期A或B期、无淋巴结转移、无SCRLM者比较,浸润至浆膜层、Dukes分期C或D期、有淋巴结转移、有SCRLM的CRC组织中FHIT阳性率降低,Apollon阳性率升高(P<0.05);而不同性别、年龄、肿瘤部位、肿瘤直径、组织学分型、大便隐血试验状态、HBsAg状态及腹腔积液状态的患者FHIT、Apollon阳性率比较,差异均无统计学意义(P>0.05),见表4。
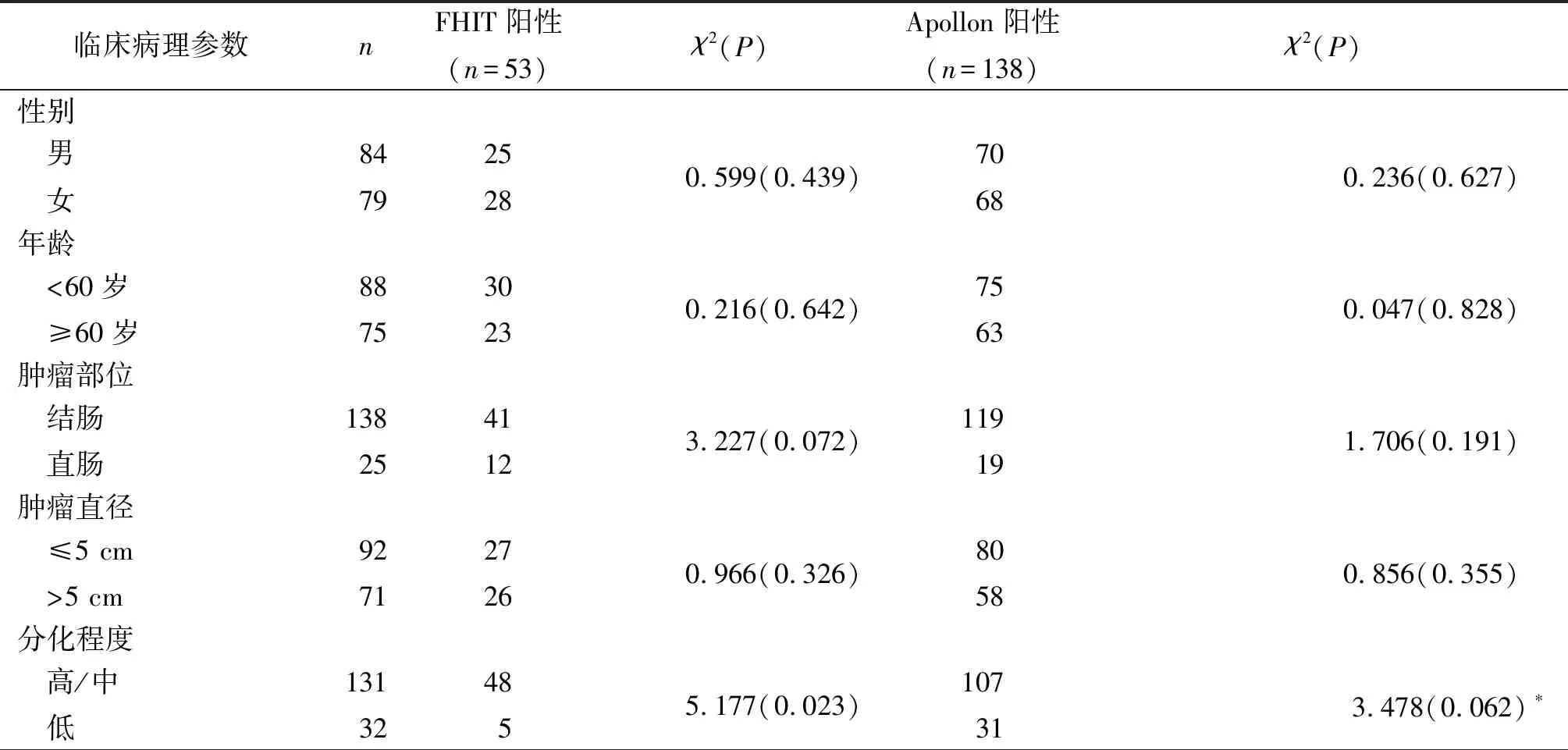
表4 不同临床病理参数CRC组织中FHIT及Apollon蛋白表达的比较 例(%)
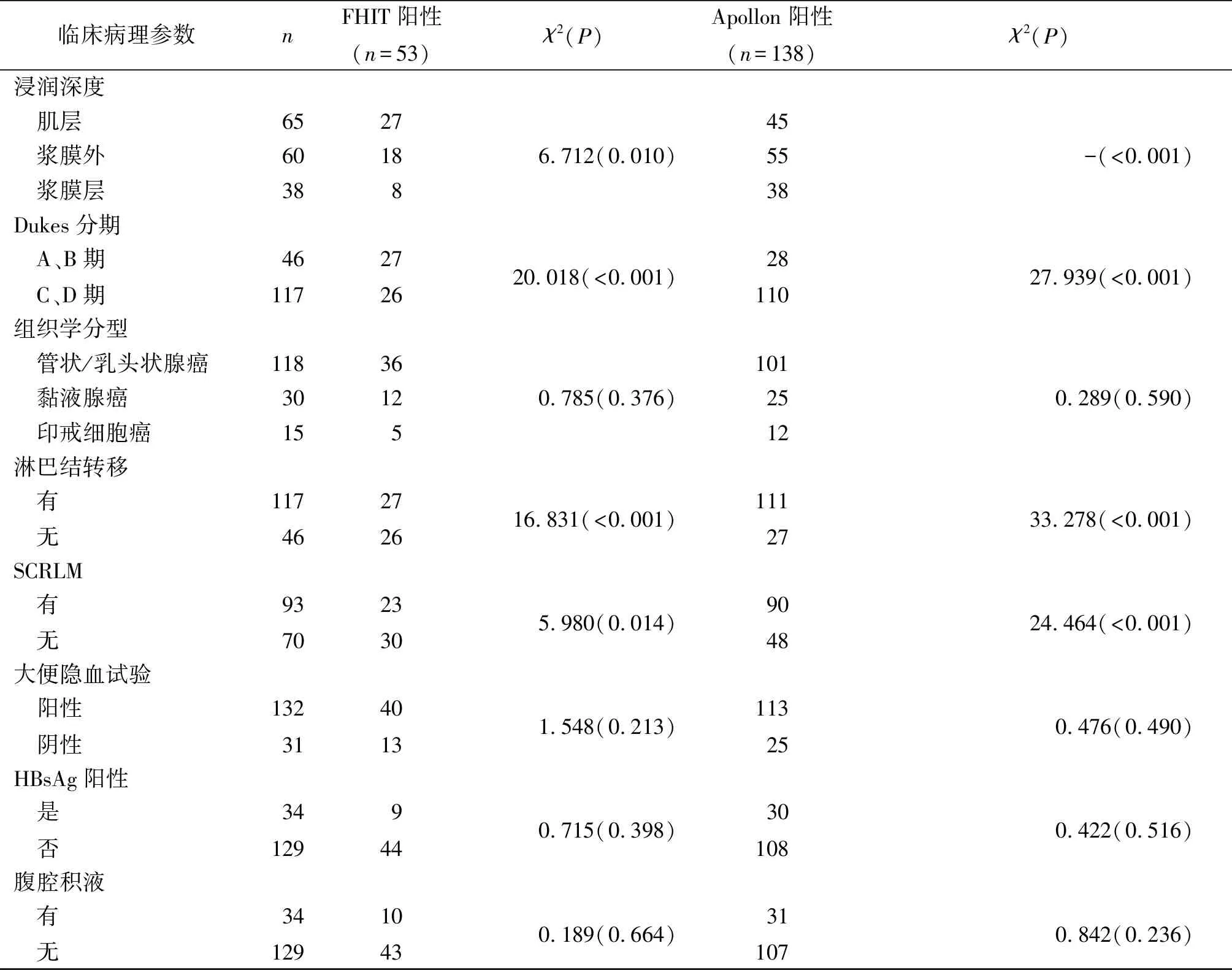
续表4
2.3FHIT、Apollon表达与CRC预后的关系163例生存曲线见图1。FHIT+Apollon-患者预后优于FHIT+Apollon+患者(χ2=10.765,P<0.001);FHIT-Apollon+、FHIT-Apollon-患者预后差于FHIT+Apollon+患者(χ2=9.154、12.130,P<0.001);FHIT-Apollon+与FHIT-Apollon-患者生存曲线比较,差异无统计学意义(χ2=0.205,P=0.651)。

图1 不同FHIT、Apollon表达状态的CRC患者的生存曲线
3 讨论
CRC属于结肠黏膜上皮细胞恶性肿瘤,其发病原因与不良生活习惯、遗传及环境因素等关系密切[6]。由于肠道血供及淋巴回流丰富,CRC细胞更易通过血液及淋巴循环发生远端转移,导致多数患者确诊时已失去最佳治疗时机,预后差[7]。因此,急需寻找可早期预测CRC复发和转移的标志物,以便能及时有效干预,改善患者预后,延长生存期。
FHIT蛋白是三联组氨酸家族重要成员,生理状态下可在机体多种组织中表达。本研究发现CRC组织中FHIT蛋白阳性率低于癌旁组织,Apollon阳性率高于癌旁组织,提示FHIT蛋白表达缺失或Apollon蛋白表达增强与CRC的发生关系密切。Zheng等[8]研究发现,FHIT在胃癌中的表达水平低于正常胃黏膜组织,且其表达水平与浸润深度、淋巴结转移、远端转移及分化程度负相关。Apollon是凋亡抑制蛋白家族中相对分子质量最大的蛋白,其特有结构域杆状病毒IAP重复序列(BIR)可与Caspase-9、Smac结合并促进其降解,从而抑制Caspase-9前体活化,抑制凋亡信号启动,从而有利于癌细胞的无限增殖、转移等过程[9]。本研究中与浸润至肌层或浆膜外、Dukes分期A或B期、无淋巴结转移、无SCRLM者比较,浸润至浆膜层、Dukes分期C或D期、有淋巴结转移、有SCRLM的CRC组织中FHIT阳性率降低,Apollon阳性率升高,提示FHIT蛋白表达异常降低或Apollon蛋白表达异常升高均有利于CRC细胞的侵袭、转移。
Druck等[10]研究表明,FHIT可通过死亡受体途径和线粒体依赖凋亡蛋白酶活化因子(Apaf)-1/Caspase-9两种信号通路诱导细胞凋亡;FHIT蛋白具有显著的抑癌作用,但其作用机制尚不明确,有研究[11-12]认为与FHIT具有二腺苷三磷酸(Ap3A)水解酶、mRNA脱帽、形成FHIT底物复合物等多种因素有关。而Apollon可促进Caspase-9降解,从而抑制凋亡进程;两者可能存在负调节及相互抑制的关系。本研究发现,CRC组织中FHIT与Apollon蛋白表达存在较微弱的负向关联性。
禹志韫等[13]研究发现,FHIT阳性宫颈癌患者1 a生存率明显高于FHIT阴性患者,提示FHIT与肿瘤预后关系密切。吴珏堃等[14]采用小干扰RNA法敲低乳腺癌MCF-7细胞Apollon基因,结果显示低表达Apollon基因的乳腺癌细胞对顺铂的敏感性增强,提示Apollon与肿瘤治疗转归关系密切。本研究经Kaplan-Meier生存分析发现,FHIT阴性表达(FHIT-Apollon+、FHIT-Apollon-)患者的预后均差于阳性表达(FHIT+Apollon+、FHIT+Apollon-)者;Apollon阳性表达(FHIT-Apollon+)患者预后差于阴性表达(FHIT+Apollon-)者;进一步证实FHIT蛋白低表达和Apollon蛋白高表达不利于CRC的预后转归。
综上所述,FHIT和Apollon蛋白在CRC组织中的表达呈负相关,两者的表达与CRC侵袭、转移及预后关系密切,可作为预测CRC转移及预后的可靠标志物;临床上可通过靶向调控FHIT与Apollon的表达,调控CRC细胞增殖、转移等过程。本研究的不足之处在于,纳入研究对象较少,随访时间较短。我们进一步将扩大样本量,开展多中心、高质量随机对照研究,以证实本研究结果的稳定性和正确性,为CRC临床治疗提供一定理论依据。