大剂量咖啡因对脂多糖诱导的新生大鼠神经细胞活力及PI3K/AKT信号通路蛋白表达的影响
王俊苹,张剑春,刘 伟
1)驻马店市中心医院药学部 河南驻马店 463000 2)驻马店市中心医院新生儿科 河南驻马店 463000 3)新乡医学院第三附属医院临床药学室 河南新乡 453003
近些年早产儿出生率增高,且有增加的趋势[1]。由于早产儿血脑屏障没有发育完善,细胞内毒素及多种炎症因子易透过血脑屏障进入脑内,造成脑损伤。临床上使用的机械通气、静脉置管等技术也增加了新生儿感染的风险,从而使新生儿脑损伤程度加重[2]。脂多糖(lipopolysaccharide,LPS)是一种细菌内毒素,可造成多种炎症反应,常用于诱导脑损伤动物模型[3-4]。咖啡因是一种脂溶性药物,能顺利透过血脑屏障,广泛应用于呼吸暂停等多种新生儿期疾病的治疗[5];但过量的咖啡因摄入可导致过度兴奋、精神紧张等症状[6];高浓度咖啡因可使PC12细胞内钙的释放过度,钙稳态被破坏,从而引起细胞损伤[7]。本研究利用LPS诱导原代培养的新生大鼠大脑皮层神经细胞炎性损伤模型,观察大剂量咖啡因对模型细胞活力、凋亡及PI3K/AKT信号通路的影响,探讨大剂量咖啡因的脑损伤作用及可能的机制。
1 材料与方法
1.1主要试剂和仪器胰蛋白酶、LPS购自美国Sigma公司;DMEM培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;BCA试剂盒购自北京康为世纪科技有限公司;MTT试剂购自碧云天生物技术研究所; Annexin V-FITC/PI细胞凋亡检测试剂盒及流式细胞仪购自美国BD公司;细胞增殖核抗原(PCNA)、活化的Caspase-3(Cleaved Caspase-3)、PI3K、磷酸化AKT(p-AKT)、GAPDH抗体及PI3K/AKT信号通路抑制剂LY294002均购自美国Cell Signal公司;酶标仪购自瑞士TECAN公司。
1.2大鼠大脑皮层神经细胞的分离及培养新生SPF级SD大鼠(出生24 h以内)购自四川大学实验动物中心。无菌条件下取出大鼠的大脑皮层,洗涤后转移至装有胰蛋白酶的小青霉素瓶中,用手术剪剪碎至1~3 mm3的小块,于培养箱内37 ℃消化10 min,加适量体积分数10%胎牛血清终止消化,制成细胞悬液。将细胞悬液离心(1 000 r/min离心10 min)后弃上清,加入神经细胞培养液(神经元基础培养基500 mL,添加B27试剂10 mL,青霉素和链霉素各5万U,L-谷氨酰胺1 mmol,调pH值至7.2)适量,调整细胞浓度为5×105个/mL。将细胞接种至培养板内,37 ℃培养24 h,换液,此后每3.5 d换液一次。取培养1周的细胞[8]用于实验。
1.3细胞分组及处理将神经细胞分为空白对照组、LPS组、咖啡因组和咖啡因+LPS组。空白对照组细胞仅用培养液培养24 h;LPS组和咖啡因组细胞分别用10 mg/L的LPS及5 mmol/L的咖啡因处理24 h;咖啡因+LPS组细胞用5 mmol/L的咖啡因和10 mg/L的LPS处理24 h。
1.4细胞活力和凋亡检测采用MTT法检测各组细胞活力。以每孔100 μL(含有1×105个细胞)接种大鼠神经细胞于96孔板,于体积分数5%CO2培养箱37 ℃培养7 d,吸尽培养基,按照1.3分组处理。然后,每孔加入MTT溶液10 μL,于培养箱内孵育4 h,加入DMSO溶液150 μL/孔37 ℃培养4 h,利用空白孔调零,上酶标仪测570 nm波长处的吸光度(A)值,计算细胞存活率[(实验组A值/调零孔A值)×100%[9]]。每组设置8个复孔。采用Annexin V-FITC/PI双染法检测各组细胞凋亡率,具体步骤参照试剂盒说明。实验重复3次。
1.5PI3K/AKT信号通路蛋白表达的检测收集细胞,加入适量的裂解液以提取细胞总蛋白,BCA法进行蛋白定量。每孔道上样40 μg蛋白进行SDS-PAGE,电泳结束后转PVDF膜,用50 g/L脱脂奶粉摇床封闭2 h,加一抗过夜。PCNA、Cleaved Caspase-3、PI3K、p-AKT抗体均按1∶500稀释,内参GAPDH按1∶1 000稀释。一抗孵育结束后洗膜,加入1∶2 000稀释的HRP标记的羊抗兔IgG二抗,洗膜。化学发光法曝光显色,用凝胶成像系统扫描,以目的条带与内参GAPDH条带灰度值的比值表示目的蛋白表达水平。实验重复3次。
1.6抑制PI3K/AKT信号通路对LPS诱导的新生大鼠神经细胞的影响将新生大鼠神经细胞分为2组: 咖啡因+LPS组细胞用咖啡因和LPS诱导24 h(方法同1.3); 咖啡因+LPS+LY294002组细胞用咖啡因、LPS和PI3K/AKT信号通路抑制剂LY294002处理24 h。按照前述方法检测2组细胞活力、凋亡率及PCNA、Cleaved Caspase-3、PI3K、p-AKT蛋白的表达。实验重复3次。
1.7统计学处理采用SPSS 21.0进行数据分析。空白对照组、LPS组、咖啡因组和咖啡因+LPS组细胞活力、凋亡率及PCNA、Cleaved Caspase-3、PI3K、p-AKT蛋白表达的比较采用2×2析因设计的方差分析;咖啡因+LPS组和咖啡因+LPS+LY294002组上述指标的比较采用两独立样本的t检验;检验水准α=0.05。
2 结果
2.1 4组大鼠神经细胞PCNA、Cleaved Caspase-3、PI3K、p-AKT蛋白表达的比较结果见图1、表1。LPS和咖啡因单独作用均可下调PCNA、PI3K和p-AKT表达,上调Cleaved Caspase-3表达;两者联用,协同增效。
2.2 4组大鼠神经细胞活力和凋亡率的比较见表1。LPS和咖啡因单独作用均可抑制新生大鼠神经细胞活力,诱导凋亡;咖啡因可增强LPS对细胞的活力抑制和凋亡诱导作用。
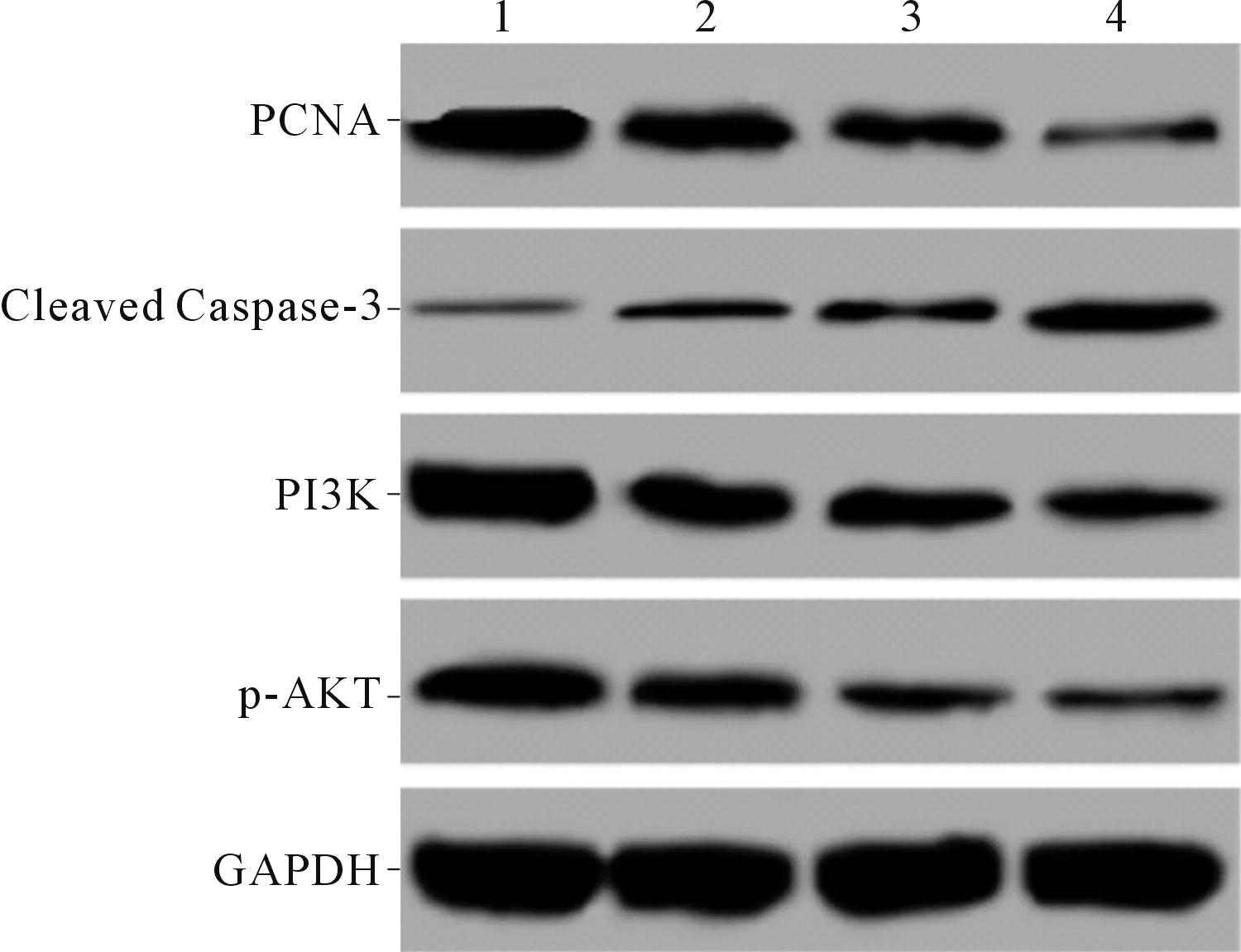
1:空白对照组;2:LPS组;3:咖啡因组;4:咖啡因+LPS组

表1 4组细胞存活率、凋亡率及PCNA、Cleaved Caspase-3、PI3K、p-AKT蛋白表达的比较(n=3)
2.3咖啡因+LPS组和咖啡因+LPS+LY294002组各指标的比较见图2和表2。与咖啡因+LPS组比较,咖啡因+LPS+LY294002组细胞活力降低,凋亡率增加,PCNA、PI3K和p-AKT表达下调,Cleaved Caspase-3表达上调。

表2 2组细胞存活率、凋亡率及PCNA、Cleaved Caspase-3、PI3K、p-AKT蛋白表达的比较(n=3)
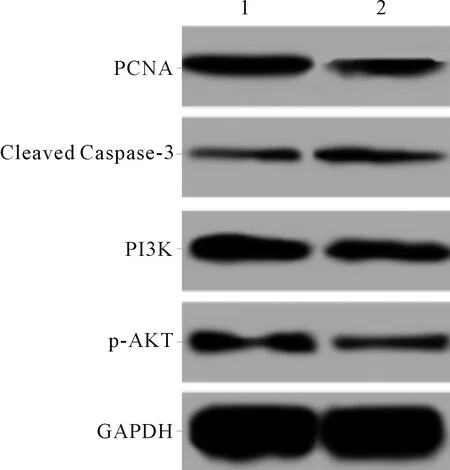
1:咖啡因+LPS组;2:咖啡因+LPS+LY294002组
3 讨论
近年来,由感染导致的早产儿脑损伤引起广泛关注,脑损伤与多种因素引起的脑组织炎症反应关系密切,细菌感染中LPS是主要的致病物质。有研究[10-11]显示,LPS能刺激小胶质细胞凋亡,导致神经元损伤,造成脑损伤。本研究应用LPS建立新生大鼠神经细胞炎症损伤模型,分析大剂量咖啡因对LPS诱导的大鼠神经细胞活力及凋亡的影响。
在预实验中我们发现5 mmol/L的咖啡因作用24 h即可引起新生大鼠神经细胞损伤,因此选择此作用条件用于实验。结果显示,LPS和咖啡因均可降低新生大鼠神经细胞活力,诱导细胞凋亡,并且两者具有协同增效的作用。PCNA是一个酸性核蛋白,表达越高说明DNA的复制程度越高,其表达水平可反映细胞增殖状态[12-13]。细胞凋亡需要一定的刺激信号,caspase级联反应在细胞凋亡过程中发挥重要作用,而Caspase-3在此过程中处于中心地位[14-15]。有研究[16]发现,在LPS诱导的脑损伤中神经细胞凋亡增加,Caspase-3表达增强。本研究结果显示,LPS和大剂量咖啡因均可下调新生大鼠神经细胞PCNA的表达,上调Cleaved Caspase-3的表达;两者共同干预后细胞中PCNA表达下调更明显,Cleaved Caspase-3表达增强更显著。PI3K/AKT信号通路是细胞内一条重要的信号转导通路,影响细胞增殖、凋亡启动、血管生成、周期调控等过程,在脑损伤中的作用也受到广泛关注[17-18]。p-AKT表达增加可减轻缺氧诱导的脑损伤,而抑制该信号通路作用则相反[19-20]。本研究结果显示,LPS和大剂量咖啡因均可抑制新生大鼠神经细胞PI3K/AKT信号通路PI3K和p-AKT表达,两者共同干预后PI3K和p-AKT表达下调更明显;PI3K/AKT信号通路抑制剂LY294002可减弱大剂量咖啡因和LPS共同干预作用,表现为细胞活力降低,凋亡增强;提示大剂量咖啡因可能是通过调节PI3K/AKT信号通路参与新生大鼠神经细胞损伤过程。
综上所述,咖啡因可通过调节PI3K/AKT信号通路,降低LPS诱导的新生大鼠神经细胞活力,诱导细胞凋亡,从而加重脑损伤;在临床使用时,应充分考虑咖啡因用药剂量。