莱菔硫烷对人黑色素瘤A375细胞自噬的影响
张心 王博涵 孙健
黑色素瘤(melanoma)是一种恶性程度极高的肿瘤,手术联合化疗是其主要治疗手段,但因病情进展快,治疗效果并不理想[1]。因此,亟需探索更高效的治疗方法。莱菔硫烷(sulforaphane,SFN)是十字花科蔬菜中存在的一种化学活性成分,具有调控化学致癌物代谢酶活性、抗炎、阻滞细胞周期、诱导细胞凋亡等作用[2]。在结肠癌、乳腺癌、前列腺癌和人神经母细胞瘤等研究中还发现SFN可诱导细胞自噬,且联合自噬抑制剂可进一步增强促凋亡作用[3-6]。但目前SFN及联合用药对黑色素瘤的作用仍不清楚。本研究探讨SFN在人黑色素瘤A375细胞自噬中的作用,以期为黑色素瘤临床治疗提供新的思路。
1 材料与方法
1.1 细胞系及主要试剂
人黑色素瘤A375细胞购自中国科学院上海细胞库;SFN(纯度≥95%)、自噬抑制剂氯喹(CQ)购自Sigma Aldrich公司;RPMI 1640培养基购自GIBCO公司;胎牛血清购自Thermo Fisher Scientific公司;胰蛋白酶购自 Solarbio 公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试剂购自武汉博士德公司;二甲基亚砜(DMSO)购自北京鼎国昌盛生物技术有限责任公司;总RNA提取试剂盒、逆转录试剂盒、SYBR染料均购自TaKaRa公司;BCA试剂盒、RIPA蛋白裂解液均购自上海碧云天生物技术公司;兔抗微管相关蛋白 1 轻链 3(LC3)、Beclin-1、p62、Bcl-2、Bax、Caspase-3和β-actin单克隆抗体和相应的辣根过氧化物酶标记的山羊抗兔二抗均购自美国Santa Cruz公司。
1.2 细胞培养
A375细胞用含有10%胎牛血清、100 U青霉素和100 U链霉素的RPMI 1640培养基于37℃、5% CO2条件下培养,待细胞生长完全贴壁后,用0.25%胰酶消化后传代,取对数生长期的A375细胞用于后续实验。
1.3 MTT法检测细胞增殖能力
取对数生长期的A375细胞按2×105·mL-1密度接种于 96孔板,每孔 200 μL,于 37 ℃、5% CO2培养箱过夜培养,待细胞生长至70%融合时,分别加入不同浓度的 SFN (0 μmol·L-1、5 μmol·L-1、10 μmol·L-1、20 μmol·L-1、40 μmol·L-1),同时以相同体积的含0.1% DMSO的培养基为空白对照组;同等条件下将自噬抑制剂 CQ 10 μL(20 μmol·L-1)加入 A375 细胞培养2 h,然后加入以上不同浓度的SFN。培养24 h后,每孔加入 MTT 试剂 20 μL(5 μg·mL-1),4 h 后弃去培养基,加入100 μL DMSO,室温避光震荡10 min。于酶标仪测定570 nm处的吸光度(OD)值。细胞增殖率(%)=[(对照组OD值-实验组OD值)/(对照组OD值-空白组OD值)]×100%。实验重复3次。
1.4 Real-time PCR法检测自噬和凋亡分子mRNA的表达水平
收集各组细胞,提取细胞中总RNA,测定浓度和纯度。按照逆转录试剂盒说明书将总RNA逆转录成cDNA,并采用SYBR染料法进行PCR定量。PCR反应体系:2×UltraSYBR Mixture(With ROXⅠ)10 μL,cDNA 2 μL,上下游引物各 0.8 μL,RNase-Free H2O 6.4 μL。反应条件:95 ℃ 30 s,95 ℃ 5 s、60 ℃ 30 s共40个循环。各引物序列中,β-actin上游为5′-GGACTTCGAGCAAGAGATGG-3′,下游为 5′-AGCACTGTGTTGGCGTACAG-3′;LC3 Ⅱ 上 游 为 5′-CCACACCCAAAGTCCTCACT-3′,下游为 5′-CACTGCTGCTTTCCGTAACA-3′;LC3Ⅰ上游为 5′-GTCACCGGGCGAGTTACC-3′,下游为 5′-CTCGCGCTCAAGGGCTC-3′;Beclin-1 上游为 5′-AGCTGCCGTTATACTGTTCT-3′,下游为 5′-TGTGTCTTCAATCTTGCCTT-3′;p62 上游为5′-AAATGGGTCCACCAGGAAACTGGA-3′,下游为 5′-TCAACTTCAATGCCCAGAGGGCTA-3′;Bcl-2 上游为5′-CTGGTGGACAACATCGC-3′,下游为 5′-GGAGAAATCAAACAGAGGC-3′;Bax 上游为 5′-TGGCAGCTGACATGTTTTCTGAC-3′,下游为 5′-TCACCCAACCACCCTGGTCTT-3′;Caspase-3 上游为 5′-CTGGACTGTGGCATTGAGAC-3′,下游为 5′-ACAAAGCGACTGGATGAACC-3′。以 β-actin 为内参。采用 2-△△Ct法计算LC3Ⅱ、LC3Ⅰ、Beclin-1、p62、Bcl-2、Bax 和 Caspase-3 mRNA的表达水平。实验重复3次。
1.5 Western blot法检测自噬相关蛋白和凋亡相关蛋白的表达水平
收集各组细胞,加入RIPA蛋白裂解液提取细胞中的总蛋白,并按照BCA试剂盒的操作步骤检测蛋白浓度。用10% SDS聚丙烯酰胺凝胶电泳分离蛋白质,转移至PVDF膜,以5%脱脂奶粉室温封闭2 h后,分别加入 LC3、Beclin-1、p62、Bcl-2、Bax、Caspase-3和 β-actin 一抗(稀释比例分别为 1∶2 000、1∶2 000、1∶2 000 和 1∶5 000),4 ℃孵育过夜,用 TBST 洗膜 3 次后加入相应二抗(稀释比例为1∶10 000)孵育,化学发光凝胶成像仪检测,Image J软件分析灰度值,以β-actin作为内参校正蛋白相对表达水平。
1.6 统计学方法
采用SPSS 20.0统计软件进行统计分析,结果以均数±标准差(±s)表示,多组间比较采用单因素方差分析,若组间差异有统计学意义,进一步多重比较采用Dunnett's t检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 SFN可抑制A375细胞增殖
MTT法检测结果显示,SFN呈剂量依赖式抑制A375细胞增殖,各组间的细胞增殖率差异有统计学意义(F=21.517,P<0.001),且与对照组(0 μmol·L-1SFN)比较,不同浓度(5 μmol·L-1、10 μmol·L-1、20 μmol·L-1 和 40 μmol·L-1)SFN 组的细胞增殖率均降低(P<0.05),见图 1。
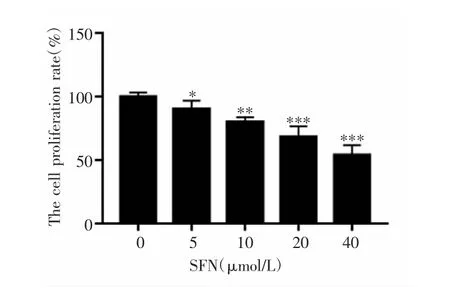
图1 不同浓度SFN对A375细胞增殖的影响Fig.1 Effect of different concentrations of SFN on the proliferation of A375 cells
2.2 SFN调控A375细胞内自噬相关分子LC3、Beclin-1和p62的表达
Real-time PCR和Western blot检测结果显示,不同浓度SFN处理A375细胞后,各组细胞内自噬相关分子LC3Ⅱ、Beclin-1和 p62 mRNA 表达(FLC3Ⅱ=17.561,PLC3Ⅱ<0.001;FBeclin-1=18.622,PBeclin-1<0.001;Fp62=7.843 ,Pp62=0.004)和蛋白表达水平(FLC3Ⅱ/LC3Ⅰ=10.080,PLC3Ⅱ/LC3Ⅰ=0.002;FBeclin-1=40.132,PBeclin-1<0.001;Fp62=9.061,Pp62=0.002)差异均有统计学意义,而LC3ⅠmRNA水平比较差异无统计学意义(FLC3Ⅰ=0.448,PLC3Ⅰ=0.772)。与对照组比较,不同浓度SFN均能上调A375细胞内LC3Ⅱ、Beclin-1 mRNA和蛋白表达,且随着SFN干预剂量的增加而明显升高(P<0.05);但A375细胞内p62 mRNA和蛋白表达均下调,且随着SFN干预剂量的增加而逐渐下降(P<0.05)。见图2。
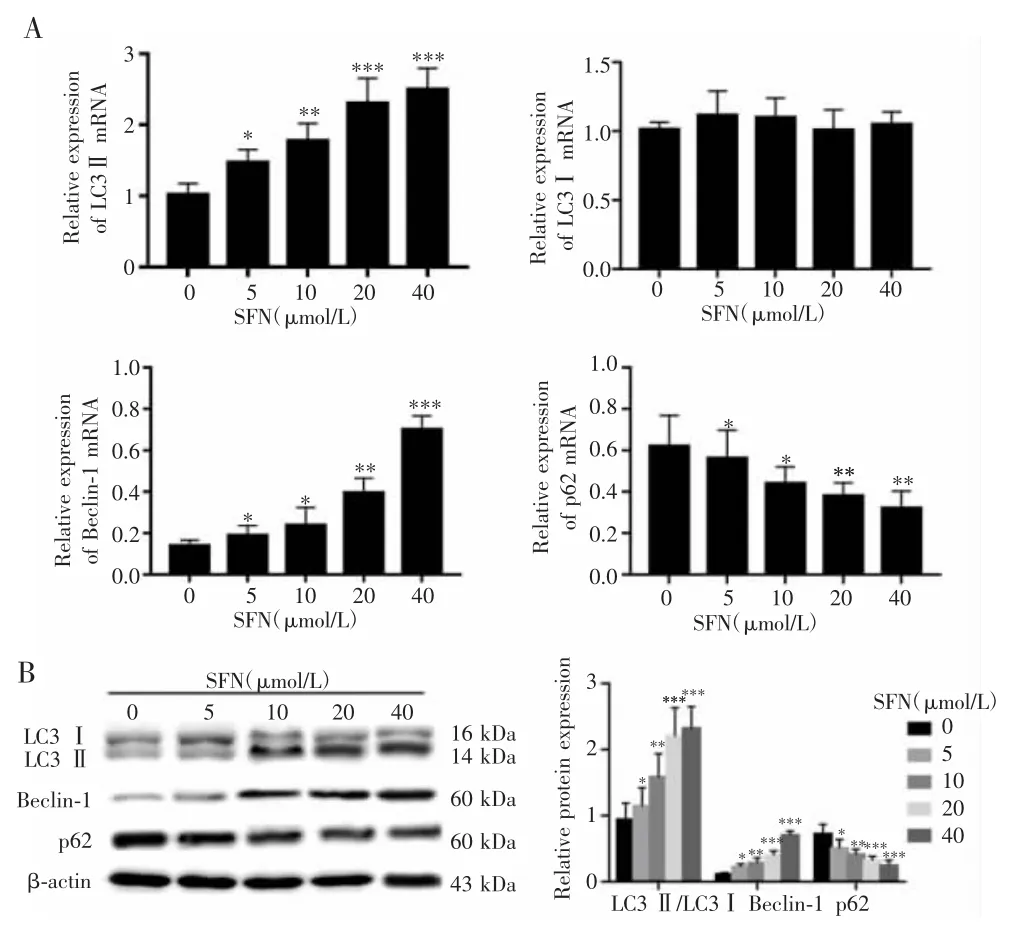
图2 不同浓度SFN处理A375细胞后LC3、Beclin-1和p62的表达情况Fig.2 Expression of LC3、Beclin-1 and p62 in A375 cells after treated with different concentrations of SFN
2.3 SFN调控A375细胞内凋亡相关分子Bcl-2、Bax和Caspase-3的表达
Real-time PCR和Western blot检测结果显示,不同浓度SFN处理A375细胞后,各组细胞内凋亡相关分子Bcl-2、Bax和Caspase-3 mRNA表达(FBcl-2=68.049,PBcl-2<0.001;FBax=96.653,PBax<0.001;FCaspase-3=49.272,PCaspase-3<0.001)和蛋白表达水平(FBcl-2=82.943,PBcl-2<0.001;FBax=151.221,PBax<0.001;FCaspase-3=59.764,PCaspase-3<0.001)差异均具有统计学意义。与对照组比较,不同浓度SFN均可下调Bcl-2 mRNA和蛋白表达,且随SFN干预剂量的增加逐渐下降(P<0.05);而Bax、Caspase-3 mRNA和蛋白的表达上调,且随SFN干预剂量增加而逐渐升高,差异均有统计学意义(P<0.05),见图3。
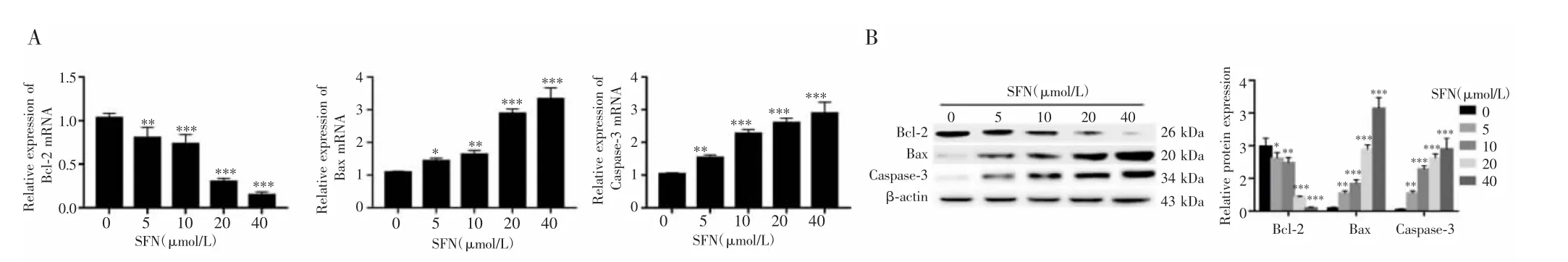
图3 不同浓度SFN处理A375细胞后Bcl-2、Bax和Caspase-3的表达情况Fig.3 Expression of Bcl-2、Bax and Caspase-3 in A375 cells after treated with different concentrations of SFN
2.4 自噬抑制剂CQ联合SFN对A375细胞增殖的影响
不同浓度联合组的细胞增殖率差异有统计学意义(F=71.924,P<0.001),进一步多重比较发现,不同浓度SFN组细胞增殖率较空白组低,且呈剂量依赖方式(P<0.05);但CQ组细胞增殖率与空白组比较差异无统计学意义(P=0.862),SFN+CQ组细胞增殖率较相应浓度的单独SFN组均下降(P<0.05),见图4。
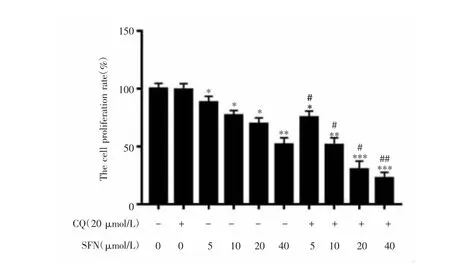
图4 SFN联合自噬抑制剂CQ对A375细胞增殖的影响Fig.4 Effect of SFN combined with CQ on the proliferation of A375 cells
3 讨论
SFN是十字花科植物中存在的异硫氰酸酯类物质的主要成分,具有抗炎、抗氧化、清除自由基等作用[7]。近年来,有研究发现SFN可保护细胞免受环境致癌物的侵害,并诱导多种癌细胞生长停滞和(或)凋亡,如抑制非肌肉浸润性膀胱癌、卵巢癌和胃癌干细胞等多种肿瘤细胞增殖并促进其凋亡[8-10]。本研究以人黑色素瘤细胞株A375为研究对象,结果亦发现SFN呈剂量依赖式抑制A375细胞增殖,与上述文献报道一致。
自噬是真核细胞内不依赖于半胱氨酰天冬氨酸特异性蛋白酶的程序性细胞死亡,是细胞内多余的蛋白质和细胞器等成分在溶酶体内分解的复杂的催化过程,又被称为Ⅱ程序性细胞死亡[11]。其中,LC3是自噬体的标志蛋白,其蛋白合成后可被Atg4剪切,形成LC3Ⅰ;而在自噬过程中,LC3Ⅰ经Atg7和Atg3等泛素酶系统加工修饰,形成分子量为14 kDa的LC3Ⅱ,并定位到自噬小体中,因此自噬活化时,细胞内LC3Ⅰ会向LC3Ⅱ转化[12]。Beclin-1作为自噬过程的关键基因,是自噬所需Ⅲ型磷脂酰肌醇-3-激酶复合物的一部分。当细胞发生自噬时,细胞内的Beclin-1 mRNA和蛋白表达均增加[13]。p62是选择性自噬受体,在自噬过程中与泛素化蛋白结合,最终被清除。p62水平升高表示对自噬体的清除被阻断,当LC3Ⅱ/LC3Ⅰ上调时,p62下调,表明自噬正在进行,反之表示自噬过程被抑制[14]。因此,分析上述自噬相关分子的表达变化有助于反映细胞自噬水平。有研究报道SFN能诱导前列腺癌细胞发生保护性自噬,发挥促凋亡作用[5]。在人乳腺癌MDA-MB-231细胞中,SFN可通过上调LC3Ⅱ和Beclin-1蛋白以及下调p62蛋白表达诱导乳腺癌细胞发生自噬[4]。在人神经瘤母细胞中同样发现SFN可增加LC3Ⅱ蛋白表达而降低p62蛋白表达,从而诱导自噬流形成[15]。本研究采用不同浓度SFN处理人黑色素瘤A375细胞后,亦发现随着SFN剂量的增加,LC3Ⅱ/LC3Ⅰ、Beclin-1表达水平逐渐增强,p62表达水平逐渐降低;而抗凋亡蛋白Bcl-2表达水平逐渐下降,促凋亡蛋白Bax和Caspase-3蛋白水平逐渐升高,说明SFN同样可诱导黑色素瘤A375细胞发生自噬并促进其凋亡。
目前也有研究报道SFN与自噬抑制剂联合可能更好发挥抑癌作用。KANEMATSU等[16]研究发现SFN联合自噬抑制剂巴伐洛霉素A1可促进乳腺癌细胞凋亡。VYAS等[5]在前列腺癌细胞中亦发现SFN联合自噬抑制剂CQ可有效抑制细胞增殖并诱导其凋亡。CQ作为常用的自噬抑制剂之一,可作用于自噬过程的终末阶段,同时通过影响溶酶体对自噬包裹物的降解抑制自噬,且被报道与其他药物联合作用可能有助于进一步抑制多种肿瘤细胞增殖[17]。为进一步分析SFN诱导的自噬对A375细胞增殖的影响,本研究采用自噬抑制剂CQ预处理A375细胞后分别加入不同浓度的SFN,结果发现单纯CQ预处理A375细胞并未引起细胞增殖率明显变化,提示A375细胞在正常情况下自噬水平可能较低,对细胞增殖活力无明显影响,但CQ联合SFN处理后可进一步增强细胞增殖抑制作用。
本研究发现,SFN可诱导黑色素瘤A375细胞发生自噬并促进其凋亡,且与自噬抑制剂联合应用能更有效抑制黑色素瘤细胞增殖,为黑色素瘤的联合治疗提供新的策略。但是本研究仅在A375细胞中验证,且未进行体内动物实验研究,因此SFN诱导自噬及联合自噬抑制剂对黑色素瘤的确切作用及其机制仍有待进一步研究。

