超高压处理对复合果汁微生物和品质的影响
高婧昕 刘 旭 丁皓玥 廖小军 王永涛
(中国农业大学食品科学与营养工程学院 国家果蔬加工工程技术研究中心农业部果蔬加工重点实验室 北京100083)
目前市场上销售的果汁主要分为2种:一种是浓缩还原(From concentrate,FC)果汁,另一种是非浓缩还原(Not from concentrate,NFC)果汁。FC 果汁需要经过浓缩与还原等复杂加工过程,其新鲜度及口感较差,营养流失也很严重;NFC 果汁是将新鲜原果清洗后压榨出果汁,经杀菌后直接灌装(不经过浓缩及复原),可以更好地保留水果原有的新鲜风味和营养物质[1]。随着消费水平的提高,人们对果汁产品质量的要求也越来越高,既要天然、有营养,又要色、香、味俱佳。目前市场上NFC 果汁已成为健康消费的趋势,拥有广阔的市场前景。然而,目前市场上现有的NFC 果汁产品多为单一水果压榨而成,不能满足不同人群对产品的多元化和个性化需求,并且现有NFC 果汁多采用热杀菌,这不仅造成果汁营养成分损失(特别是热敏性营养成分),还使果汁产生蒸煮味,感官品质严重下降。
复合果汁是以2种或2种以上的果汁为原料,按照一定比例加工配制而成,它可综合多种水果的营养价值并创造出新奇的口感,满足不同人群对产品的需求。超高压(High Hydrostatic Pressure,HHP)技术是一种新兴的非热加工技术,是将食品物料以柔性材料密封包装后,放入液体介质中,使用100 MPa 以上(100~1 000 MPa)的压力处理一定时间,使食品达到杀菌、灭酶和改变物性等目的的新型食品加工方法。由于它具有温度变化小,只作用于非共价键,瞬间压缩,作用均匀等优点,因此能够很好地保持食品天然的色、香、味、质构和营养等品质[2]。
本研究选用多种高品质水果原料制备复合果汁,采用HHP 杀菌来代替热杀菌,减少营养物质及感官品质的损失,研究HHP 杀菌对复合果汁品质的影响,以期为HHP 技术在复合果汁加工中的应用提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 原料及预处理 苹果,品种为“红富士”,产地新疆阿克苏地区,选用外观新鲜、无腐烂的苹果为试验原料。洗净切分后浸泡于含有0.5 mg/mL食品级抗坏血酸及0.5 mg/mL 食品级柠檬酸的溶液中护色,榨汁后用8 层纱布过滤得到苹果汁,向苹果汁中加入0.05%苹果质量的抗坏血酸护色,4℃下冷藏待用。
石榴,品种为“皮亚曼”,产地新疆皮山县。选用外观新鲜、无腐烂的石榴为试验原料。洗净剥好,用打浆机带籽打碎后,8 层纱布过滤得到石榴汁,4 ℃下冷藏待用。
布朗李,品种为“黑宝石”,产地新疆英吉沙县。选用速冻布朗李浆为试验原料。解冻后使用8层纱布过滤,4 ℃下冷藏待用。
1.1.2 主要试剂 平板计数培养基,北京奥博星生物技术有限责任公司;抗坏血酸标品(优级纯药品)、磷酸缓冲液、2,6-二氯靛酚、2,4,6-三(2-吡啶)-1,3,5-三吖嗪(TPTZ)、孟加拉红培养基,北京索莱宝科技有限公司;氯化钠、冰醋酸、浓盐酸、氢氧化钠、无水甲醇,北京化工厂;水溶性维生素E、没食子酸,Aladdin 上海试剂公司;碳酸钠、草酸、无水磷酸二氢钠、硼酸、无水氯化铁、邻苯二酚均属于国产化学纯药品,国药集团化学试剂有限公司;1,1-二苯基苦基苯肼(DPPH)、福林酚,上海源叶生物公司;Tween 20 纯度97%,Triton X-100为生化试剂,美国AMRESCO 公司;碳酸氢钠、愈创木酚,山东西亚化学工业有限公司;30%过氧化氢、十二税和磷酸氢二钠,西陇化工股份有限公司;聚乙烯吡咯烷酮,北京拜尔迪生物技术有限公司;醋酸钠,天津京福晨化学试剂厂;亚油酸纯度为95%,成都格雷西亚化学技术有限公司;其它试剂均属于国产分析纯级。
1.2 设备与仪器
MJ-BL25B1 搅拌机,广东美的生活电器制造有限公司;JYZ-E19 原汁机,九阳股份有限公司;超高压处理设备(30 L),包头科发高压科技有限责任公司;SHP-150 电热恒温培养箱、SHP-250 低温生化培养箱,上海精宏实验设备有限公司;LDZX-50KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-2D 超净工作台,苏州净化设备有限公司;S-HH-W21-Cr600 恒温水浴箱,北京长安科技仪器厂;CLXXUVFM2 超纯水器,英国EL GA LabWater 公 司;PB -10标准型pH计、BSA224S-CW 分析天平、BSA822 电子天平,赛多利斯科学仪器(北京)有限公司;AR550 流变仪,美国TA 仪器有限公司;UV-1800 紫外分光光度计,日本岛津公司;DR-A1 阿贝折射仪,广州市爱拓科学仪器有限公司;SPARK 10M 酶标仪,瑞士帝肯集团公司;V1800可见分光光度计,尤尼科(上海)仪器有限公司;KQ-500DE 超声水溶箱,昆山市超声仪器有限公司;HunterLab Color Quest XE全能色差仪,美国Hunterlab 公司;WK2102 电磁炉,美的股份有限公司;Agilent 7890-5975 气质联用仪,美国安捷伦公司;AG 22331 离心机,艾本德公司。
1.3 试验方法
1.3.1 复合果汁的制备 将制备好的苹果汁、石榴汁和布朗李浆按照一定质量比混合。
1.3.2 感官评价 根据预试验,最终选择苹果、石榴、布朗李为复合果汁原料,将果汁按照复合比例(m苹果汁∶m石榴汁∶m布朗李浆=4∶5∶1,5∶4∶1,12∶7∶1,14∶5∶1,16∶3∶1)进行配制,对果汁色泽、气味、组织状态和口感进行感官评价。
感官评价过程参照Min等[3]的方法,略作修改。由15 名(7 名男性,8 名女性)受过相关训练的品评员进行。按照感官评价表,采用百分制打分法对各项指标进行评分。将不同复配比例的果汁分装到用于品鉴的一次性杯中,同时向每个评价员提供1 杯饮用水以清除品尝不同果汁间口中残留的味道,每品尝2 个果汁之间要间隔1 min。
1.3.3 超高压和热处理 将用100 mL PET 瓶装好的果汁置于HHP 处理釜中,处理压力分别设定为300,400,500 MPa,保压时间(不包括升卸压时间)分别设定为1,3,5 min。处理温度为常温(20±1)℃。达到保压时间后,系统自动卸压,卸压结束后打开堵头,取出果汁。另设热处理组,热处理条件为80 ℃/2 min。
1.3.4 培养基的制备 平板计数培养基的制备:按照23.5 g 平板计数培养基加入1 L 蒸馏水的比例配制,121 ℃高压灭菌15 min,置于(55±1)℃恒温水浴锅中。
孟加拉红培养基的制备:按照36.7 g 孟加拉红培养基加入1 L 蒸馏水的比例配制,121 ℃高压灭菌15 min,置于(55±1)℃恒温水浴锅中。
1.3.5 微生物的测定 菌落总数用平板计数培养基测定,根据GB 4789.2-2016 《食品安全国家标准 食品微生物学检验 菌落总数测定》 中的相关操作进行。

表1 复合果汁感官评价表Table 1 Sensory evaluation form of composite juice
霉菌和酵母数用孟加拉红培养基测定,根据GB 4789.15-2016 《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》中的相关操作进行。
为保证试验数据准确性,试验结果均为2 个平行、3 组重复数据平均所得。
1.3.6 pH 值的测定 将待测的果汁摇匀,取30 mL 于烧杯中,使用pH 计在室温下测定pH 值,待示数稳定后读数。每个样品重复测定3 次。
1.3.7 色差的测定 采用色差仪,在室温条件下,先用黑板和白板对色差仪校正,将样品摇匀置于比色皿中,选取Hunter Lab 测试系统,在反射模式下测定L*,a*,b*值。其中:L*表示亮度;a*>0,表示红色程度,a*<0,表示绿色程度;b*>0,表示黄色程度,b*<0,表示蓝色程度。通过以下公式计算ΔE:
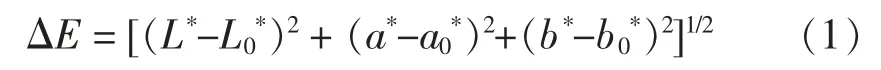
式中,ΔE——总色差;L*——处理后果汁亮度值;L0*——处理前果汁亮度值;a*——处理后果汁红色值;a0*——处理前果汁红色值;b*——处理后果汁黄色值;b0*——处理前果汁黄色值。
1.3.8 可溶性固形物的测定 采用阿贝折射仪测定可溶性固形物(Total soluble solids,TSS)含量。用蒸馏水对仪器校零。测量时用一次性塑料滴管取果汁,滴2 滴于棱镜上测量,每次测量后都用蒸馏水清洗。每个样品重复测定3 次。
1.3.9 抗坏血酸的含量测定 参照GB 5009.86-2016 《食品安全国家标准 食品中抗坏血酸的测定》中的第三法,略做修改。
样品前处理:准确称1.25 g 果汁于烧杯中,用草酸溶液(20 g/L)将果汁转移至25 mL 容量瓶,并稀释至刻度,摇匀后倒入离心管中,加入约5 g 高岭土,于4 ℃,10 000 r/min 条件下离心5 min,取上清液备用。
标定方法:准确吸取1 mL 抗坏血酸标准溶液(1.000 mg/mL)于50 mL 锥形瓶中,加入10 mL 草酸溶液(20 g/L),摇匀,用2,6 -二氯靛酚溶液滴定至粉红色,保持15 s 不褪色为止。同时另取10 mL 草酸溶液做空白试验。
抗坏血酸含量的测定:准确吸取10 mL 上清液于50 mL 锥形瓶中,用标定过的2,6-二氯靛酚溶液滴定,直至溶液呈粉红色15 s 不褪色为止,同时做空白试验。
结果计算:试样中L(+)-抗坏血酸含量计算公式如下:

式中,X——试样中L(+)-抗坏血酸含量,mg/100g;V——滴定试样所消耗2,6-二氯靛酚溶液的体积,mL;V0——滴定空白所消耗2,6-二氯靛酚溶液的体积,mL;T——2,6 -二氯靛酚溶液的滴定度,即每毫升2,6-二氯靛酚溶液相当于抗坏血酸的质量,mg/mL;A——稀释倍数;m——试样质量,g。
试验结果以2 个平行、3 个重复测定结果的算术平均值表示,结果保留3 位有效数字。
1.3.10 总酚的含量测定 参照Cao等[4]的方法略作修改。
提取液的制备:取10 mL 果汁,在10 000 r/min,4 ℃条件下离心10 min,取上清液备用。
总酚含量的测定:福林酚试剂用超纯水按体积比1∶9 稀释10 倍,将提取液稀释8 倍,取0.4 mL 与2 mL 稀释的福林酚试剂充分混合,加入1.8 mL 7.5%的Na2CO3溶液,室温下避光反应1 h后,迅速用分光光度计测定波长765 nm 处吸光值,结果用没食子酸物质的量浓度表示,单位为μg/mL。
没食子酸标准曲线的制作:配制质量浓度分别为10,20,40,60,80,100 μg/mL 的没食子酸标准溶液。将0.4 mL 不同质量浓度的没食子酸溶液分别与2 mL 稀释10 倍的福林酚试剂混合后,再加入1.8 mL 7.5% Na2CO3溶液,室温下避光反应1 h 后,迅速用分光光度计测定波长765 nm 处吸光值,绘制标准曲线。
1.3.11 抗氧化能力测定
1)DPPH 自由基清除能力测定 参照Miller等[5]的方法并略作修改。
提取液的制备方法同1.3.10 节。
DPPH 自由基溶液配制:0.1001 g DPPH 自由基标样用甲醇溶解定容50 mL。取7 mL 该溶液定容250 mL,最终浓度即0.14 mmol/L。
DPPH 自由基清除能力测定:取100 μL 果汁提取液加入到4 mL 0.14 mmol/L DPPH 自由基溶液中,常温避光条件下放置45 min,在波长517 nm 处测定吸光值。以100 μL 甲醇加到4 mL DPPH 自由基溶液为对照。DPPH 自由基清除能力用水溶性维生素E 物质的量浓度表示,单位为mmol/L。
水溶性维生素E 标准曲线的制作:用甲醇配制浓度分别为100,200,400,600,800,1 000 μmol/L的水溶性维生素E 标准溶液,分别取100 μL 与4 mL DPPH 自由基溶液常温避光反应45 min,于波长517 nm 处测定吸光值,绘制标准曲线。
2)FRAP 测定 参照Aljadi等[6]的方法,略作修改。
提取液的制备方法同1.3.10 节。
TPTZ 工作液:pH 3.6的醋酸盐缓冲液,10 mmol/L TPTZ 溶液,20 mmol/L FeCl3按体积比10∶1∶1 配制而成。
铁离子还原能力测定:取100 μL 果汁(以蒸馏水为空白对照)加到4 mL TPTZ 工作液中,于37 ℃反应10 min 后,测定其在波长593 nm 处的吸光值。FRAP 用水溶性维生素E 物质的量浓度表示,单位为mmol/L。
水溶性维生素E 标准曲线的制作:采用无水甲醇配制浓度分别为100,200,400,600,800,1 000 μmol/L 水溶性维生素E 标准溶液,分别取100 μL 与4 mL TPTZ 工作液在37 ℃避光反应10 min,于波长593 nm 处测吸光值,绘制标准曲线。
1.3.12 流变特性的测定 参照李静[7]的方法略作修改。
使用旋转流变分析仪测定果汁的流变特性。选用的夹具为锥头式同心圆筒(定子半径=15.00 mm,转子半径=14.00 mm,浸没高度=42.00 mm,间隙=5 920 μm)。测定时使果汁刚刚没过转子,采用循环水系统控制测定温度为25 ℃。测定采用稳态剪切模式,设定剪切速率在10 min 内从1 s-1指数增加到100 s-1,可得表观黏度-剪切速率图。
1.3.13 挥发性香气成分的测定 参照马永昆等[8]的方法略做修改。
固相微萃取:取8 g 果汁,放入15 mL 果汁瓶中,加入2.4 g NaCl,于40 ℃水浴中平衡预热10 min 后萃取30 min,磁力搅拌速度为100 r/min,用萃取针收集果汁香气。
色谱条件:J & W DB-5 石英毛细柱(30 m×0.25 mm,0.25 μm)。进样口温度250 ℃,载气(He)流速1.0 mL/min,以1∶5 分流进样。程序升温:柱初温40 ℃,保持3 min;以12 ℃/min 升至60℃,以6 ℃/min 升至140 ℃,再以20 ℃/min 升至250 ℃,保持5 min。进样5 mL/min,解析5 min。
质谱条件:5973 四极杆质谱仪,检测器温度为280 ℃,电子轰击(EI)离子源,电子能量为70 eV,电子倍增电压为1 353 V,离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围50~550 amu。
1.3.14 酶活性测定
1)PPO 酶活性测定 参照徐增慧[9]的方法略作修改。
提取液的制备:将4 g 果汁与8 mL 提取液(含4 mg/mL PVPP,pH 6.5,0.2 mol/L 磷酸缓冲液)混合均匀,在4 ℃下静置1 h 后,于10 000 r/min,4 ℃条件下离心15 min,取上清液为酶粗提液。
样品测定:采用分光光度法,反应底物为2 mL 0.5 mol/L 邻苯二酚溶液(用pH 6.5,0.2 mol/L的磷酸缓冲液配制)和1 mL 粗酶液,立即在波长420 nm 处测定吸光值随时间的变化曲线,扫描时间间隔为0.1 s,测定时间为1 min,曲线开始变化的直线部分用于酶活计算。
2)POD 酶活性测定 参照徐增慧[9]的方法略做修改。
提取液的制备:同1.3.14 节1)。
样品测定:采用分光光度法,反应底物为2.2 mL 体积分数为1.0%的愈创木酚(用pH 6.5,0.2 mol/L 的磷酸缓冲液稀释)与0.2 mL 质量分数为1.5%的过氧化氢混合物。向底物中加入1 mL 粗酶液,立即在波长470 nm 处测定吸光值随时间的变化曲线,扫描时间间隔为0.1 s,测定时间为1 min,曲线开始变化的直线部分用于酶活计算。
3)LOX 酶活性测定 参考肖建等[10]的方法,稍作修改。
亚油酸底物配制:反应底物为60 μL 亚油酸,120 μL Tween 20 和4 mL 蒸馏水的混合液,向混合液中加入60 μL 5 mol/L NaOH 溶液,充分振荡使其澄清,定容25.00 mL,于4 ℃冷藏备用。
提取液的制备:取3.0 mL 果汁和3.0 mL 磷酸缓冲液(0.05 mol/L,pH 6.8)于离心管内,在0 ℃下浸提30 min,然后在2 ℃,10 000 r/min 的条件下离心10 min,取上清液于4 ℃保存。
样品测定:酶反应体系包括2.7 mL 硼酸缓冲液(0.05 mol/L,pH 9.0),0.1 mL 亚油酸溶液和0.2 mL 酶液。以硼酸缓冲液为空白对照。反应体系在(20±1)℃的条件下,立即在波长234 nm 处测定吸光值随时间的变化曲线,扫描时间间隔为0.1 s,测定时间为1 min,曲线开始变化的直线部分用于酶活计算。
1.3.15 数据分析 试验结果以均值±标准误差(Mean±S)表示。为保证试验结果的可靠性,所有试验均进行3 次重复。用Statistical Product and Service Solutions 17.0 统计软件,对数据进行方差分析,P<0.05 表示差异显著,P>0.05 表示差异不显著。用Origin 2018 软件画图。
2 结果与分析
2.1 复合比例对果汁感官评价的影响
果汁制备后,立即请15 名评价员进行感官评价,结果如表2所示。在口感方面,16∶3∶1 配比得分显著高于4∶5∶1 和14∶5∶1 配比,与5∶4∶1 和12∶7∶1 配比没有显著性差异;在组织状态方面,16∶3∶1 配比得分显著高于4∶5∶1,5∶4∶1,12∶7∶1配比,与14∶5∶1 配比无显著性差异;在色泽和风味方面,16∶3∶1 配比得分与其它配比均没有显著性差异;在总分方面,16∶3∶1 配比总分显著高于其它配比。经综合考虑,最终确定复合果汁最佳配比为m苹果汁∶m石榴汁∶m布朗李浆=16∶3∶1,后续试验均以此比例制作复合果汁样品。

表2 不同复合比例果汁的感官评价结果Table 2 Sensory evaluation results of different proportions of composite juice
2.2 超高压处理条件对复合果汁中微生物的影响
由表3可知,未处理组果汁菌落总数为(3.36±0.06)lg(CFU/mL),霉菌和酵母数为(2.85±0.04)lg(CFU/mL)。经HHP 处理后果汁的菌落总数降至2.19 lg(CFU/mL)以下,霉菌和酵母数降至2.63 lg(CFU/mL)以下。这些结果说明HHP 处理能够显著降低果汁中的微生物数量。文献中也有类似结果,例如,Mckay等[11]于20 ℃,600 MPa/1 min 条件下处理的苹果汁以及Kim等[12]用400 MPa/5 min 处理的熟柿子汁中均没有检测出微生物;Liu等[13]于20 ℃下将黄瓜清汁经500 MPa/5 min 处理后,菌落总数由(3.88±0.13)lg(CFU/mL)降至(0.70±0.10)lg(CFU/mL),霉菌和酵母未检出。
在相同的处理压力条件下,菌落总数和霉菌酵母的数量均随灭菌时间的增加而减少;类似的,在相同的处理时间条件下,微生物数量随处理压力的增加而减少,说明增加HHP 处理的压力或时间能够有效地增强杀菌效果。Mecnun等[14]于20 ℃下将红葡萄汁分别在150,200,250 MPa 下处理5,10,15 min,发现随着压力升高以及时间的延长,红葡萄汁中的残存菌落呈下降趋势,与本试验结果相同。
果汁经400 MPa/5 min,500 Pa/1 min,500 MPa/3 min,500 MPa/5 min 处理后,样品中菌落总数以及霉菌和酵母的数量符合 《GB 7101-2015食品安全国家标准 饮料》对菌落总数以及霉菌和酵母数量的要求,因此筛选出这些HHP 处理条件进行后续品质影响研究。另外,80 ℃/2 min 的热处理也能够达到国标的微生物数量要求,且与HHP处理的杀菌效果基本相当,可用于后续的品质比较研究。
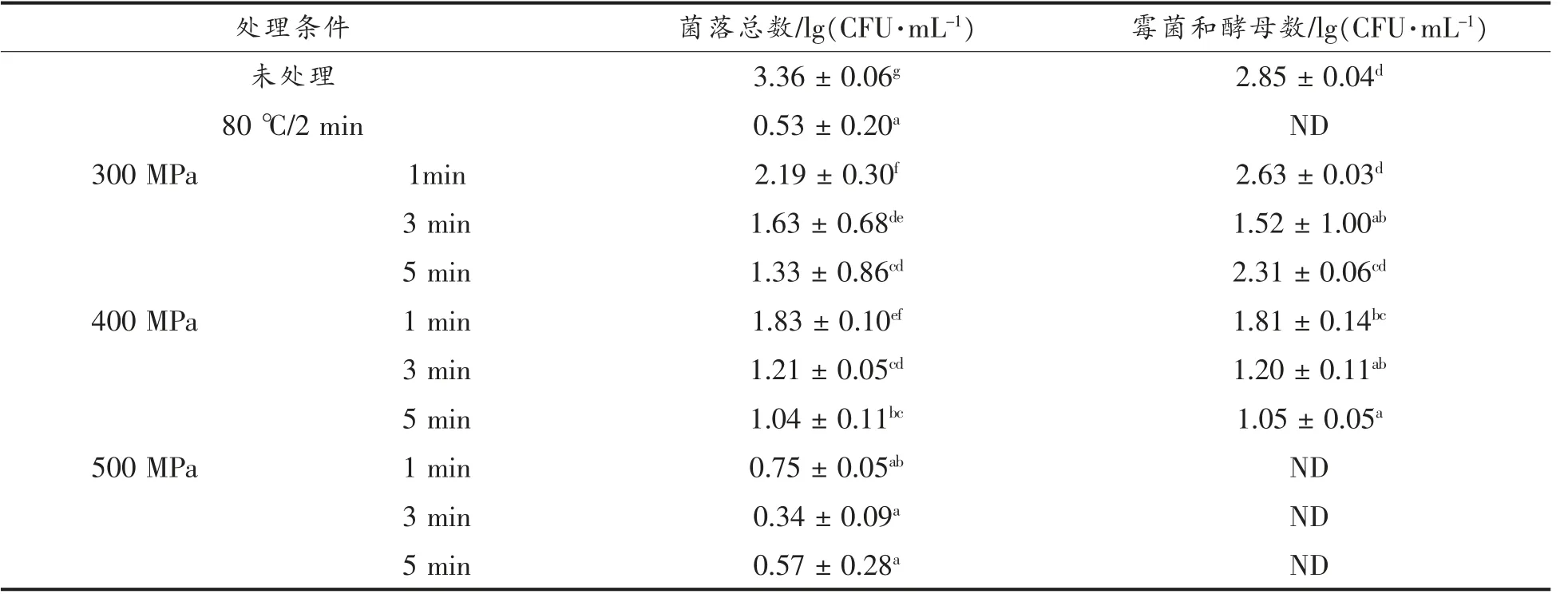
表3 不同HHP 处理条件对复合果汁菌落总数以及霉菌和酵母的影响Table 3 Effects of different HHP treatments conditions on the total aerobic bacteria and mold and yeast of composite juice
2.3 超高压处理对复合果汁品质的影响
2.3.1 对pH 值,TSS 和色泽的影响 处理前、后果汁pH 值,TSS 和色泽的变化如表4所示。未处理组果汁的pH 值,TSS 分别是3.79,12.7°Brix。与未处理组相比,HHP 处理和热处理后果汁的pH值和TSS 变化不显著(P>0.05)。该研究结果与徐玉娟等[15]的研究一致,HHP 处理对荔枝汁pH 值和TSS 的影响不显著。Chen等[16]研究绿竹笋汁经不同条件的HHP 处理及热处理后,其pH 值和TSS 也均未发生显著性变化。
与未处理组相比,HHP 处理后果汁的L*值无显著性变化(P>0.05),热处理后果汁的L*值显著上升(P<0.05)。然而,除500 MPa/1 min 处理组,HHP 处理组和热处理组果汁的L*值无显著性差异。与未处理组相比,HHP 处理和热处理后果汁的a*值均显著上升(P<0.05),而HHP 处理组和热处理组果汁的a*值则无显著性差异(P>0.05)。HHP 处理和热处理后果汁的红色程度显著上升,可能是由于处理会促进花色苷等呈红色的物质溶出[17]。与未处理组相比,HHP 处理和热处理后果汁的b*值均未发生显著性变化(P>0.05)。
一般认为当ΔE≥2 时,色泽差别可以被人的视觉所分辨,当ΔE<2 时,色泽变化肉眼不可分辨[18]。就总体颜色变化而言,HHP 处理和热处理后果汁的ΔE 值均小于2,说明HHP 和热处理不会使果汁发生肉眼可分辨的颜色变化。然而,HHP处理后果汁的ΔE 值小于热处理,说明HHP 处理对果汁色泽的保持效果比热处理好。
色差的产生可能是由酶促褐变[19]或呈色物质降解[20]引起的,对于HHP 和热处理来说,原因可能不尽相同。其中,HHP 处理后样品的PPO 和POD 残存酶活性较高(图2),使得HHP 处理组样品更容易发生酶促褐变,生成黄褐色物质,从而增加样品的ΔE 值;而热处理后样品的PPO 和POD残存酶活性很低,因此呈色物质的降解是热处理组样品ΔE 值增加的主要原因。热加工很容易引起花色苷的降解褪色,花色苷降解的机理可能是花色苷的C3糖苷首先水解,然后花色苷苷元发生水合反应生成花色苷的假碱形式,再异构化生成查耳酮及其同分异构体α-二酮[21]。

表4 超高压处理和热处理对复合果汁pH 值,TSS 和色泽的影响Table 4 Effects of HHP and heat treatment on pH,TSS and color of composite juice
2.3.2 对总酚、抗坏血酸和抗氧化能力的影响由表5可知,与未处理组相比,HHP 处理后复合果汁的总酚含量显著下降(P<0.05),热处理后复合果汁总酚含量没有显著性变化(P>0.05),然而HHP 处理组和热处理组之间的总酚含量没有显著性差异(P>0.05)。热处理后总酚含量的下降可能主要是高温作用的结果,而HHP 处理后总酚含量的下降则主要是由PPO 和POD 残存酶活性引起的。酚类物质热不稳定,高温短时处理可能使得部分酚类物质降解,而低于1 000 MPa 的超高压处理只作用于食品成分的非共价键,不会破坏共价键,因此对食品中的小分子物质如酚类等的影响较小[22]。
与未处理组相比,400 MPa/5 min,500 MPa/1 min,500 MPa/3 min 处理后样品的抗坏血酸含量无显著性变化(P>0.05),而80 ℃/2 min 处理后抗坏血酸含量显著下降(P<0.05)。HHP 处理组和热处理组的抗坏血酸含量没有显著性差异(P<0.05)。该研究结果与Gao等[23]的研究结果一致,将红葡萄柚汁分别经550 MPa/10 min 和110 ℃/8.6 s 条件处理后,抗坏血酸含量均显著下降,而HHP 处理组和热处理组的抗坏血酸含量没有显著性差异。HHP 处理使抗坏血酸含量减少的原因主要是超高压处理将外界的氧气压入了食品体系中,同时增加了其与抗坏血酸的接触,使抗坏血酸发生了氧化损失[24-25]。然而,有文献报道称,HHP 处理对抗坏血酸的保存优于热处理,如Chen等[16]将绿竹笋汁分别在200,400,600 MPa下处理10,20 min 和121 ℃下处理3 min 后,HHP 处理组的抗坏血酸含量均显著高于热处理组。这些研究结果的不统一,可能与样品组分和处理条件的差异有关。
与未处理组相比,HHP 处理和热处理后样品的DPPH 自由基清除能力均显著下降(P<0.05),然而除500 MPa/3 min 处理组外,HHP 处理组样品的DPPH 自由基清除能力均显著高于热处理组(P<0.05)。类似的,与未处理组相比,经HHP 和热处理后样品的FRAP 均显著下降(P<0.05),而除500 MPa/5 min 处理组外,HHP 处理组样品的FRAP 均显著高于热处理组(P<0.05)。因此,与热处理相比,HHP 处理可以更好地保持样品的抗氧化能力。该研究结果与林甜甜[26]的研究结果一致,将甜橙彩椒汁分别经550 MPa/5 min 和110 ℃/8.6 s 的条件处理后发现,HHP 处理对其FRAP 没有显著影响,而热处理显著降低了其FRAP。

表5 超高压和热处理对复合果汁总酚、抗坏血酸和抗氧化能力的影响Table 5 Effects of HHP and heat treatment on total phenolic,ascorbic acid and antioxidant capacity of composite juice
2.3.3 对流变特性的影响 由图1可知,随着剪切速率的增加,复合果汁黏度逐渐降低,呈现典型的剪切稀化特征,属于假塑型流体,且HHP 处理和热处理均没有改变样品的流体类型。Zou等[27]将桑葚汁分别经500 MPa/5 min 和110 ℃/8.6 s 处理后流体类型也均未改变。
由图1a可知,与未处理组相比,500 MPa/1 min 和500 MPa/3 min 处理,使果汁的剪切应力上升;80 ℃/2 min 处理使果汁的剪切应力下降。由图1b可知,与未处理组相比,HHP 处理使果汁的黏度略有上升,热处理使果汁的黏度略有下降,该结论与前人研究结果一致。张文佳等[28]研究发现,在不同条件HHP 处理后,树莓汁在30 s-1剪切速率下黏度均显著上升,而热处理后树莓汁在此剪切速率下黏度下降,说明HHP 处理后树莓汁黏度增加可能是由于高压增加了果胶物质从细胞壁向果汁中的溶出。此外,曹霞敏等[17]研究也发现草莓浊汁经HHP 处理后黏度呈增加趋势,而经高温短时杀菌处理后草莓浊汁黏度显著减小,说明高温短时杀菌后草莓浊汁黏度降低可能是发生了果胶的β-消除反应,导致果胶链断裂、降解。
2.3.4 对挥发性香气成分的影响 经SPME-GC/MS 分析鉴定,未处理组果汁中共有19种挥发性香气成分,主要由酯类、醇类、酮类、醛类和烯类组成。含量最多的是丁酸乙酯(30.13%),其次是1-己醇(20.37%)。另外,2-甲基-1-丁醇、2-甲基丁酸乙酯、反式-2-己烯醛的含量也较为丰富。
热处理后果汁中共有19种挥发性香气成分,其中含量最多的2种不变,增加了丁酸甲酯、2-甲基丁酸甲酯和6-甲基-5-庚烯-2-酮,减少了丁酸丁酯、3,7,11-三甲基-1,3,6,10-十二碳-四烯和棕榈酸乙酯。丁酸甲酯、2-甲基丁酸甲酯和6-甲基-5-庚烯-2-酮都具有果香特征;丁酸丁酯、3,7,11-三甲基-1,3,6,10-十二碳-四烯和棕榈酸乙酯也具有果香特征。HHP 处理后果汁中的挥发性香气成分变为15~22种不等,其中含量最多的2种均未发生变化。由图2可知,HHP 和热处理均未有效钝化果汁中的LOX,这可能是引起挥发性香气成分变化的原因。
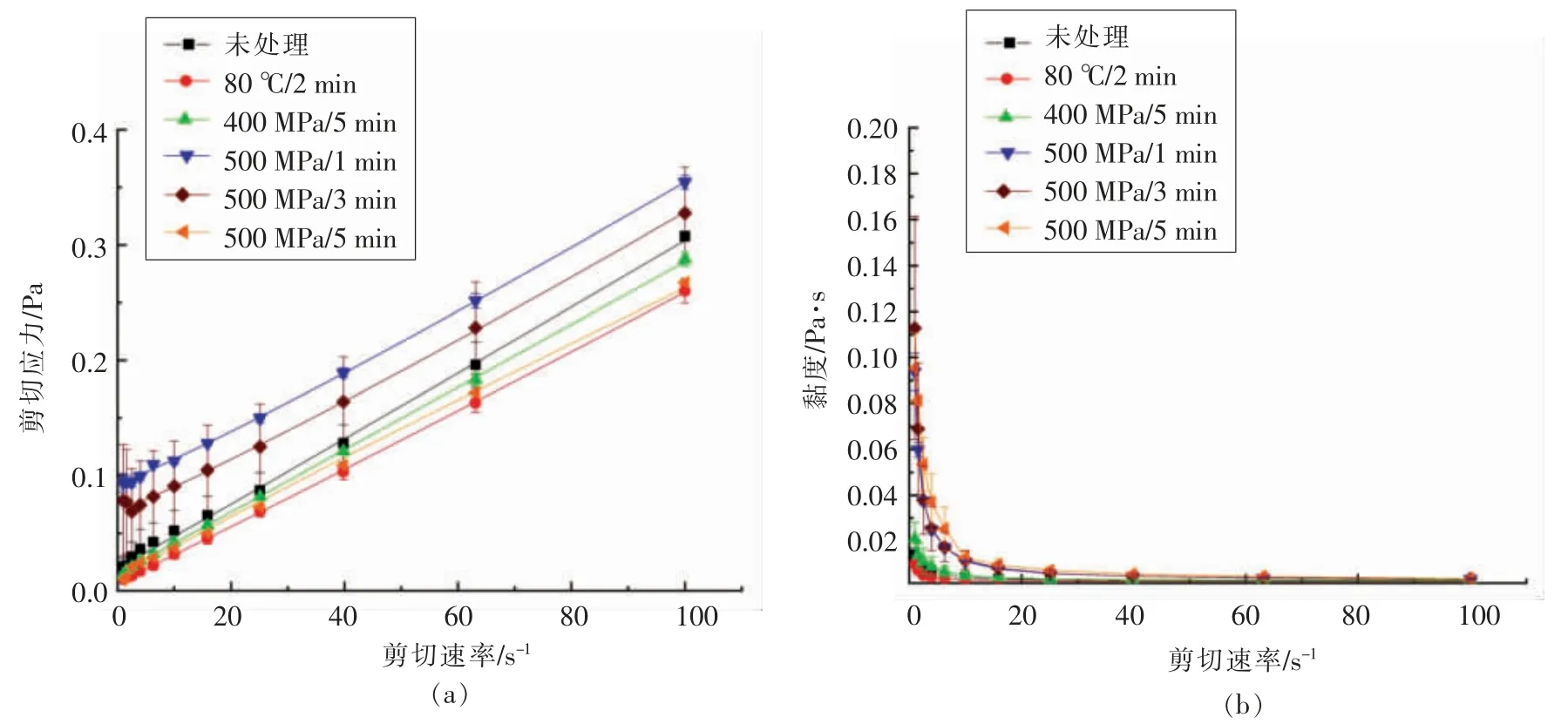
图1 超高压和热处理对复合果汁流变特性的影响Fig.1 Effects of HHP and heat treatment on rheological properties of composite juice

表6 不同处理条件的复合果汁挥发性香气成分一览表Table 6 List of volatile aroma components for composite juice with different treatments
综合李静[7]、亦志英等[29]、李维妮等[30]的研究成果,主要选择丁酸乙酯、乙酸丁酯、2-甲基丁酸乙酯、反式-2-己烯醛、丁酸丙酯、己酸丁酯和乙酸己酯7种果汁中最具代表性的香气成分研究HHP处理和热处理对果汁挥发性香气成分的影响,如表7所示。各香气物质对果汁香气的贡献程度可以用香气活力值(Odpr activity value,OAV)来表示。本款复合果汁中,80%为苹果汁。Valappil等[31]在研究中得出苹果中OAV 较高的物质有乙酸己酯、2-甲基丁酸乙酯以及反式-2-己烯醛等。与未处理组相比,80 ℃/2 min,400 MPa/5min,500 MPa/1 min,500 MPa/3 min,500 MPa/5 min 处理均使乙酸己酯、反式-2-己烯醛含量下降,然而热处理组比HHP 处理组的存留率高;80 ℃/2 min,400 MPa/5 min,500 MPa/1 min 处理使2-甲基丁酸乙酯含量上升,500 MPa/3 min,500 MPa/5 min 处理使2-甲基丁酸乙酯含量下降。乙酸丁酯和丁酸丙酯是苹果煮熟味的重要呈香物质[7],与未处理组相比,80 ℃/2 min,400 MPa/5min,500 MPa/1 min 处理使乙酸丁酯和丁酸丙酯的含量上升,且80 ℃/2 min处理比400 MPa/5min 或500 MPa/1 min 处理上升的幅度大;500 MPa/3 min 或500 MPa/5 min 处理使2种物质的含量下降。丁酸乙酯和己酸丁酯都使果汁具有良好的芳香气味,与未处理组相比,80℃/2 min,400 MPa/5 min,500 MPa/1 min 处理均使丁酸乙酯含量上升,500 MPa/3 min,500 MPa/5 min处理均使丁酸乙酯含量下降;热处理和HHP 处理均使乙酸丁酯含量上升。
综上所述,HHP 处理和热处理都会使果汁的挥发性香气成分发生变化。通过对典型香气成分的分析发现,400 MPa/5min,500 MPa/1 min 的HHP 处理及热处理都使有利香气成分增多,然而热处理使果汁的蒸煮味更强,这可能会影响果汁的风味。
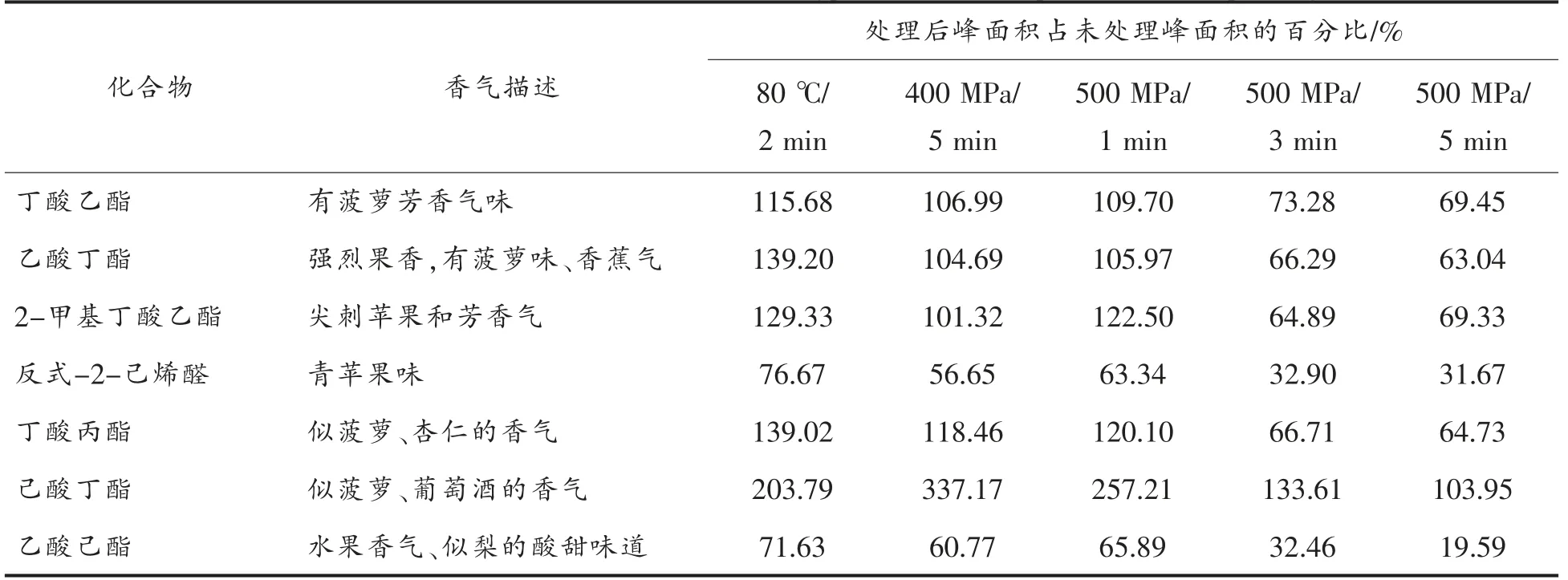
表7 超高压和热处理对复合果汁中典型香气成分的影响Table 7 Effects of HHP and heat treatment on typical aroma components in composite juice
2.3.5 对内源酶活性的影响 HHP 处理和热处理对复合果汁中PPO,POD,LOX 酶活性的影响,如图2所示。经热处理后样品中PPO,POD,LOX活性显著下降,残存酶活约为15.35%,7.29%,45.00%,而HHP 处理后果汁中PPO,POD,LOX 的残存酶活仍较高,分别在65.13%~76.97%,75.00%~85.42%和75.00%~85.00%之间,且不同HHP 处理组之间残存酶活无显著性差异(P>0.05)。由此可知,HHP 处理并不能有效钝化PPO,POD,LOX酶活性。徐增慧等[32]发现桃汁经400 MPa/2.5 min处理后,PPO 和LOX 残存酶活均有90%左右。Chang等[33]发现白葡萄汁经600 MPa/3 min 处理后,PPO 残存酶活为51.20%,POD 残存酶活为52.10%。PPO,POD,LOX 酶活性与样品中色泽、酚类、香气成分等品质的变化有很大关系,HHP 处理并不能有效钝化PPO,POD,LOX 酶活性,这使得HHP 处理后样品的品质变化主要为残存酶活的作用。后续还应继续研究钝化内源酶活性。

图2 超高压和热处理对复合果汁中PPO,POD,LOX酶活性的影响Fig.2 Effects of HHP and heat treatment on PPO,POD and LOX enzyme activities in composite juice
3 结论
本研究筛选出复合果汁的最佳配方为m苹果汁∶m石榴汁∶m布朗李浆=16∶3∶1。试验发现经HHP 处理能显著降低果汁中微生物的数量,且400 MPa/5 min,500 MPa/1 min,500 MPa/3 min,500 MPa/5 min处理后微生物指标均能够满足国家标准的要求。与热处理相比,HHP 处理能够更好地保持果汁的抗氧化能力及流变特性。HHP 和热处理后复合果汁的挥发性香气成分均发生改变,然而热处理后蒸煮味成分含量增加更多。HHP 处理对复合果汁中内源酶活性的钝化效果较差,后续应继续在酶活性钝化上进行优化。例如可以将热烫预处理和HHP 处理相结合,达到钝化内源酶活性,稳定果汁品质的目的。此外,还应进一步研究贮藏期间超高压复合果汁中微生物及品质的变化,获得相应变化规律,从而确定产品货架期。

