对苯二酚对海洋底栖双壳类毛蚶和紫贻贝毒性效应研究
毛成责,魏爱泓*,姜晟,周超凡,矫新明,袁广旺,郑江鹏,王长友
(1.江苏省环境监测中心,江苏省海洋环境监测预报中心,江苏 南京 210019;2.江苏省海涂研究中心,江苏 南京 210036;3. 南京信息工程大学海洋科学学院,江苏 南京 210044)
随着人类工业的不断发展,苯系物及其衍生物被广泛开发并运用到人类生产活动中,给人们的生产和生活带来了很多便利,但同时这些有毒有害化合物也通过生产和生活废水、废气、爆炸和泄露等途径被大量排入土壤、水及大气环境中,给生态系统和人类健康带来了不利影响[1-2]。
对苯二酚是一种常见的苯系物,也是苯的主要代谢物,溶于水,易溶于乙醇和乙醚,被广泛应用于摄像造影剂、染料中间体、橡胶及食品抗氧化剂、机动车燃料、美白化妆品及除藻剂等众多生产生活领域,故其在生态系统中的分布相当广泛[1,3-4]。国内外大量研究表明,酚类化合物在10-6级就会对水生生物产生极大毒性,在10-9级就能影响鱼类和甲壳类的感觉器官[5-6]。而对苯二酚则对链带藻属(Desmodesmusspp.)、集胞藻属(Synechocystisspp.)、念珠藻属(Nostocspp.)、铜绿微囊藻(Microcystisspp.)、褶皱臂尾轮虫(Brachionusplicatilis)、大型溞(Daphniamagna)、黑头呆鱼(Pimephalespromelas)、斑马鱼属(Brachydaniosp.)等多种水生生物具有极强毒性[3,7]。
江河水体中的对苯二酚最终将汇入海洋,其作为普通化工产品出现在国际海运货物中。近年来海上化学品泄漏事故多有发生,海洋生物因此遭受来自陆源和海上的双重威胁,海洋底栖生物等迁移能力较弱的类群将受到较大影响[8-9]。现选取毛蚶(Scapharcasubcrenata)、紫贻贝(Mytilusedulis)为受试生物,通过急性和慢性毒性试验,分析计算对苯二酚对两者的半致死效应浓度(Lethal Concentration 50,LC50)、非检测效应浓度(No Detected Effective Concentration,NDEC) 及无观测效应浓度(No Observed Effective Concentration,NOEC),为对苯二酚的海洋生态风险管理提供科学依据。
1 研究方法
1.1 试验材料
1.1.1 主要试剂
用海水素(益尔牌)配制盐度为20 pus的人工海水,放置1 d后,作为受试生物培养液;对苯二酚为分析纯(购自国药集团化学试剂有限公司);超氧化物歧化酶(SOD)活性检测试剂盒(上海碧云天生物技术有限公司)。
1.1.2 受试生物预处理
采集连云港赣榆区近岸健康且反应灵敏的毛蚶与紫贻贝,以半静水法暂养3~7 d,期间连续充气,每24 h更换水体的一半;经3 d饥饿处理后,第4 d开始每天以贝类软体鲜重的0.6%(约0.1%~0.2%的湿重)投喂螺旋藻粉,至试验前1 d停止投饵[10-11]。试验中选择大小基本一致、健康且反应灵敏的个体随机分组。
1.2 试验方法
1.2.1 急性毒性试验
在玻璃水槽(37cm×27 cm×20 cm)内注入培养液5 L,随机投放经24 h饥饿处理的毛蚶/紫贻贝15只。其中,毛蚶平均体长2.28 cm(2.16~2.40 cm),平均体质量4.0 g(3.8~4.5 g);紫贻贝平均体长5.20 cm(5.06~5.42 cm),平均体质量14.2 g(13.1~15.5 g);年龄约10个月。试验期间室温为14~22℃,水温为17~21℃,人工海水pH值为7.8~8.0, 溶解氧为9.0~10.2 mg/L。
在预试验结果基础上设5个对苯二酚浓度梯度(C1—C5),天然海水做空白对照(C0),每组设双平行(表1)。进行96 h急性毒性试验,每24 h更换一半水体,补充试剂至初始浓度并记录死亡率,死亡界定参考《GB/T 29881—2013》[11]。
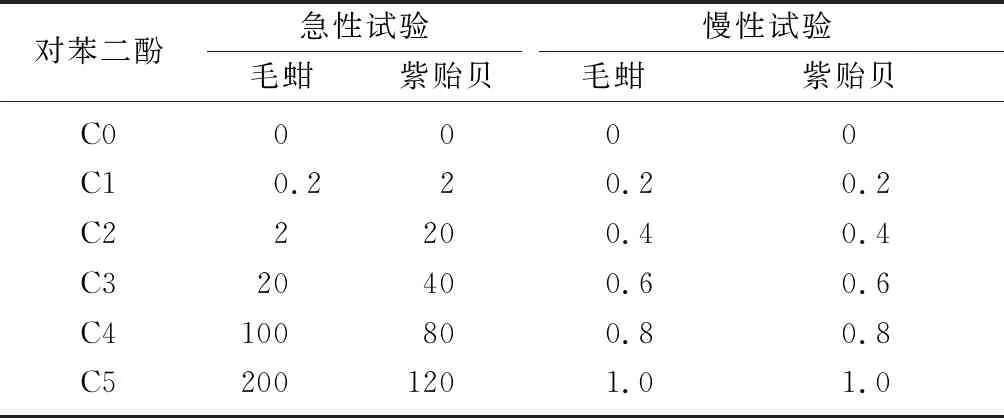
表1 毒性效应试验对照组及处理组对苯二酚浓度 mg/L
1.2.2 慢性毒性试验
在水槽中随机投放与急性试验相同处理的毛蚶、紫贻贝各40只。毛蚶平均体长2.85 cm(2.78~2.92 cm),平均体质量7.2 g(6.7~7.8 g);紫贻贝平均体长5.05 cm(4.85~5.15 cm),平均体质量12.8 g(11.5~14.0 g)。
根据急性试验结果设置5个对苯二酚浓度梯度和1个海水空白对照,每组双平行(表1)。每天于固定时间投喂螺旋藻粉1次(投喂量与预处理相同),其余条件同急性试验。于试验开始第5,9,13,17和21 d及结束时,测定个体湿重(精度0.01 g)和体长(精度0.01 mm)。
试验开始后第4,8,12,16和20 d取样,每组随机抽取2只,用于测定蛋白质含量及SOD活性,期间观察各组有无个体死亡。
1.2.3 消化腺SOD活性检测
取受试生物消化腺,冰浴匀浆,4℃离心后取上清液,按试剂盒说明书(WST-8法)严格操作。
1.3 数据分析方法
1.3.1 LC50
LC50是指在一定时间内,实验系统中或某一生态系统中50%的实验生物或某一生物种群表现出可观察到死亡时污染物浓度[12-14]。
采用Log-logistic模型计算LC50及其置信区间[15]。
(1)
式中:LC50——半致死浓度,mg/L;
y——效应指标;
c——污染物质量浓度;mg/L;
a和b——模型形状参数。
1.3.2 非效应浓度
1.3.2.1 NOEC
NOEC是指与空白对照无显著性差异的最高实验浓度(显著性水平α通常取5%)[12,15]。研究应用单因素方差分析检验慢性毒性试验各组组间方差与组内方差的显著性;应用配对多重比较(Games-Howell和Dunnett’s T3)检验处理组与对照组的均数差异,根据检验结果确定受试生物慢性毒性实验的NOEC。
1.3.2.2 低效应浓度
ECx是指与空白对照相比,能使效应指标(如生存率、生物量、生长率等)减少x%的污染物浓度[12]。经济合作与发展组织(Organization for Economic Cooperation and Development,OECD)、国际环境毒理学和化学学会(International Society For Environmental Toxicology And Chemistry,SETAC)建议用EC05或EC10置信区间的下限作为生态安全暴露基准浓度[16-17]。
采用Log-logistic模型计算受试生物EC05及其置信区间。
(2)
式中:y——效应指标;
c——污染物浓度,mg/L;
x——效应百分数;
a——c=0时的效应指标;
ECx——低效应浓度,mg/L;
b——模型形状参数。
1.3.2.3 阈值浓度
应用weibull毒性效应阈值模型计算受试生物急性毒性效应阈值浓度[18]。
y=y0e-a(cb-csb)
(3)
式中:y——效应指标;
c——污染物浓度;mg/L;
Cs——阈值浓度,mg/L;
y0——c=0时的效应指标;
a和b——模型形状参数。
2 结果分析
2.1 急性毒性效应
以对苯二酚质量浓度为横坐标,96 h存活个体数为纵坐标,绘制毛蚶与紫贻贝存活个体数变化曲线。结果表明,对苯二酚对毛蚶与紫贻贝具有一定毒性,ρ>0.2 mg/L即造成毛蚶死亡,>20 mg/L在96 h内致半数毛蚶死亡[ρ(96 h LC50)=20 mg/L];ρ>2 mg/L即造成紫贻贝死亡,ρ>80 mg/L在96 h内致半数紫贻贝死亡[ρ(96 h LC50)=80 mg/L],见图1(a)(b)。

图1 毛蚶、紫贻贝96 h存活数随对苯二酚质量浓度变化曲线
2.2 体长及体重变化
第0,5,9,13,17和21 d毛蚶、紫贻贝平均体质量、平均体长测量结果显示,处理组与对照组组内与组间无显著差异(P>0.1)。
对比试验21 d和试验0 d毛蚶的平均体质量变化情况,C0组(0 mg/L)、C1组(0.2 mg/L)21 d比0 d略有增长,其余各组均略有下降,其中C5(1.0 mg/L)降幅较明显;对比试验21 d和试验0 d时毛蚶平均体长变化情况可知,除C2(0.4 mg/L)组21 d比0 d略有增长,其余各组均略有下降,其中C3(0.6 mg/L)组降幅较明显,见图2(a)(b)。

图2 对苯二酚对毛蚶平均体质量、平均体长的影响
对比试验21 d和试验0 d紫贻贝的平均体质量变化情况,C0(0 mg/L)组、C5(1.0 mg/L)组21 d比0 d略有下降,其余各组均略有增长,其中C0(0 mg/L)降幅较明显;对比试验21 d和试验0 d紫贻贝的平均体长变化情况,除C4(0.8 mg/L)组21d比0 d略有增长,其余各组均略有下降,其中C0(0 mg/L)、C2(0.4 mg/L)组降幅较明显,见图3(a)(b)。

图3 对苯二酚对紫贻贝平均体质量的影响
2.3 消化腺SOD活性的变化
2.3.1 毛蚶
不同时间点取毛蚶样本的SOD检测结果显示,各处理组组内与组间测定值差异不显著(P>0.05),见图4。

图4 对苯二酚对毛蚶消化腺SOD活性的影响
多重比较和Dunnett’s T3检验显示,试验第4 d,C1、C3、C4、C5分别为C0的90.7%,80.3%,98.3%和92.1%,仅C3显著降低(P<0.05),C2为C0的 108.4%,差异不显著(P>0.05);第8d,C1—C5分别为C0的115.4%,107.4%,123.7%,130.9%和115.6%,差异不显著(P>0.1);第12 d,C1、C4分别为C0的83.1%和73.5%,C2、C3、C5分别为C0的106.1%、113.5%和116.5%,差异不显著(P>0.1);第16d,C3为C0的99.4%,C1、C2、C4、C5分别为C0的118.0%,109.0%,114.8%和113.3%,差异不显著(P>0.1);第20 d,C1、C2、C4分别为C0的70.9%,96.1%和72.9%, C3、C5分别为C0的109.9%和107.8%,差异不显著(P>0.1)。
同组不同时段SOD 活性变化各不相同,C1、C3、C4与C0比值呈减小增大再减小趋势;C2与C0比值呈逐渐减小趋势;C5与C0比值呈逐渐增大趋势。由此可见,高浓度组诱导的SOD 活性积分值大于低浓度组。
2.3.2 紫贻贝
不同时间点取紫贻贝样本的SOD检测对苯二酚浓度见图5。试验第16 d各处理组组间差异显著(P<0.05),其余4次抽检组内与组间差异不显著(P>0.05)。多重比较与Dunnett’s T3检验显示,第4 d,C1、C2、C4、C5分别为C0的108.3%,105.3%,116.9%和119.3%,C3为C0的 93.6%,差异不显著(P>0.05);第8 d,C1、C2、C4、C5分别为C0的83.1%,82.8%,78.4%和89.6%,C3为C0的 107.3%,差异不显著(P>0.1);第12 d,C1—C5分别为C0的74.0%,93.2%,70.4%,82.2%和77.1%,差异不显著(P>0.1);第16 d,C1为C0的100.4%, C2—C5分别为C0的77.2%,79.2%,58.3%和68.7%,其中C4、C5与C0差异显著(P<0.05);第20 d,C1—C5分别为C0的98.4%,94.8%,96.6%,89.9%和87.3%,差异不显著(P>0.1)。

图5 对照组与处理组紫贻贝SOD活性变化
同组不同时段 SOD 活性变化亦不相同,C1、C2、C4、C5与C0比值呈先增大后减小趋势,C3与C0比值呈减小增大再减小趋势。综上,高浓度组诱导的SOD 活性积分值小于低浓度组,但响应时间高浓度组早于低浓度组。
2.4 毒性效应浓度
应用模型方程公式(1)—(3)分别计算对苯二酚对毛蚶、紫贻贝的急性毒性效应浓度LC50、EC05、Cs及其bootstrap置信区间,平均吻合度检验(Goodness of Fit)较好(R2>0.9)。通过多重比较和Dunnett’s T3检验处理组与对照组的均数差异,根据检验结果确定NOEC(P< 0.05),见表2。

表2 对苯二酚对毛蚶和紫贻贝的Cs、LC50、EC05 mg/L
Weibull模型为4参数,Log-Logistic模型为3参数,后者收敛性要优于前者,且EC05均值均
3 讨论
3.1 对苯二酚的急性毒性
相关研究表明,对苯二酚对部分细菌、藻类、桡足类及鱼类均具有极强的毒性,对大型溞的ρ(48 h EC50)为0.15 mg/L,对褶皱臂尾轮虫的ρ(24 h LC50)为0.22~0.28 mg/L,对黑头呆鱼的ρ(LC50)为0.10~0.18 mg/L,对明亮发光杆菌的毒性分别为邻苯二酚及间苯二酚100倍和1 000倍[3,5,7,19]。结果显示,对苯二酚对毛蚶与紫贻贝的ρ(LC50)分别为34.1与66.5 mg/L,根据水生生物急性毒性等级分类标准,其对两者毒性等级均为急性毒性3类[10 mg/L<ρ(LC50)<100 mg/L],毒性较低,这可能由于毛蚶及贻贝成体对对苯二酚的耐受性高于其他类群生物,同时也说明两者对于对苯二酚的预警指示作用较弱,后续可选择敏感性较高的贝类幼体或其他类群的底栖动物进行进一步试验研究[11,20-22]。
毛蚶与紫贻贝作为常见的污染物毒性试验受试生物,文献[23-28]分别就重金属离子、有机农药、原油及其提炼物对两者的急性毒性进行了研究。根据典型的96 h试验结果,汞、镉及石油烃对毛蚶的毒性较大,为急性毒性二类[1 mg/L<ρ(96 hLC50)<10 mg/L];燃料油WAF、原油DWAF、氯硝柳胺对紫贻贝的毒性最大,为急性毒性一类[ρ(96 h LC50)<1 mg/L],燃料油DWAF、原油WAF、甲基异硫磷、水胺硫磷对紫贻贝的毒性较大,为急性毒性二类,见表3。
不同的试验条件和分析计算方法对急性毒性试验的结果也存在影响,张艳红等[25]就汞对毛蚶的急性毒性试验结果得出ρ(96 h LC50)为2.07 mg/L,而魏爱泓等[29]的试验结果ρ(96 h LC50)为800.0 μg/L,两者相差1个急性毒性等级。

表3 11种危化品对毛蚶与紫贻贝的96 h半致死浓度(96h LC50) mg/L
3.2 对苯二酚的慢性毒性

研究表明,毛蚶、紫贻贝等海洋底栖贝类在受到重金属、有机农药、多环芳烃及海洋石油污染时,污染物在体内代谢产生的活性氧化物(H2O2及ROS等)会对机体抗氧化系统产生2种效应:在污染物浓度较低或暴露初期,代谢产生的活性氧化物会诱导机体抗氧化系统产生SOD、过氧化氢酶(CAT)、谷胱甘肽巯基转移酶(GST)等抗氧化酶来清除活性氧化物以避免机体细胞受损;随着污染物浓度升高或暴露时间的延长,抗氧化系统将受到严重胁迫而使抗氧化酶的合成受到抑制[23,32-35]。
毛蚶与紫贻贝在对苯二酚的暴露试验中SOD活性变化显示,高浓度诱导积分大于低浓度,且高浓度组SOD的应激反应要早于低浓度,但剂量—效应关系不明显,这可能由于SOD的合成除受活性氧化物诱导外,还受水温、溶解氧及pH值等环境因子和2种受试生物的耐受能力影响;且对苯二酚对生物细胞的代谢和遗传方面均存在着较大的毒性,机体不同组织及器官抗氧化酶合成机制也存在一定的差异,具体规律有待进一步研究[33-38]。
对于对苯二酚的海洋生态风险管理,首先要建立保护各类海洋生物免受其污染损害的阈值浓度,即海水水质基准,包括急性基准与慢性基准,分别以急性与慢性毒性试验数据为依据[39]。由于分布区域、环境理化参数、物种代谢机制等方面的差异,不同类别海洋生物对对苯二酚的敏感性也有着较大的差异,区域海洋生物群落甚至生态系统水平要以海水水质为基准推导,还需要补充浮游植物、浮游动物及鱼类等不同营养级以及具有生态学代表性种类的急性和慢性毒性试验数据,通过物种敏感度分布法(Species Sensitivity Distribution, SSD)进行进一步研究[39-40]。
4 结论
(1)急性毒性试验结果表明,对苯二酚对毛蚶、紫贻贝的ρ(NDEC)分别为0.36和0.50 mg/L,ρ(LC50)分别为34.10和66.50 mg/L。
(2)慢性毒性试验结果表明,处理组与对照组组内与组间体长及体质量无显著差异(P>0.1);SOD酶活性测定结果显示,毛蚶培养试验处理组组内与组间测定值无显著差异(P>0.05),紫贻贝仅在第16 d各处理组组间差异显著(P<0.05)。对苯二酚对毛蚶、紫贻贝的ρ(NOEC)分别为0.40与0.60 mg/L。

