人冠状动脉内半乳糖凝集素3水平与斑块稳定性的相关性研究*
彭 进, 王 玉, 张 琼, 刘江金, 李 竹, 汪家文,夏 冰, 王 杰, 乐翠云, 万昌武
(贵州医科大学法医学院,贵州贵阳550004)
研究显示,冠心病(coronary heart disease,CHD)的发作及心源性猝死(sudden cardiac death,SCD)的发生与粥样斑块结构的稳定性密切相关[1-3],但影响斑块稳定性变化的机制仍不明确,有研究指出炎症反应是影响斑块稳定性的关键因素[4]。
半乳糖凝集素3(galectin-3)属于凝集素家族的一员[5],主要由活化的巨噬细胞产生和分泌,在正常组织中呈现低水平表达[6-10],而在病理状态下,其表达水平显著升高[11]。研究显示,galectin-3能促进动脉粥样硬化(atherosclerosis,AS)的形成和发展,并与心肌缺血的严重性相关[12-14]。动物实验也证实了在小鼠的 AS 斑块中检测到高表达的 galectin-3[15-16],提示galectin-3可能作为一个新的炎症标志物,参与促进CHD的发生和发展。
然而,目前国内外从人体冠状动脉组织层面直接检测galectin-3及其相关因子表达水平的研究鲜见报道。本研究采用尸检案例中的冠脉标本为研究对象,直接检测冠状动脉粥样斑块内galectin-3的表达水平,探讨其表达变化与AS病灶内炎症反应水平和斑块稳定性及与SCD的关系。
材料和方法
1 材料收集
选取贵州医科大学法医司法鉴定中心2014年1月~2018年12月尸检案例的冠状动脉组织标本,并获得贵州医科大学伦理审查委员会认可(审批号为201801),根据是否伴有血栓形成、斑块破裂、斑块内出血等继发病变及死亡原因是否为冠心病猝死,分为3组:A1组,有冠状动脉粥样硬化但非冠心病猝死者,22例;A2组,冠心病猝死但无上述继发病变者,20例;A3组,冠心病猝死且伴有上述任一种继发病变者,24例。选取同期尸检及组织学检验证实冠状动脉无病变且非心源性疾病死亡者18例作为对照(control)组。
病变组案例纳入标准:(1)经解剖的尸体在死亡后48 h内尸检或死后6 h内冰冻保存;(2)经肉眼及组织学检验证实存在AS者,即冠状动脉管壁内膜增厚、管腔变窄,增厚的冠脉内膜见粥样斑块形成,存在或不存在继发病变形成,合并心肌纤维化和心肌梗死等任一病变;(3)系统尸检及常规毒物检测排除暴力致死、中毒死亡及其他疾病致死可能者。对照组案例纳入标准:(1)对照组为实验组同期尸检经肉眼及组织学检验证实无冠状动脉病变者;(2)死亡原因明确为机械性暴力致死或机械性窒息者。案例排除标准:(1)组织自溶或结构不清;(2)患有风湿性心脏病、心肌病和心肌炎等心脏病者;(3)多发全身炎症性感染或多器官功能障碍者。
按照纳排标准,统一选取无任何病变的冠状动脉左前降支作为对照组,病变组标本选取肉眼所见冠脉狭窄程度最严重处,所选组织采用4%甲醛固定,部分组织置于-80℃冰箱冻存供蛋白测定及mRNA检测。
2 主要试剂与仪器
鼠抗CD68单克隆抗体(GeneTex);兔抗galectin-3单克隆抗体和兔抗基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)多克隆抗体(Abcam);PV-9000兔/鼠超敏二步法免疫组织化学检测试剂盒(中杉金桥公司);羊抗鼠/兔IgG(H+L)购自北京索莱宝科技有限公司;RevertAidTM第1链cDNA合成试剂盒(Thermo Fisher)。
光学显微镜(Olympus);NanoDrop 2000型超微量紫外分光光度计(Thermo Fisher);凝胶成像系统(Bio-Rad);7500 Fast型实时荧光定量PCR仪(Applied Biosystems)。
3 主要方法
3.1 冠状动脉组织结构的观察及测量 选取经4%甲醛固定的冠状动脉组织,以血管横断面作常规石蜡包埋,4µm切片后常规HE染色,光镜观察并在100倍下拍照,采用Image-Pro Plus 6.0检测相关指标:(1)冠状动脉内膜厚度:血管内膜(含病灶)腔缘至外侧缘的距离,取最大、最小及随机共3条测试线平均值,即为内膜厚度;(2)纤维帽厚度:病灶表层纤维帽垂直距离,结果取3次测量平均值;(3)坏死灶厚度:量取病灶中从近腔面缘至近外侧缘的最大垂直距离,无坏死灶者计0;(4)血管腔狭窄程度=1-横断面上冠状动脉血管腔的面积/整个血管面积,取3次测量结果平均值,即为血管腔狭窄程度。
3.2 冠状动脉组织中galectin-3、CD68和MMP-2蛋白表达水平的检测 采用Western blot法检测冠状动脉组织内蛋白表达水平。取-80℃保存的血管组织,充分研磨匀浆,离心后取上清液,采用紫外分光光度计测量蛋白浓度,行12%SDS-PAGE,转膜至PVDF膜,5%脱脂牛奶封闭2 h后洗膜,根据目标蛋白分子大小,分别加入Ⅰ抗(galectin-3,1∶5 000;CD68和MMP-2,1∶1 000;β-actin,1∶2 000)于4℃孵育过夜,洗膜后加辣根过氧化物酶(horseradish peroxidase,HRP)标记的Ⅱ抗(羊抗兔IgG,1∶10 000)室温孵育1 h,滴加增强化学发光(ECL)液于化学发光成像系统上显色。以β-actin为内参照,利用ImageJ软件分析测量条带灰度值,以3次测量的均值作为测定结果。
3.3 冠状动脉病灶内galectin-3、CD68和MMP-2的表达与分布观测 采用免疫组织化学法检测冠状动脉病灶内的蛋白表达与分布。经4%甲醛固定后的血管,行常规石蜡包埋,4µm切片,脱蜡,水合。滴加3%H2O2于37℃孵育10 min封闭内源性过氧化物酶,高压热修复抗原 3 min,加Ⅰ抗(galectin-3,1∶200;CD68,1∶150;MMP-2,1∶250),阴性对照选用PBS缓冲液,于4℃孵育过夜。次日加入HRP标记Ⅱ抗(羊抗兔IgG,1∶10 000),37℃恒温孵育50 min后DAB显色,苏木素复染,二甲苯透明,中性树胶封片。显微镜下计数CD68标记的单核巨噬细胞,于400倍镜下选取3个视野拍照,Image-Pro Plus 6.0软件测量平均吸光度(即阳性表达吸光度值/测量总面积)。结果为重复测量3次平均值。
3.4 冠状动脉组织内galectin-3、CD68和MMP-2 mRNA表达水平检测 选取-80℃保存的冠脉组织,采用Trizol法提取总RNA,紫外分光光度计测定RNA浓度,经RevertAidTM逆转录试剂盒逆转录为cDNA后,采用SYBR®Select Master Mix试剂和相应的引物配制成反应体系,采用7500 Fast实时荧光定量PCR仪测量Ct值,并计算目的基因的转录水平。PCR 条件为:50℃ 2 min;95℃ 2 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,40个循环。解离曲线条件为:95℃ 15 s,60℃ 1 min,95℃ 15 s。实验所需的引物遵循引物设计原则,由上海生物工程有限公司合成,序列见表1。
4 统计学处理
采用用SPSS 22.0软件对所得数据分析处理。计量资料采用均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析;计数资料两组间比较用卡方检验;相关性分析采用Pearson相关系数检验。以P<0.05为差异有统计学意义。
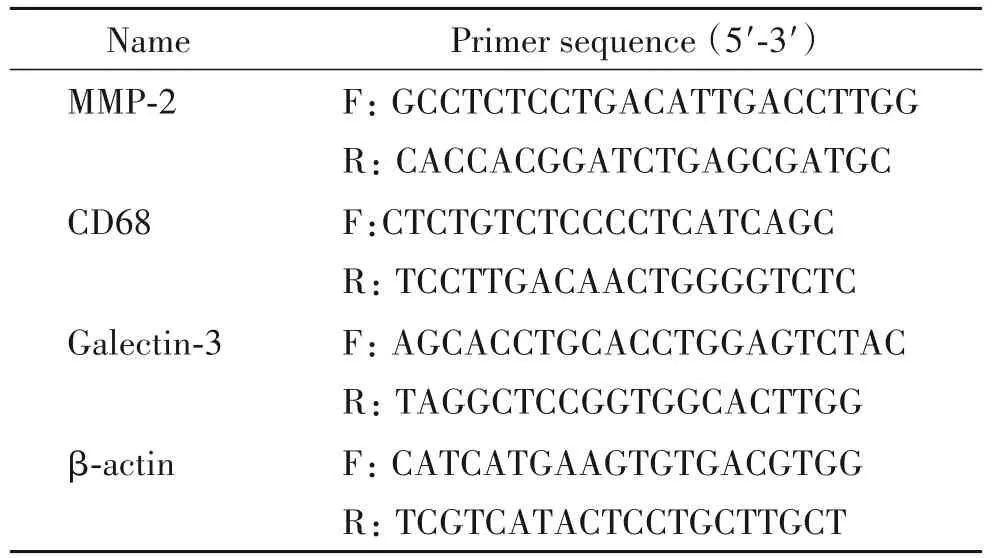
表1 RT-qPCR引物序列Table 1.The primer sequences for RT-qPCR
结 果
1 案例基本情况
按照纳排标准收集到病变组冠状动脉标本66例,其中男性33例,女性33例;年龄在30~83岁之间,平均年龄为(53.6±13.7)岁。收集到正常组共计18例,其中男性10例,女性8例,年龄在16~50岁之间,平均年龄(31.9±9.6)岁。比较各组间基线资料,组间性别差异无统计学意义;组间年龄间差异有统计学意义(P<0.05),见表2。
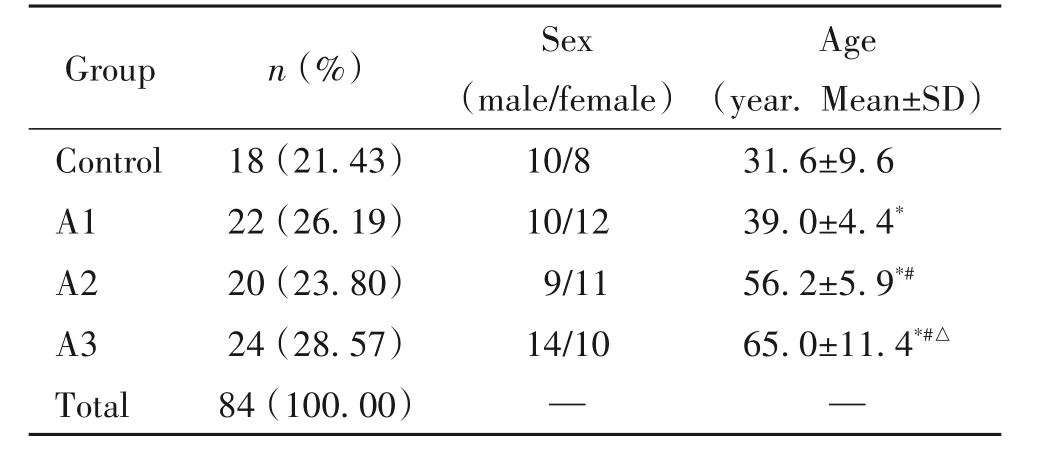
表2 案例基线资料Table 2.Baseline information for the cases
2 冠状动脉形态学分析
镜下可见正常组冠状动脉内膜壁薄而光滑,内、中、外膜厚度均匀一致;A1组中有纤维帽形成,纤维帽下见数量不等的泡沫细胞,血管腔轻度狭窄;A2组中内膜厚度不均匀增厚,管腔不同程度狭窄,内膜下见典型纤维帽,部分案例纤维帽下见粥样坏死物,中膜可因斑块压迫、平滑肌萎缩等受压变薄,外膜变化不明显;A3组血管内膜厚度、坏死灶厚度较A2组增厚,出现典型粥样坏死灶,坏死灶周边残留数量不等的泡沫细胞等炎细胞,坏死灶内可见斑块内出血、斑块破裂等继发病变形成,中膜显著受压变薄,由于上述病变的加重,致管腔多呈偏心性狭窄,见图1。
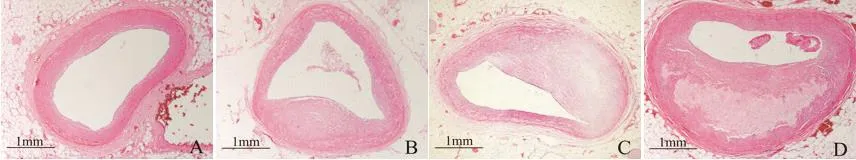
Figure 1.Microscopic changes of coronary artery(HE staining).A:control group;B :atherosclerosis group,A1 group;C :sudden death of coronary heart disease without secondary lesions,A2 group;D:sudden death of coronary heart disease with grade IV stenosis of vascular lumen,A3 group.图1 冠状动脉结构的镜下变化
图像分析显示,病变组冠状动脉内膜厚度和坏死灶厚度较对照组增高,纤维帽厚度降低,管腔狭窄程度从A1至A3组依次增大(P<0.05),见表3。

表3 冠状动脉病灶形态学相关指标Table 3.Comparison of morphological indexes of coronary artery lesions(Mean±SD)
3 冠状动脉病灶内泡沫细胞计数
对照组血管壁内无泡沫细胞,病变各组病灶内泡沫细胞数量从A1组至A3组逐渐增多,测量值分别为 7.89±2.03、17.58±1.79 和 28.92±2.87,且 A3组泡沫细胞数量显著高于A2和A1组,A2组高于A1组(P<0.05)。
4 冠状动脉组织中galectin-3、CD68和MMP-2蛋白表达
Western blot结果显示,同正常组比较,病变组冠状动脉血管组织中galectin-3、CD68和MMP-2蛋白表达增高(P<0.05);病变组间蛋白水平比较,A2组蛋白表达高于A1组,A3组蛋白表达高于A2组(P<0.05),见图2。
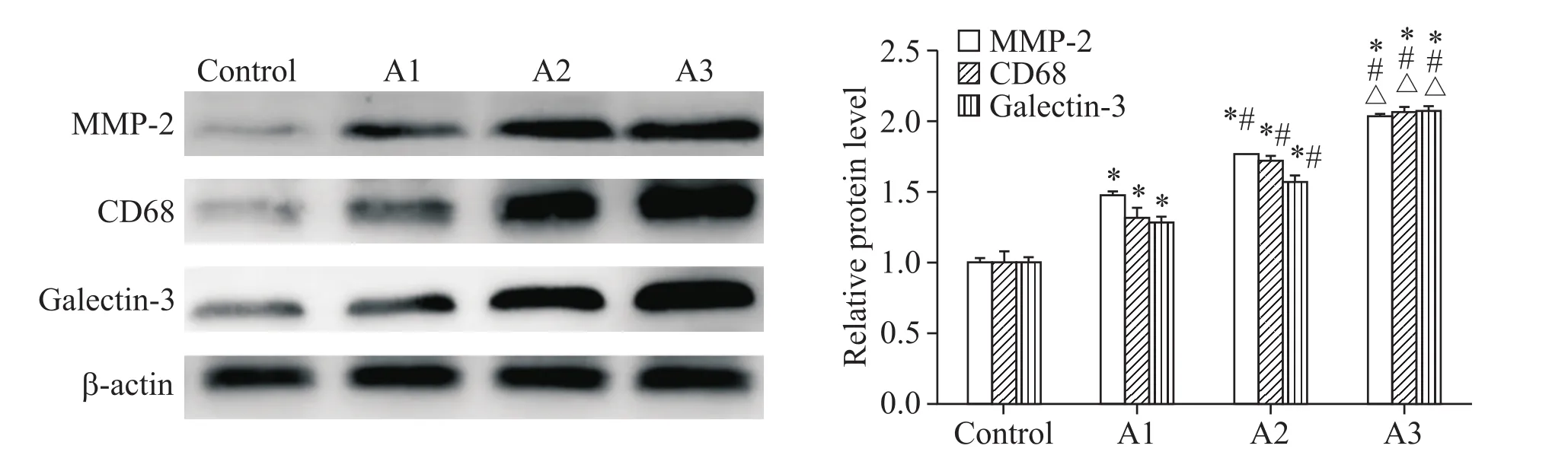
Figure 2.The protein expression of MMP-2,CD68 and galectin-3 in coronary artery.Mean±SD.n=8.*P<0.05 vs control group;#P<0.05 vs A1 group;△P<0.05 vs A2 group.图2 冠状动脉组织内MMP-2、CD68和galectin-3的蛋白表达
5 冠状动脉粥样硬化病灶内galectin-3、CD68和MMP-2蛋白表达分布
免疫组织化学结果显示,正常组冠状动脉内膜偶见galectin-3的弱阳性表达于内膜下近基底膜处,病变组中galectin-3蛋白在冠状动脉粥样硬化病灶周围及基底部炎症细胞胞核及胞质中见颗粒状、点片状棕黄色着色,且病变组galectin-3蛋白较正常组增高(P<0.05),其中,A3组中蛋白表达高于A1和A2组,A2组蛋白表达高于A1组(P<0.05),见图3、表4。
正常组中未见CD68和MMP-2蛋白的表达,病变组中,CD68蛋白主要表达在病灶肩区及内皮下的泡沫细胞胞质,胞核也有少量表达,呈棕黄色着色,且随着病程的进展,棕黄色逐渐加深,即CD68蛋白阳性表达逐渐增强(P<0.05);MMP-2蛋白主要表达在病灶两肩区及基底部的细胞外基质,阳性表达较正常组增强(P<0.05),但A2组与A1组间MMP-2蛋白表达差异无统计学意义(P>0.05),见图3、表4。
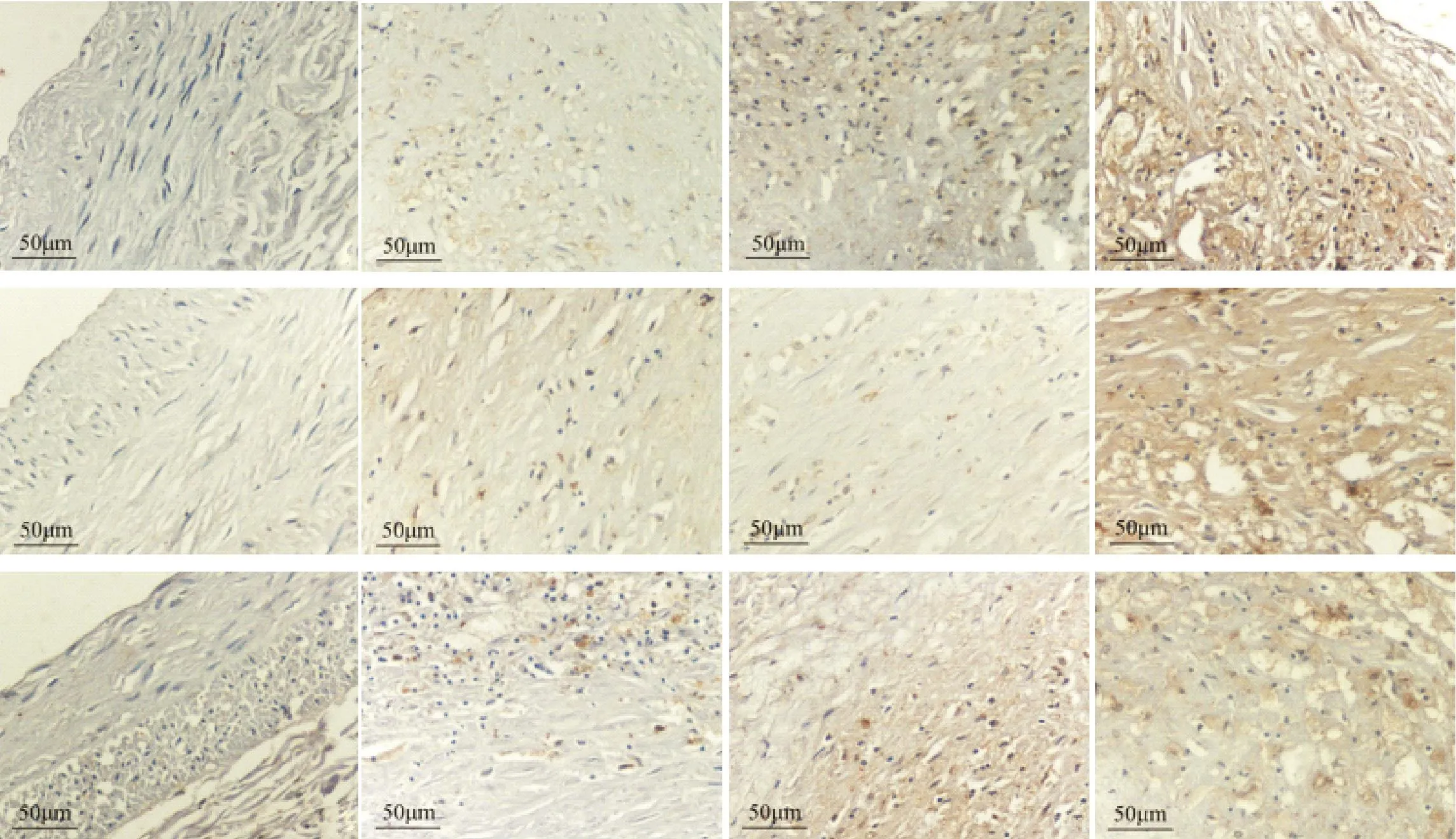
Figure 3.The expression level of MMP-2,CD68 and galectin-3 in coronary atherosclerotic lesions(IHC staining).The scale bar=50µm.图3 AS病灶内MMP-2、CD68和galectin-3蛋白表达分布

表4 AS病灶内CD68、MMP-2和galectin-3的平均吸光度值Table 4.Mean absorbance of CD68,MMP-2 and galectin-3 proteins in coronary artery lesions(Mean±SD)
将病变组内galectin-3、CD68和MMP-2蛋白表达两两做相关性分析。结果显示,病变组内galectin-3与CD68蛋白表达呈显著正相关(r=0.717,P=0.000),galectin-3与MMP2蛋白表达呈显著正相关(r=0.695,P=0.000),CD68与MMP-2蛋白表达呈显著正相关(r=0.794,P=0.000)。
6 冠状动脉组织中galectin-3、CD68和MMP-2 mRNA的表达水平
RT-qPCR结果显示,同正常组比较,病变各组MMP-2、CD68和galectin-3 mRNA表达水平升高,且A3组各因子mRNA表达水平高于A1和A2组,A2组又高于A1组(P<0.05),见图4。
7 AS病灶内galectin-3、CD68和MMP-2蛋白水平与病灶结构的相关性分析
相关性分析结果显示,病灶内galectin-3、MMP-2和CD68蛋白水平与病灶厚度和坏死核心厚度呈正相关,与纤维帽厚度呈负相关(P<0.05),见表5。
8 AS病灶内炎症反应水平与猝死的关系
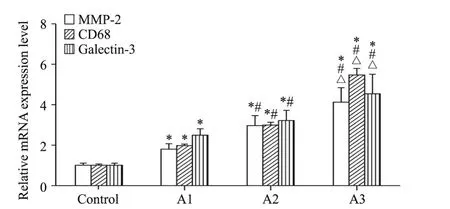
Figure 4.The mRNA expression of MMP-2,CD68 and galectin-3 in coronary artery tissues.Mean±SD.n=8.*P<0.05 vs control group;#P<0.05 vs A1 group;△P<0.05 vs A2 group.图4 冠状动脉组织内MMP-2、CD68和galectin-3的mRNA表达水平
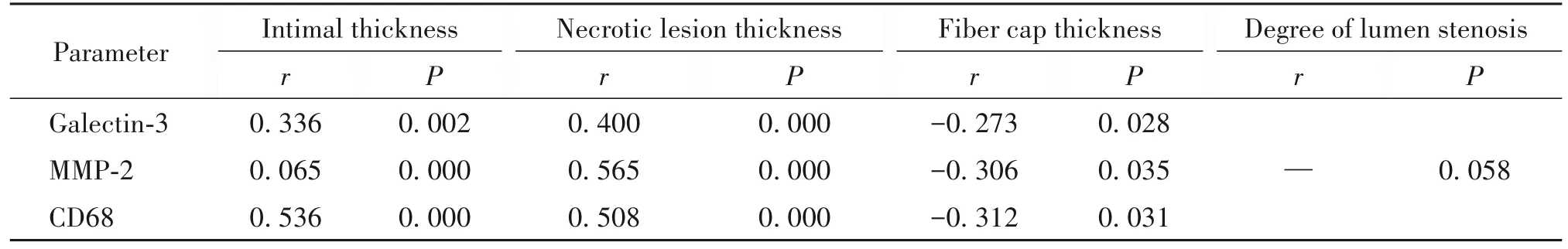
表5 病灶内galectin-3、MMP-2和CD68蛋白表达水平与病灶结构参数的相关性分析Table 5.Correlation analysis of protein expression level of galectin-3,MMP2-2 and CD68 and focal structure parameters
将冠心病猝死组与非猝死组中的AS病灶内炎症细胞总数进行比较,猝死组病灶内炎症细胞数量高于非猝死组(P<0.01);将冠心病猝死组与非猝死组中的血管腔面积分数度进行比较,结果显示猝死组管腔狭窄程度高于非猝死组(P<0.01),见表6。

表6 猝死组与非猝死组病灶内炎症细胞数量及管腔狭窄程度的分析Table 6.Analysis of the inflammatory response and the degree of stenosis in the lesions of sudden cardiac death(SCD)and non-sudden cardiac death(non-SCD)groups
讨 论
动脉粥样硬化被认为是一种发生在血管壁的慢性炎症反应性疾病[4]。研究表明,多种炎症细胞及细胞因子参与AS发生发展的病理生理过程[17-20]。单核巨噬细胞在斑块形成和发生发展中发挥重要作用,在高危因素持续存在的情况下,脂质不断的堆积于内膜下,刺激包含单核细胞在内的多种炎症细胞及来源于中膜的平滑肌细胞不断的积聚于内膜下,吞噬脂质后转化为泡沫细胞并分泌多种活性物质,使细胞外基质成分发生降解,最终致纤维帽的变薄,促使斑块不稳定性的发生。
研究表明,galectin-3主要由活化的巨噬细胞产生,参与调节炎症、纤维化等过程[21-22]。MacKinnon等[15]的动物研究表明,给予ApoE/galectin-3敲除大鼠高脂饮食,大鼠主动脉及其分支中动脉粥样硬化病变形成减少,斑块中M2型巨噬细胞的活化也降低;抑制galectin-3表达可减轻小鼠动脉粥样硬化病变[23]。大量临床研究也显示,血浆galectin-3水平与心肌缺血的严重程度相关[12-14],Aksand等[24]的临床试验也显示,冠心病患者的血清galectin-3水平高于健康对照组,同时血清galectin-3水平与冠心病的严重程度呈显著正相关,提示galectin-3是与动脉粥样硬化斑块严重性和不稳定的异常变化有关的一类生物标记物,但在人体层面直接检测动脉粥样硬化斑块内的galectin-3表达鲜见报道。本研究在人体冠状动脉内直接检测galectin-3表达,结果显示在人体正常冠状动脉内galectin-3低水平表达于冠脉血管内膜近基底部,进一步证实galectin-3低水平存在于正常的血管组织中[6-10],而随着冠状动脉粥样硬化病程的进展,galectin-3在病灶内特别是有斑块破裂、斑块内出血等继发病变的病灶内表达明显增高,在上述研究结果基础上进一步提示galectin-3可能与AS斑块的稳定性相关。
CD68作为单核巨噬细胞的标记性分子,其在组织内的表达水平在一定程度上反应了该部位的炎症程度。动脉粥样硬化斑块的不稳定性与包含单核巨噬细胞在内的多种炎症细胞富集等多种因素直接相关[25]。研究表明,病灶内不稳定性斑块的炎症反应程度强,易发生破裂、出血等病变导致斑块内纤维成分破坏、脂质坏死核心面积增加[26]。本研究直接对冠状动脉粥样硬化病灶内单核巨噬源性的泡沫细胞标记并计数,结果显示病灶内泡沫细胞数量增多,CD68阳性表达增强,提示随着病程的进展,病灶内炎症反应逐渐增强,此与本课题组前期研究结果相一致[24]。AS病灶内单核-巨噬细胞系统主要产生MMP-2和MMP-8等[27]。研究显示,从稳定性斑块进展到不稳定性斑块的过程中,血清中MMP-2的表达水平是显著升高的[28-30]。在急性冠脉综合征患者的血清中,MMP-2表达明显高于稳定性心绞痛组[31]。MMP-2在Ca2+和Zn2+帮助下,能降解包括IV型胶原等在内的细胞外基质(extra cellular matrix,ECM),而IV型胶原等是AS斑块基底膜和纤维帽等的重要组成部分[32-33]。Seifert等[34]的动物实验也证实,在ApoE-/-小鼠模型中,MMP-2和MMP-9活性在不稳定动脉粥样硬化斑块中显著高于下游更稳定的斑块表型。以上研究均提示,MMP-2水平的升高是AS稳定性斑块向不稳定性斑块发展的重要因素。本研究直接检测人体冠状动脉AS斑块内MMP2表达,结果显示,在AS病灶内MMP-2表达明显增高,这进一步验证了MMP-2在不稳定性斑块中发挥着关键作用并促进斑块的不稳定。
将病灶内galectin-3与CD68蛋白表达作相关性分析显示,galectin-3与CD68蛋白表达呈显著正相关,提示随着冠状动脉粥样硬化病程的进展,病灶内炎症水平增高,galectin-3的表达也随之增高;galectin-3的表达与动脉粥样硬化病灶厚度和坏死核心厚度呈正相关,与纤维帽厚度呈负相关,而MMP-2是反应斑块稳定性的重要指标,galectin-3与MMP-2蛋白表达呈正相关,提示galectin-3可能通过促进病灶内MMP2的表达,使得细胞外基质分解加强,纤维帽变薄,加速斑块裂隙,从而促进病变的进展及坏死灶的扩大,使斑块的稳定性下降,促进其破裂、出血等继发病变的发生,更甚者导致猝死。
综上所述,人冠状动脉粥样硬化病灶内galectin-3表达水平随病灶内炎症程度增强而升高,且病灶内galectin-3水平的改变与病灶结构变化具有相关性,因此,病灶内galectin-3水平变化可能是影响斑块结构稳定性的环节之一。

