气相环境下丙氨酸Ca2+配合物的手性转变机理及水分子的催化作用
徐锐英,刘芳,马宏源,张雪娇,潘宇,杨晓翠*,王佐成*
(1.白城师范学院 理论计算中心,吉林 白城137000; 2.白城师范学院 传媒学院,吉林 白城137000;3.白城师范学院 物理学院,吉林 白城137000)
0 引 言
丙氨酸(alanine, Ala)是结构最简单的手性氨基酸。根据旋光性可分为左-丙氨酸(L-Ala)和右-丙氨酸(D-Ala);根据构型可分为S-丙氨酸(S-Ala)和R-丙氨酸(R-Ala)。不同旋光性的Ala 作用不同,L-Ala 是蛋白质的成分之一,D-Ala 在生命体内微量存在,使氨基酸氧化酶(DAAO)在肿瘤细胞质中异位表达,阻止体内脂质氧化损伤;在细菌孢子代谢过程中起重要作用;但过量的D-Ala 会诱发某些疾病或导致衰老[1-4]。D-Ala 是生产维生素B6 的原料,可作为合成二肽甜味剂阿力甜的原料[5-6]。
研究Ala 的手性转变具有重要意义,目前该领域已有很多研究成果。WANG 等[7]发现,光学纯的Ala 分子可以消旋。文献[8-11]采用密度泛函的B3LYP 方法研究了气相单体Ala 的手性转变及水分子的作用,结果表明,气相下α-氢以氨基氮为桥迁移是其消旋的优势通道,总包能垒约为266.1 kJ·mol-1;α-氢以羰基氧为桥迁移时,其消旋的总包能垒约为381.4 kJ·mol-1;水分子簇对其消旋反应有较好的催化作用。文献[12]采用量子力学与分子力学组合的方法研究了SWBNNT 对Ala 手性转变的限域影响,结果表明,SWBNNT(5,5)对Ala的消旋具有明显的限域催化作用。文献[13]采用色散校正泛函的ɷB97X-D 方法,研究了气相下Cu2+与α-Ala 配合物的手性转变,结果表明,Cu2+对α-Ala 的消旋反应具有催化作用。
研究气相的金属离子-生物分子体系,可获得相关体系最本质的化学及物理性质等信息,同时为深入研究溶剂等复杂环境下金属与氨基酸的作用奠定基础。Ca2+是动植物生长过程中必需的营养元素,参与细胞内许多重要生理过程[14-15]。目前,学者们在气相“钙离子与氨基酸配合物的结构性质”领域做了大量工作,文献[16-20]的研究表明,钙离子与很多金属离子一样会诱导甘氨酸、丝氨酸和组氨酸等发生分子内质子迁移,且金属氨基酸两性离子配合物构象稳定。目前,Ca2+对Ala 手性转变影响的研究鲜见报道,通常气相环境有水分子(簇)存在,基于此并结合以往的研究[13,21],采用密度泛函理论对气相丙氨酸Ca2+配合物的手性转变机理及水分子的催化作用进行了研究,对进一步研究水溶剂环境下丙氨酸Ca2+配合物的手性转变具有指导意义。
1 研究与计算方法
采用对处理含有金属元素和弱键作用体系能量有较高精度的杂化泛函M06 方法[22],在6-31++G(d, p)[23]基组下,通过优化反应过程中单重态势能面上的驻点结构(本工作体系的自旋态可能是1,3,5和7,计算表明单重态最稳定),计算了体系的自然键轨道(natural bond orbital,NBO)电荷。通过对过渡态[24]作的内禀反应坐标(IRC)计算[25],确认过渡态连接期望的稳定点。为得到较高水平的反应过程势能面,同时兼顾计算成本,在M06/6-311++G(2df, pd)高角动量基组水平上计算单点能。总吉布斯自由能用Gtotal=Gtc+ESP计算(Gtc和ESP分别是吉布斯自由能热校正和单点能)。S-Ala_1(丙氨酸稳定构象1)与Ca2+的配合物Ala_1·Ca2+记作S-A_1,S-A_1 在a 通道异构的第1 个S-型过渡态配合物记作S-T1_1a,第1 个S-型中间体配合物记作S-I1_1a;a 和b 通道公用的结构X 记作Xa(b),6 个水分子与SAz_1a(b)的Ca2+配位,同时2 个水分子簇(二聚水)与S-Az_1a(b)形成氢键,记作S-Az_1a(b)←6H2O·(H2O)2,其他体系用相似方法表示。采用Gaussian 09[26]程序在白城师范学院理论计算中心完成计算工作。
2 结果与讨论
将文献[8-11]的气相Ala 分子两种稳定构型作为初始猜测,优化的两对手性对映体及Ca2+的几何构型见图1。计算表明,S-Ala_1 相对于S-Ala_2 的自由能为3.0 kJ·mol-1,S-Ala_1 的稳定性稍差。

图1 Ala 分子手性对映体及Ca2+的几何构型Fig.1 Chiral enantiomer of Ala and geometric conformation of Ca2+
Ca2+可在不同位置与S-Ala_1 和S-Ala_2 的氮和氧配位形成配合物,优化得到的最稳定配合物SA_1 和S-A_2 的几何构型见图2。
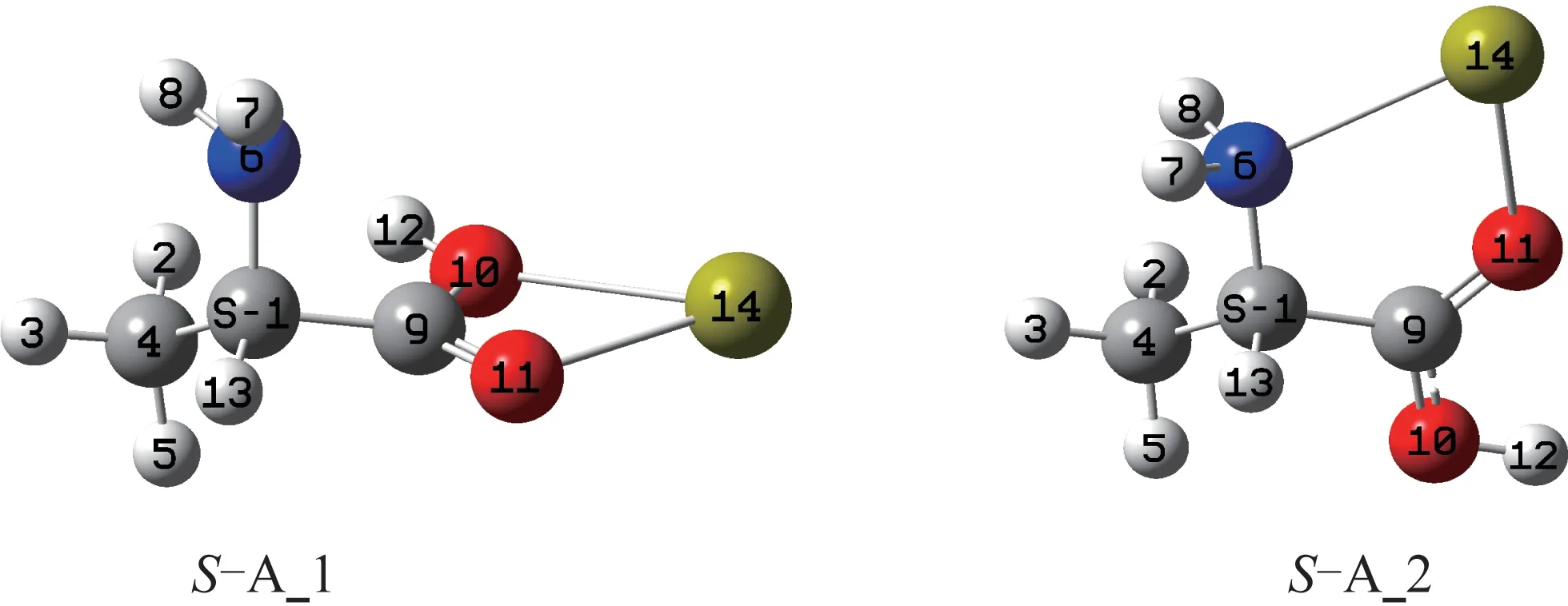
图2 配合物S-A_1 和S-A_2 的几何构型Fig.2 Geometric configuration of S-A_1 complex and S-A_2 complex
2.1 S-A_1 的手性转变
S-A_1 的手性转变反应有a 和b 2 个通道,反应历程及过渡态矢量见图3(第1 和第2 基元反应为共用基元),反应的吉布斯自由能势能剖面见图4。
第1 基元:反应物S-A_1,经1C—9C 键内旋转的过渡态S-T1_1a(b),构象异构,形成两性的中间体S-Az_1a(b)。从S-A_1 到S-T1_1a(b),1C—9C 键 沿 过渡态矢量的正方向向内旋转,同时质子12H 从羧基氧10O 向氨基氮6N 迁移。二面角11O—9C—1C—6N 从94.1°变为97.5°,小角度的 C—C 键内旋转只需很小的能量,S-T1_1a(b)产生的内禀能垒为3.7 kJ·mol-1。S-T1_1a(b)靠 近S-A_1,是 早 期 过 渡 态。该基元反应放热148.5 kJ·mol-1,所放热量可被后续的反应利用。两性Ala 和Ca2+的配合物S-Az_1a(b)处于势阱最深处,其构象远比S-A_1 稳定。
第2 基元:S-Az_1a(b)经α-氢13H 向羰基氧11O迁移的过渡态T2_1a(b)构型异构,形成两性的中间体配合物I2_1a(b)。从S-Az_1a(b)到T2_1a(b),13H 沿过渡态矢量正向迁移,1C—13H 键的键长从0.109 9 nm拉伸至0.151 9 nm,断裂,二面角6N—1C—9C—4C从-123.9°变为-133.5°,C—H 键大幅拉伸断裂及骨架的形变需要给予很高的能量,T2_1a(b)产生的内禀能垒为283.3 kJ·mol-1。较气相环境下单体Ala在此过程的内禀能垒316.3 kJ·mol-1[5]有明显下降,说明Ca2+对氢迁移反应有催化作用。由于Ca2+与两性Ala 羧基的2 个氧同时配位,α-氢的NBO 电荷从0.251 e 增至0.307 e,11O 的NBO 电荷从-0.619 e 增至-0.813 e,导 致 羰基氧11O 对α-氢13H 的库仑引力明显增加。由于前一基元的反应放热148.5 kJ·mol-1可 被利 用,因此S-Az_1a(b)越过T2_1a(b)需要的能量只有134.8 kJ·mol-1(283.3-148.5)。I2_1a(b)较S-A_1 在势能面上的位置低、稳定性好,原因是I2_1a(b)的骨架原子基本共面,形成了共轭大π 键。
接下来的反应历程分为a 和b 通道。
2.1.1 a 通道
第3 基元:I2_1a(b)经13H 在纸面内从11O 向1C迁移的过渡态T3_1a异构成中性的R-型产物R-Az_1a,S-A_1 实现手性转变。从I2_1a(b)到T3_1a,11O—13H 键长从0.097 9 nm 拉伸至0.122 5 nm,断裂,此处O—H 键拉伸幅度小于第2 基元的S-Az_1a(b)到T2_1a(b)的C—H 键拉伸幅度,又O—H 键较C—H 键易断裂,因此T3_1a产生了181.4 kJ·mol-1的内禀能垒,较T2_1a(b)产生的内禀能垒小得多。结构分析表明,T3_1a和R-Az_1a分别与T2_1a(b)和S-Az_1a(b)镜像对称。至此,S-Az_1a(b)实现了手性对映体转变。
第4 基元:R-Az_1a经1C—9C 键向内旋转的过渡态R-T4_1a异构成两性的产物配合物R-A_1a。从R-Az_1a到R-T4_1a,二面角11O—9C—1C—6N从171.9°变为-97.5°,同时6N—12H 键断裂,12H 从6N 迁移到羰基氧10O,大角度的C—C 键向内旋转以及12H 从6N 迁移到10O,需要一定的能量,RT4_1a产生的 内禀能 垒为152.2 kJ·mol-1。R-T4_1a靠近R-A_1a,为晚期过渡态。结构分析表明,R-A_1a与S-A_1 镜像对称。至此,S-A_1 实现了手性对映体转变。
纵观S-A_1 在a 通道整个反应历程的驻点构象和势能面,发现所有驻点构象及各个驻点的能量关于I2_1a(b)对称,体现了Ala 分子手性对映体转变的过程美和内在美!
2.1.2 b 通道
第3 基元:I2_1a(b)经8H 在纸面内从氨基向α-C迁移的过渡态T3_1b异构成R-型中间体R-I3_1b,S-A_1 实现手性转变。从I2_1a(b)到T3_1b,6N—8H键长从0.102 9 拉伸至0.134 2 nm,断裂,T3b_1 产生了199.3 kJ·mol-1的内禀能垒。较气相环境下单体Ala 在此基元的内禀能垒106.5 kJ·mol-1[6]有大幅提升,说明Ca2+与羧基氧的配位对此基元反应有极强的负催化作用。原因是Ca2+与羰基氧配位导致I2_1a(b)8H 的NBO 电荷从0.436 e 增至0.485 e,6N 的NBO 电 荷 从0.795 e 增 至0.796 e,1C 的NBO 电 荷从-0.245 e 骤降至-0.081 e,导致6N 对8H 的库仑引力增加,1C 对8H 的库仑引力显著减小。
第4 基元:R-I3b_1 经氨基氢左右翻转的过渡态R-T4_1b异构成中间体配合物R-4_1b。从R-I3b_1到R-T4_1b, 二 面 角 7H—6N—1C—2H 从-147.7°变为-162.6°,非骨架二面角的小幅增加需要的能量很少,R-T4_1b产生的内禀能垒只有0.4 kJ·mol-1,此基元几乎是无势垒反应。
第5 基元:R-I4_1b经11O—14Ca 配位键断裂和9C—10O—14Ca 剪式运动的过渡态R-T5_1b,异构成14Ca 与6N 和10O 配位的R-I5_1b。从R-I4_1b到R-T5_1b,较弱的11O—14Ca 配位键(键长0.256 1 nm)断裂,9C—10O—14Ca 从106.1°到119.3°小幅剪式运动,所需能量较少,R-T5_1b产生的内禀能垒为2.2 kJ·mol-1。R-T5_1b靠近R-I4_1b,是11O—14Ca配位键断裂和9C—10O—14Ca 剪式运动协同非同步的早期过渡态。
第6 基元:R-I5_1b经9C—11O 键向内旋转的过渡态T6m_1b或T6n_1b,实现了13H 从羧基外侧向羧基内侧旋转,异构成稳定的产物配合物R-A_2_1b。至此实现了S-Ala_1 向R-Ala_2 的异构。从R-I5_1b到T6m_1b,9C—11O 键 向 内 旋 转81.0°需 要 的 能 量 较 少,从R-I5_1b到T6n_1b,9C—11O 键向内旋转100.3°需要的能量也较少,因此,T6m_1b和T6n_1b产生的能垒较小,分别为37.7 和37.1 kJ·mol-1。
从图4 中可以看出,S-A_1 手性转变反应的a 通道具有优势,反应的总包能垒为134.8 kJ·mol-1(来自于过渡态T2_1a(b)),远低于气相环境下单体Ala 手性转变优势通道的活化能266.0 kJ·mol-1[8](本文理论水平下的计算值为257.5 kJ·mol-1),说明Ca2+对S-Ala_1 的手性转变具有极好的催化作用。134.8 kJ·mol-1的能垒在通常情况下可以极缓慢地越过,亦即配合物S-A_1 在该通道可以微量地消旋。b 通道的总包能垒为152.7 kJ·mol-1,越过此能垒的概率很小,S-A_1 在此通道只能痕量地消旋。从图4 中还可看出,反应物中S-Az_1a(b)的分布远高于S-A_1,产物中主要为R-Az_1a,而R-A_2_1b极少。此外,S-A_1 手性转变反应的优势通道a 是α-氢以羰基氧为桥迁移,而单体Ala 手性转变的优势通道是α-氢以氨基氮为桥迁移[8],说明Ca2+的存在改变了S-Ala_1 手性转变反应的机理。
2.2 S-A_2 的手性转变
S-A_2 的手性转变反应有a、b、c 和d 4 个通道,其中,a 和b 通道共用第1 和第2 基元,c 和d 通道也共用第1 和第2 基元,反应历程、驻点构象及过渡态矢量见图5,反应的吉布斯自由能势能剖面见图6。
2.2.1 a 和b 通 道
第1 基元:S-A_2 经羧基内质子迁移的过渡态S-T1_2a(b),12H 沿 过 渡 态矢量的 负 方 向 从10O 迁 移到11O,异构成中间体配合物S-I1_2a(b)。从S-A_2到S-T1_2a(b),10O—12H 键的键 长 从0.097 7 nm 拉伸至0.135 0 nm,断裂,10O—12H 键的大幅度拉伸使S-T1_2a(b)产生了188.2 kJ·mol-1的内禀能垒。这与气相环境下单体Ala 在此基元反应的内禀能垒195.1 kJ·mol-1[5]相差无几,说明Ca2+的存在对此基元反应的影响很小。
第2 基 元:S-I1_2a(b)经13H 从1C 向10O 迁移 的过渡态T2_2a(b),异构成中间体配合物I2_2a(b)。从SI1_2a(b)到T2_2a(b),1C—13H 键 的 键 长 从0.110 3 nm拉伸至0.128 9 nm,断裂,骨架二面角6N—1C—9C—4C 从-126.8°变为-140.0°,C—H 键的断裂及骨架的形变需要较高的能量,T2_2a(b)产生了300.0 kJ·mol-1的内禀能垒。较气相环境下单体Ala 在此基元反应的能垒316.3 kJ·mol-1[5]略有降低,说明Ca2+对此基元反应的催化作用很小。
2.2.2 a 通道
第3 基元:I2_2a(b)经与T2_2a(b)镜像对称的过渡态T3_2a,实现了13H 在纸面内侧从10O 向α-碳1C的迁移,异构成中间体配合物R-3a_2。至此,S-A_2实现了手性转变。从I2_2a(b)到T3_2a,10O—13H 键的键长从0.096 9 nm 拉伸至0.128 6 nm,断裂,T3_2a产生的内禀能垒为258.0 kJ·mol-1。此基元与2.1 节中a 通道的第3 基元反应相似,不再赘述。
第4 基元:R-I3_2a经过与S-T1_2a(b)镜像对称的过渡态R-TS4_2a,实现12H 在羧基内的回迁,异构成产物配合物R-A_2a。结构分析表明,R-A_2a与S-A_2 镜像对称。至此,R-A_2a实现了手性对映体转变。从R-I3_2a到R-TS4_2a的过程中,11O—12H 键的键长从0.097 9 nm 拉伸至0.124 9 nm,断裂,R-TS4_2a产 生 的 能 垒 为102.3 kJ·mol-1。此 基元反应的能垒小于第1 基元反应,原因是此基元反应比第1 基元反应O—H 键的拉伸幅度小。
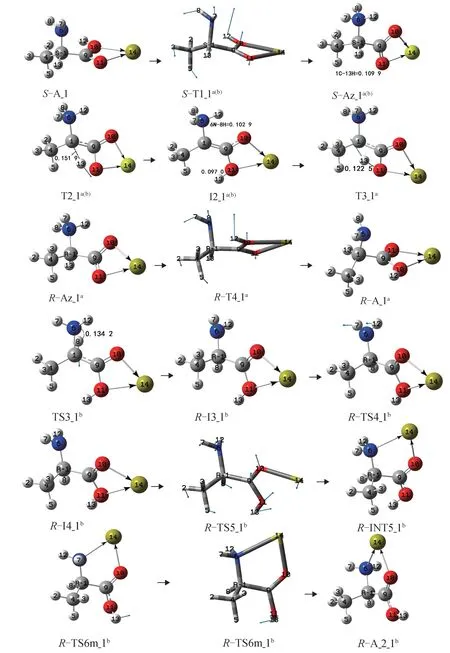
图3 Ca2+催化S-Ala_1 的手性转变历程(键长单位:nm)Fig.3 Reaction process of chiral transition of S-Ala_1 catalyzed by Ca2+(bond length unit:nm)
纵观S-A_2 在a 通道反应历程的驻点构象和势能面,发现所有驻点构象及各个驻点的能量关于I2_2a(b)对称,体现了Ala 分子手性对映体转变的过程美和内在美!
2.2.3 b 通道
第3 基元:I2_2a(b)经8H 在纸面内从氨基向α-碳迁移的过渡态T3_2b,异构成R-型中间体R-I3_2b,S-A_2 实现了手性转变。从I2_2a(b)到T3_2b,6N—8H 键的键长从0.102 6 nm 拉伸至0.142 2 nm,断裂,T3b_2 产生的内禀能垒为198.5 kJ·mol-1。较气相环境下单体Ala 在此基元反应的内禀能垒106.5 kJ·mol-1[6]有大幅提升,Ca2+与羧基氧的配位对此基元有极强的负催化作用。原因与a 通道第3 基元相似,不再赘述。
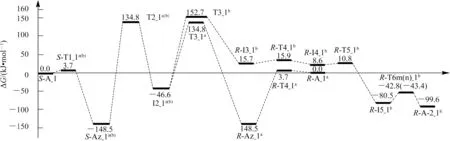
图4 Ca2+催化S-Ala_1 手性转变反应的吉布斯自由能势能剖面Fig.4 Gibbs free energy surfaces of chiral transformation reaction of S-Ala_1 catalyzed by Ca2+
第4 基元:R-3_2b经11O—9C 键俯视顺时针或逆时针旋转的过渡态R-TS4m_2b或R-TS4n_2b,异构成中间体R-I4m_2b或R-I4n_2b。从R-I3_2b到R-TS4m_2b,二面角12H—11O—9C—10O 从0.2°变为-96.1°,二面角11O—9C—1C—6N 从2.4°变为-72.7°,二面角14Ca—6N—1C—9C 从3.6°变为128.5°,11O—9C 键俯视顺时针旋转与9C—1C 键左视逆时针旋转及1C—6N 键俯视逆时针旋转协同进行。3 个化学键向内旋转使R-TS4m_2b产生了60.9 kJ·mol-1的 内 禀 能 垒。同 样,R-TS4n_2b产 生了70.8 kJ·mol-1的内禀能垒。
第5 基元:R-I4m_2b经12H 从11O 向6N 迁移的过渡态R-T5m_2b,异构成R-I5_2b(R-INT5_1b)。从R-I4m_2b到R-T5m_2b,11O—12H 键的键长从0.101 6 nm 拉伸至0.106 9 nm,O—H 键小幅拉伸需要的能量很少,R-T5m_2b产生的内禀能垒只有0.3 kJ·mol-1。同 样,R-T5n_2b产 生 的 内 禀 能 垒 只 有1.8 kJ·mol-1。 结 构 分 析 表 明,R-I5_2b同 于RINT5_1b,R-I5_2b的 异 构 体 也 同 于R-INT5_1b(见2.1.2 节b 通道的第6 基元)。
2.2.4 c 和d 通 道
第1 基元:S-A_2 经9C—10O 键向内旋转的过渡态S-T1m_2c(d)或S-T1n_2c(d),羧基从顺式平面结构改变为反式平面结构,异构成中间体S-I1_2c(d)。从S-A_2 到S-T1m_2c(d),9C—10O 键沿S-T1m_2c(d)虚频的负向旋转97.0°,S-T1m_2c(d)产生的内禀能垒为57.2 kJ·mol-1。同样,S-T1n_2c(d)产生的内禀能垒为57.7 kJ·mol-1。
第2 基元:S-I1_2c(d)经14Ca—6N 配位键断裂与14Ca—11O—9C 做沿虚频正向剪式运动协同进行的过渡态S-T2_2c(d)异构成S-I2_2c(d)。从S-I1_2c(d)到S-T2_2c(d),14Ca—6N 键 断 裂 且14Ca 从 羧 基 的 外 侧摆动到内侧,需要较多能量,S-T2_2c(d)产生了92.6 kJ·mol-1的内禀能垒。
2.2.5 c 通道
第3 基元:S-I2_2c(d)经氨基左右翻转的过渡态S-T3_2c,异 构 成S-I3_2c。从S-I2_2c(d)到S-T3_2c,二面角7H—6N—1C—8H 从131.5°变为-162.6°,非骨架的形变所需能量很少,S-I3_2c产生的内禀能垒为7.8 kJ·mol-1。
第4 基元:S-I3_2c经α-氢13H 从α-碳向氨基氮迁移的过渡态T4_2c,异构成I4_2c[I2_1a(b)]。从S-I3_2c到T4_2c,1C—13H 键 长从0.110 5 nm 拉伸至0.123 3 nm,断裂,C—H 键大幅拉伸需要的能量较高,T4_2c产生了136.6 kJ·mol-1的内禀能垒。该能垒较气相环境下单体Ala_2 在此基元的能垒248.2 kJ·mol-1[10]大幅降低(本文理论值为248.2 kJ·mol-1,文献[10]的理论值约为260.3 kJ·mol-1),说明Ca2+与羧基氧的配位对此基元有极好的催化作用。原因是Ca2+与羧基氧的配位导致α-氢的红外伸缩振动频率从3 052.1 Hz 降至2 997.7 Hz;1C—13H键长从0.109 9 nm 拉伸至0.110 5 nm,1C—13H 键被活化。结构分析表明,I4_2c同于I2_1a(b)。I4_2c继续的异构同于I2_1a(b)之后的异构。
2.2.6 d 通道

图5 Ca2+催化S-Ala_2 的手性转变历程(键长单位:nm)Fig.5 Reaction process of chiral transition of S-Ala_2 catalyzed by Ca2+(bond length unit:nm)
第3 基元,S-2_2c(d)经1C—9C 键沿过渡态矢量的负方向向内旋转的过渡态S-T3_2d异构成S-I3_2d。从S-I2_2c(d)到S-T3_2d,二面角10O—9C—1C—6N 从153.9°变为-173.6°,S-T3_2d产生的内禀能垒 为6.9 kJ·mol-1。结 构 分 析 表 明,S-I3_2d同 于SA_1。至此,完成了S-A_2 向S-A_1 的异构。S-I3_2d继续的异构同于S-A_1 的异构。
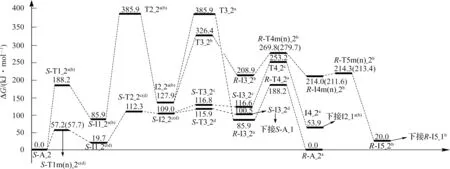
图6 Ca2+催化S-Ala_2 手性转变反应的吉布斯自由能势能剖面Fig.6 Gibbs free energy surfaces of chiral transformation reaction of S-Ala_2 catalyzed by Ca2+
由图6 并结合图4 可知,S-A_2 手性转变反应的d 通道具有优势,总包能垒为(100.5+134.8)kJ·mol-1=235.3 kJ·mol-1(来自于过渡态T2_1a(b)),低于单体Ala_2 手性转变优势通道的总包能垒249.3 kJ·mol-1(本文理论值为249.3 kJ·mol-1,文献[10]的理论值约为260.1 kJ·mol-1),说明Ca2+对SAla_2 的手性转变具有催化作用。但235.3 kJ·mol-1的能垒已经很高,通常难以逾越,说明S-Ala_2 的Ca2+配合物可以很好地保持其手性特征。从图6 中还 可 以 看 出,S-A_2 比S-A_1 稳 定 得 多,S-A_1 很容易 向S-A_2 异 构,并且S-1_2c(d)与S-A_2 共存,只是S-A_2 的分布要高得多。由图4 和图6 知,在SAla 的Ca2+配合物中,两性的S-Az_1a(b)最稳定,然而在气相环境下两性的Ala 不存在[27]。
S-Ala_1 相对于S-Ala_2 的吉布斯自由能为3.0 kJ·mol-1,对于气相环境下的S-Ala,S-Ala_1 的分布较S-Ala_2 少得多。由图4 和图6 知,Ca2+的存在使S-Ala 形成大量的S-A_2 和S-Az_1a(b),旋光异构后会得到少量的R-Az_1a和微量的R-A_2_1b。
2.3 水汽环境下水分子对S-A_1 和S-A_2 手性转变的影响
由前述讨论可知,S-A_1 和S-A_2 手性转变反应优势通道的总包能垒均来自过渡态T2_1a(b),因此,为节省篇幅,又不失对问题讨论的完整性,只讨论水分子对S-A_1 手性转变优势通道的作用。
水分子对S-A_1 的作用有2 种,一是水分子会与20Ca 形成配位键,二是水分子(簇)会与S-A_1 的氢及氧形成氢键。由于配位键强于氢键,因此实际情况应是水分子与20Ca 充分配位后,再与S-A_1 的氢及氧形成氢键。参与配位的水分子个数取最大值6(Ca2+与O 最多可以八配位,在S-A_1 中Ca2+已经与羰基氧二配位)。计算结果表明,6 个水分子与SA_1 的20Ca 配位后,1C—9C 键向内旋转,形成与6N—1C—9C—10O—11O—20Ca 共 面 的S-Ala_1和6 个水分子与20Ca 配位的配合物S-A_1←6H2O,故本节讨论的第1 基元反应是羧羟基氢从羧羟基氧向氨基氮迁移。
田子德等[11]的研究表明,不参与质子转移的、与底物形成氢键的水分子,对质子转移能垒影响很小;文献[9, 28-29]认为,对于质子从丙氨酸的α-碳向羰基氧迁移,二聚水和三聚水的催化作用相差很小,但远大于单个水分子;刘芳等[30]的研究表明,质子从羧基向氨基迁移水分子作桥能垒改变很小,且此基元不是决速步。基于上述原因,为使问题简便且节省篇幅,同时为了得到连续的反应过程势能面,在S-A_1←6H2O 的前面植入二聚水与α-氢12H 和羰基氧10O 形成氢键,优化得到反应物S-A_1←6H2O·(H2O)2m(m表示(H2O)2在S-A_1 之前,相似之处不再说明),见图7。对于第1 基元,羧羟基氢从羧羟基氧向氨基氮迁移时不考虑水分子作媒介;对于第2 基元,只讨论二聚水作为12H 从1C 向10O 迁移媒介的情况;对于第3 基元,只讨论二聚水与I2_1a(b)的羧羟基氢16H 和α-碳1C 形成氢键,作为16H 从10O 向 1C 迁 移 媒 介 的 情 况 。S-A_1←6H2O·(H2O)2m的手性转变反应历程及过渡态见图7,反应的吉布斯自由能势能剖面见图8。
第1 基元:S-A_1←6H2O·(H2O)2m经过渡态ST1_1a(b)←6H2O·(H2O)2m,实现了13H 从11O 向6N 迁移,异构成S-Az_1a(b)←6H2O·(H2O)2m。从S-A_1←6H2O·(H2O)2m到S-T1_1a(b)←6H2O·(H2O)2m,11O—13H 键长从0.101 2 nm 拉伸至0.127 7 nm ,断裂,O—H 键较小的拉伸需要的能量不高。又二面角6N—13H—11O 为139.1°,6N—13H—11O 形成了中等强度的氢键,结构分析表明,6N—13H—11O—9C—1C 基本共面,过渡态S-T1_1a(b)←6H2O·(H2O)2m的五元环结构稳定。因此S-T1_1a(b)←6H2O·(H2O)2m产生的内禀能垒很低,只有12.3 kJ·mol-1。
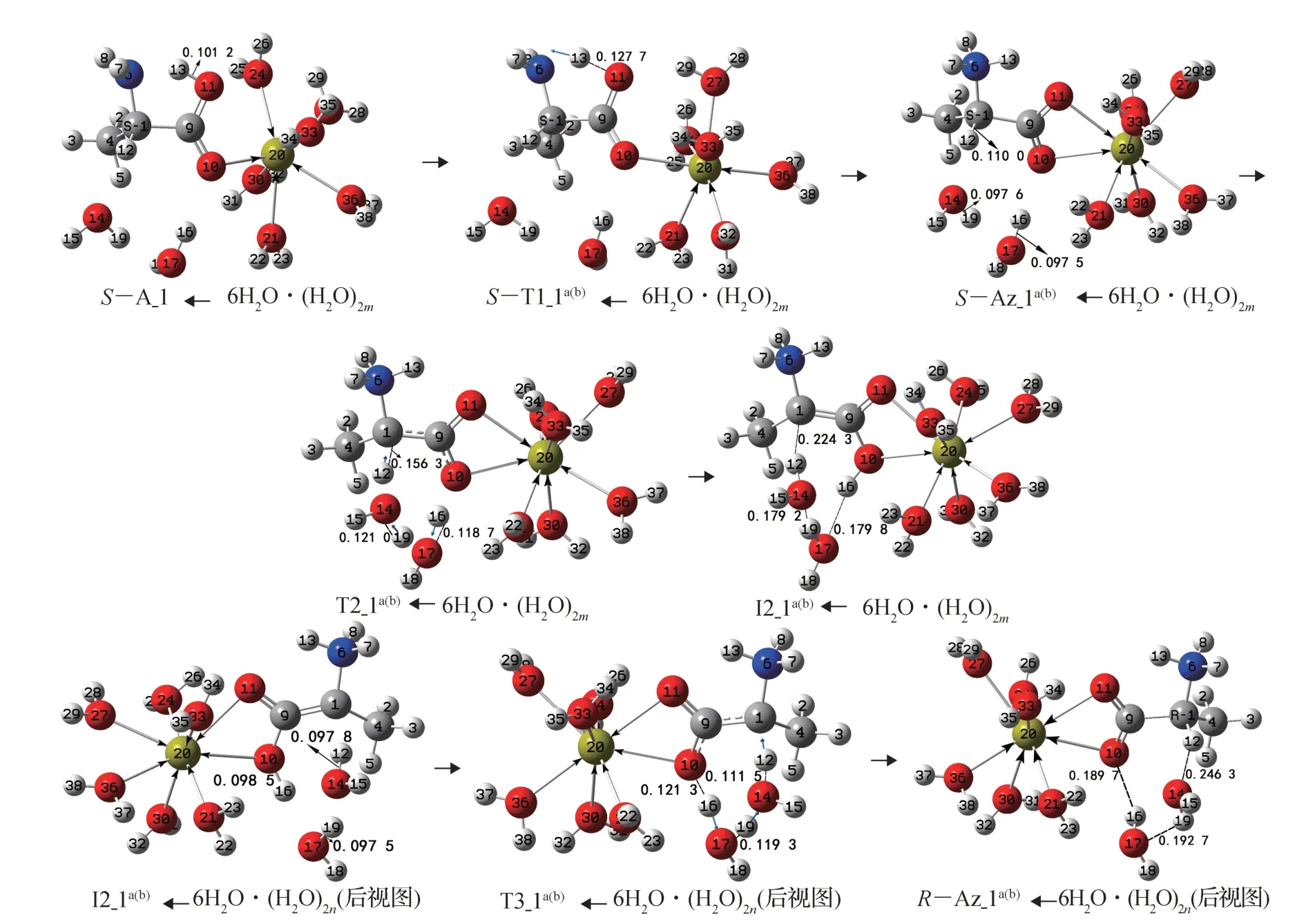
图7 水分子作用下的S-A_1 手性转变反应过程Fig.7 Chiral transition reaction process of S-A_1 under the action of water molecules

图8 水分子作用下的S-A_1 手性转变反应过程的吉布斯自由能势能面Fig.8 Gibbs free energy surfaces of S-A_1 chiral transition reaction process under the action of water molecules
第2 基元:S-Az_1a(b)←6H2O·(H2O)2m经过渡态T2_1a(b)←6H2O·(H2O)2m,实现了质子从α-碳1C 向羰基氧10O 净迁移,异构成中间体I2_1a(b)←6H2O·(H2O)2m。从S-Az_1a(b)←6H2O·(H2O)2m到T2_1a(b)←6H2O·(H2O)2m,1C—12H、14O—19H 和17O—16H键长从0.110 0 ,0.097 6 和0.097 5 nm 分别拉伸至0.156 3 ,0.121 0 和0.118 7 nm,断裂;骨架二面角6N—1C—9C—4C 从-123.7°变为-128.9°。3 个化学键的拉伸断裂,其中还有一个C—H 键断裂,需要一定的能量,但结构分析表明,T2_1a(b)←6H2O·(H2O)2m的氢键角1C—12H—14O、14O—19H—17O和17O—16H—10O 分别为163.2°,161.6°和164.1°,接近平角,3 个氢键较强,具有八元环结构的过渡态T2_1a(b)←6H2O·(H2O)2m较 稳 定。因 此,T2_1a(b)←6H2O·(H2O)2m产生的内禀能垒不会很高,为159.3 kJ·mol-1,远低于2.1 节中没有水分子存在时T2_1a(b)产生的内禀能垒283.3 kJ·mol-1,说明水分子簇对此基元反应起了极好的催化作用。
第3 基元:I2_1a(b)←6H2O·(H2O)2n(n表示(H2O)2在I2_1a(b)之后,相似之处不再说明)经过渡态T3_1a(b)←6H2O·(H2O)2n,实现了质子在纸面内从10O 向1C的净迁移,异构成R-型产物R-Az_1a(b)←6H2O·(H2O)2n,S-Az_1a(b)←6H2O 实现了手性对映体转变。从I2_1a(b)←6H2O·(H2O)2n到T3_1a(b)←6H2O·(H2O)2n,10O—16H、17O—19H 和14O—12H 键 的键长从0.098 5 ,0.097 5 和0.097 8 nm 分别拉伸至0.121 3,0.119 3 和0.111 5 nm,断裂,骨架二面角6N—1C—9C—4C 从150.7°变为129.0°。3 个化学键的拉伸断裂及骨架不小的形变需要一定的能量。结构分析表明,T3_1a(b)←6H2O·(H2O)2n的氢键角10O—16H—17O、17O—19H—14O 和14O—12H—1C 分 别 为164.1°,161.6°和163.2°,接近平角,3 个氢键较强,八元环结构的过渡态T2_1a(b)←6H2O·(H2O)2m较稳定,并 且 从I2_1a(b)←6H2O·(H2O)2n到T3_1a(b)←6H2O·(H2O)2n断裂的都是O—H 键。因此T2_1a(b)←6H2O·(H2O)2m产生的内禀能垒不高,低于T2_1a(b)←6H2O·(H2O)2m产 生 的 内 禀 能 垒,为50.8 kJ·mol-1,远 低 于2.1 节中没有水分子存在时T3_1a(b)产生的内禀能垒181.4 kJ·mol-1,说明水分子(簇)对此基元反应起了极好的催化作用。
第4 基元:R-Az_1a(b)←6H2O·(H2O)2n经与第1基元反应相似的逆过程,可以异构成R-A_1←6H2O·(H2O)2n,反应能垒为130.8 kJ·mol-1。此基元反应很难进行,R-Az_1a(b)←6H2O·(H2O)2n是该反应通道的主要产物,为节省篇幅,省略了该基元的反应历程及势能。
从图8 中可以看出,在水分子作用下,S-A_1 手性转变反应优势通道a 的总包能垒为40.8 kJ·mol-1;由图8 并结合图6 发现,在水分子作用下,S-A_2 手性转变反应优势通道d 的总包能垒为141.3 kJ·mol-1(100.5+40.8=141.3)。通常情况下40.8 kJ·mol-1的能垒容易越过,141.3 kJ·mol-1的能垒可以缓慢地越过,亦即在水汽环境下,S-A_1 可以较快地消旋,S-A_2 可以缓慢地消旋。
3 结 论
在M06/6-311++G(2df, pd)//M06/6-31++G(d,p)双水平下,研究了Ca2+与2 种稳定构型Ala 配合物的手性转变及水分子的作用,得到以下结论:
3.1S-A_1 手性转变优势通道a 的总包能垒为134.8 kJ·mol-1,远低于Ala_1 手性转变的总包能垒257.5 kJ·mol-1;S-A_2 手性转变优势通道d 的总包能垒为235.3 kJ·mol-1,低于Ala_2 手性转变的总包能垒249.3 kJ·mol-1,Ca2+对Ala_1 和Ala_2 的手性转变分别具有较强和较弱的催化作用。在气相环境下,Ala_2 的分布远高于Ala_1,Ca2+与Ala 的配合物只能微量消旋。
3.2 水分子(簇)的催化使S-A_1 和S-A_2 手性转变反应优势通道的总包能垒分别降至40.8 和141.3 kJ·mol-1,在水汽环境下,Ala_1 与Ca2+的配合物可以很快消旋,Ala_2 与Ca2+的配合物可以缓慢消旋。
3.3 Ca2+对Ala 手性转变反应的某些基元有正催化作用,对另一些基元则有负催化作用,对整个手性转变过程起正催化作用,Ca2+的存在改变了Ala 手性转变的反应机理。
3.4 Ca2+与Ala 配位后,使不同构象Ala 的相对稳定性发生了显著变化。

