腺苷预处理对缺血性脑卒中大鼠血脑屏障通透性及AQP4表达的影响
许二妮, 庞艳利, 谭 军
脑卒中的发生率很高,缺血性脑卒中的比例很大。脑缺血后恢复血液供应可能导致更严重的脑功能障碍,这种现象称为缺血再灌注(ischemia reperfusion IR)。脑水肿是脑缺血再灌注损伤的常见后遗症。脑水肿的机制尚未完全阐明,可能与脑微循环,血脑屏障疾病和水通道蛋白等因素有关。血脑屏障通常起屏障作用,并维持中枢神经系统的内部环境。血脑屏障的结构完整性和功能取决于内皮细胞和星形胶质细胞表面水通道蛋白4( aquaporin-4,AQP4) 的表达及其活性形式OAPs( orthogonal arrays of particles) 的形成[1,2]。越来越多的研究发现AQP4的表达与血脑屏障通透性呈正相关。缺血性损伤后一系列病理生理变化破坏了血脑屏障的完整性,导致其通透性增加,致脑水肿形成。血脑屏障结构的完整性与脑水肿的形成密切相关,因此解决受损的血脑屏障问题已成为预防缺血再灌注损伤的关键[3]。使用神经保护剂改善脑缺血再灌注损伤受到越来越多的关注[4]。大量的实验研究表明,腺苷具有大脑保护作用。腺苷对缺血再灌注损伤的血脑屏障功能影响的先前研究尚未在文献中报道。因此,本实验探讨了腺苷预处理对缺血性卒中大鼠血脑屏障通透性和AQP4表达的影响,从血脑屏障的角度来探讨腺苷对脑缺血再灌注损伤的影响及其可能的脑保护机制,并为腺苷用于预防或减轻缺血性脑卒中后脑水肿的发病机制提供新思路。
1 材料与方法
1.1 实验动物与分组 健康雄性SD大鼠180只(250±30 g),在通风良好的动物笼中饲养。大鼠随机分为假手术组(F组)、模型组(IR组)、腺苷预处理组(AP组),每组60只。每组按术后执行时间分为4个亚组:6 h、24 h、48 h和 72 h (F6、24、48、72 h、ir6、24、48、72 h、AP6、24、48、72 h)。腺苷注射液1.5 mg/kg(生理盐水稀释至2 ml)于造模前3 d腹腔注射于AP组,每日1次,连续3 d;F、IR组于术前3 d腹腔注射生理盐水2 ml,每日1次,共3次。
1.2 主要仪器、药品与试剂 MACO线栓(北京西浓科技有限公司);腺苷注射液(沈阳光大制药有限公司);Evans Blue粉末(北京索莱宝科技有限公司);兔抗大鼠AQP4多克隆抗体(武汉博士德生物工程有限公司);兔SP试剂盒(北京中杉金桥生物技术有限公司);DAB辣根过氧化物酶显色试剂盒(上海碧云天生物技术有限公司)。
1.3 实验方法 AP组和IR组制作大脑中动脉闭塞( MCAO)模型。实验所需用具均75%酒精消毒。术前腹腔注射10%水合氯醛(0.3 ml/100g)麻醉,麻醉后固定在大鼠解剖专用手术台上,行颈正中切口,暴露右侧颈总动脉(common carotid artery,CCA),向近端分离出颈内动脉(internal carotid artery,ICA)及颈外动脉(external carotid artery,ECA)。无菌缝线结扎CCA和ECA后,动脉夹夹闭ICA,在ICA和ECA交叉口下方1.0 cm处用眼科剪在CCA上剪一斜小口,将MCAO线栓插入斜小口进入ICA,结扎CCA,松开动脉夹,连续插入MCAO线栓,使线栓上标记的黑点进入动脉交叉处,即插入深度约为18~20 mm,说明线栓到达大脑中动脉,固定并结扎线栓,然后缝合皮肤、消毒。栓塞2 h后,拔出约1 cm线栓,恢复大脑中动脉和Willis环的血供。F组仅切取颈部皮肤,分离ICA、ECA、CCA,不结扎暴露,逐层缝合消毒。本实验对大鼠生命体征进行严密观察,术后单独笼饲养。
1.4 脑水含量的测定 每个亚组随机取5只大鼠断头取脑,应用干、湿重法,将脑组织放在电子天平上,秤湿重,置入烤箱中(105 ℃,24 h),秤干重。脑组织水含量(%)=(湿重-干重)/湿重×100%。
1.5 EB渗透法定量分析血脑屏障通透性变化 缺血后2 h,再灌注各时间点前1 h,股静脉注射2%伊文思蓝溶液,剂量4 ml/kg,通过血液循环可以看到老鼠的口鼻、四肢变蓝;循环2 h后,0.9%氯化钠溶液200 ml以50 ml/min的速度经左心房灌注,可见透明液体从左耳廓流出,断头取脑称重;称取脑组织,置于甲酰胺溶液(1 ml/100 mg)中,匀浆,60℃恒温水浴中孵育24 h,离心(时间:20 min;转速:4000 r/min),提取上清液,用分光光度计测630 nm处吸光值(OD值),同时测定已知不同梯度的标准EB的OD值,绘制标准曲线。根据标准曲线计算出待测样品的EB含量。
1.6 AQP4免疫组化检测 烤片,脱蜡,水化,3%H2O2,室温孵育10 min,浸入0.01 mol/L柠檬酸缓冲液中,加热至100 ℃抗原修复5 min,加入一抗(兔抗大鼠AQP4多克隆抗体,稀释1∶100),4 ℃过夜,加入生物素标记二抗,室温孵育30 min。DAB显色,蒸馏水终止反应,封片。最后光学显微镜观察,采用HPIAS-2000病理图文分析系统,对每张切片大脑阳性细胞的着色强度进行平均光密度测量,就AQP4的表达分析其平均光密度值(mean optical density,MOD)。
2 结 果
2.1 各组大鼠不同时间点脑组织含水量 IR组和AP组与F组比较脑水含量均明显增多,差异具有统计学意义(P<0.05);AP组与IR组比较,脑水含量显著减少,差异具有统计学意义(P<0.05)(见表1)。
2.2 各组大鼠不同时间点脑内EB渗出变化 IR组和AP组EB渗出量与F组比较均明显升高,差异具有统计学意义(P<0.05);IR组和AP组组内比较,6 h~48 h脑组织EB渗出量呈逐渐上升趋势,48 h达到高峰后开始下降但仍高于正常水平;AP组EB渗出量均低于IR组对应时间点的EB渗出量,差异具有统计学意义(P<0.05)(见表2)。
2.3 各组大鼠不同时间点AQP4表达变化 光镜下,AQP4阳性产物主要分布于梗死周围水肿区、梗死侧皮质及血管、星形胶质细胞等。AQP4阳性为膜蛋白棕黄色或褐色的深染。AQP4蛋白在F组表达较弱,仅有少量阳性细胞;在IR组和AP组AQP4蛋白表达明显高于F组,AQP4蛋白表达在缺氧缺血后随时间延迟表达逐渐增多;与IR组比较,AP组AQP4蛋白表达逐渐下降(见图1)。
2.4 大鼠脑缺血再灌注损伤后EB渗出量与AQP4之间的相关性分析 经SPSS22.0软件检验,脑缺血再灌注损伤造模组(IR组和AP组)各时间点EB含量和AQP4均符合正态分布,用Pearson进行相关性分析。脑缺血再灌注损伤后AQP4的表达与EB含量(r=0.898)呈正相关,差异具有统计学意义(P<0.05)。脑缺血再灌注损伤后AQP4表达越高,血脑屏障通透性越高(见图2)。
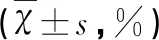
表1 各组大鼠不同时间点脑组织含水量的比较
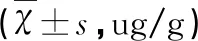
表2 各组大鼠不同时间点脑内EB渗出量的比较
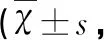
表3 各组大鼠脑缺血再灌注后不同时间点AQP4表达变化平均光密度值)
F组×400倍 IR-6 h组×400倍 IR-24 h组×400倍

IR-48 h组×400倍 IR-72 h组×400倍 AP-6 h组×400倍
AP-24 h组×400倍 AP-48 h组×400倍 AP-72 h组×400倍
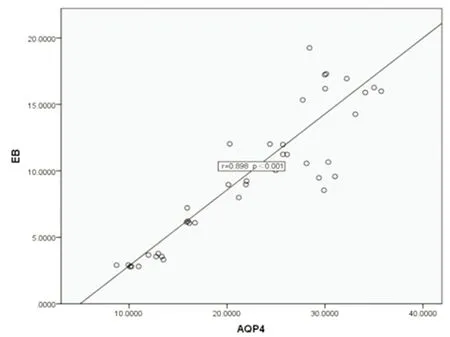
图2 AQP4表达与EB渗出量的相关性
由图1和表3可见:IR组和AP组AQP4表达与F组比较,差异具有统计学意义(P<0.05);IR组和AP组组内比较,6 h~48 h AQP4表达逐渐升高,于48 h达高峰,再灌注72 h时仍处于高峰;AP组AQP4表达明显低于IR组,差异均具有统计学意义(P<0.05)。
3 讨 论
缺血性卒中的治疗是尽快恢复脑血流灌注,但是脑血流灌注恢复后不可避免地会导致脑缺血再灌注损伤,这是一个非常复杂的病理生理过程。预防比治疗更重要,并且现在越来越关注预处理方法。脑缺血预处理的更多选择是药物预处理。研究发现,当将许多外源性药物用于脑缺血再灌注时,可通过不同途径刺激内源性腺苷的分泌,从而保护脑组织[5]。考虑到外源性腺苷也可用于治疗缺血再灌注脑损伤,本实验使用外源性腺苷探索其在缺血性卒中中的作用及其可能的相关机制。谭军等[6~8]该研究小组的论文在研究中得出了某些结论,为实验成功提供了基础。
血脑屏障是指脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障和由脉络丛形成的血浆和脑脊液之间的屏障。血液中多种溶质从脑毛细血管进入脑组织,有难有易,有些很快,有些较慢通过,有些则完全不能通过,这种有选择性的通透现象称为血脑屏障通透性。在生理条件下,血脑屏障严格控制电解质等水溶性物质进入脑组织,主要起屏障作用。脑水肿是脑缺血再灌注损伤的主要并发症之一。血管源性脑水肿主要是由于血脑屏障完整性受到破坏,导致血脑屏障通透性增加引起血浆蛋白、水分和电解质等大分子物质向外渗出所致的细胞间质水肿。血脑屏障是血液与脑组织之间的屏障,在生理条件下,血脑屏障严格控制电解质等水溶性物质进入脑组织,主要起屏障作用。脑缺血再灌注后的一系列病理生理变化损害了血脑屏障的完整性,增加了血脑屏障的通透性,促进了脑水肿的形成[9,10]。实验测定脑组织含水量即可以反应血脑屏障通透性的变化。本实验发现腺苷预处理后脑组织含水量较模型组明显减少。这表明腺苷预处理可减轻脑水含量从而达到保护脑组织的作用。正常情况下血浆白蛋白无法透过血脑屏障,EB是一种常用的偶氮染料制剂,与血浆蛋白高度亲和,因此EB在神经科学研究中常被用于示踪剂观察血脑屏障的完整性[11]。染色时,如果血脑屏障是完整的,血浆白蛋白无法透过血脑屏障,与血浆白蛋白结合的EB无法使其着色;相反如果血脑屏障被破坏,血浆白蛋白透过血脑屏障,与EB结合使其着色。本实验中,选用EB作为血脑屏障的示踪剂,它可以与血清蛋白结合形成伊文思蓝结合蛋白,仅当打开血脑屏障时伊文思蓝结合蛋白才能随血管内的蛋白成分进入组织间隙,渗出到脑组织中的EB的量与血脑屏障破坏的程度呈正相关[12]。运用其来测定缺血再灌注损伤后不同时间点的血脑屏障通透性。结果显示,缺血再灌注6 h,模型组和腺苷预处理组的EB渗出量与对照组相比有统计学差异,表明血浆蛋白渗出,血脑屏障已打开,通透性增加,并且呈上升趋势。它在48 h达到峰值,在72 h下降,但仍高于正常水平。这表明血脑屏障通透性与再灌注时间密切相关。这与王社军等[13]的发现是一致的,其通过测量脑组织中14C蔗糖的方法对大鼠大脑中动脉缺血再灌注后通透性的研究。与模型组相比,腺苷预处理组的EB渗出量明显减少,且差异具有统计学意义,表明腺苷可以抑制缺血再灌注后血脑屏障通透性的增加,从而减轻血管源性脑水肿,减轻脑损伤。
据报道,脑缺血再灌注损伤后脑水肿的形成与水通道(aquaporin,AQP)密切相关[14]。其中,AQP4是中枢神经系统的主要水通道,广泛分布于脑组织,与脑水肿形成的生理病理过程密切相关。AQP4在脑毛细血管星形胶质细胞足突和脑室室周上皮细胞中表达,通过调节细胞外空间维持脑细胞的渗透稳态,维持大脑的兴奋性,具有重要的生理功能[15]。有研究指出[16],AQP4的表达水平变化与脑水肿的发生发展及消退基本一致。传统观点认为,两侧静水压和渗透压的不平衡是导致血脑屏障渗透率增加的主要原因。随着分子生物学和蛋白质组学的发展,研究人员发现AQP4也参与调控血脑屏障的发育成熟,其表达水平与血脑屏障的完整性密切相关[17~19]。
本实验结果显示,脑缺血再灌注后6 h~48 h模型组及腺苷预处理组AQP4表达呈逐渐上升趋势,48 h达高峰,72 h仍处于较高水平。此过程与脑组织EB渗出量变化趋势一致。这符合Mardey[20]的研究模型即脑水肿所致急性水中毒,AQP4低表达在正常脑组织和高表达在脑水肿,表明AQP4与脑水肿密切相关。与Taniguchi等[21]对大脑中动脉闭塞后脑水肿的研究结果相似,AQP4 mRNA表达上调与脑组织含水量的结果平行。说明AQP4是胶质细胞、血液和脑脊液之间水调节和运输水分的重要通道,其表达水平与血脑屏障的完整性密切相关。也证实AQP4的表达与缺血再灌注后血脑屏障通透性损伤密切相关。由此可见,AQP4与脑水肿的形成密切相关,同时提示AQP4可能通过影响血脑屏障而参与水肿的形成。结果还显示腺苷预处理组AQP4表达低于模型组,说明腺苷具有神经保护作用,可能是通过某种通路途径抑制AQP4的表达,减轻血脑屏障的损伤,从而减轻脑水肿,达到治疗缺血性脑血管病的目的。
综上所述,腺苷预处理可能通过下调AQP4表达,改善血脑屏障通透性,减轻脑水肿,起到脑保护的作用,为腺苷预处理用于缺血性脑卒中的临床治疗提供了理论依据,但对于腺苷预处理下调AQP4表达的具体机制尚不清楚,其有待进一步研究。

