基于CCTA的影像组学列线图用于慢性心肌缺血预测的构建与价值
徐玉芸 何晓东 余苔痕 李杰
冠状动脉疾病(coronary artery disease,CAD)是导致全球心血管疾病发病率和病死率较高的主要原因[1]。其中临床稳定型冠心病患者占了大多数,在这些患者中,血运重建的实施主要参考心肌缺血程度,而非CAD严重程度[2]。中重度心肌缺血是经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗的首选指征[3]。因此,CAD患者心肌缺血的评估结果会直接影响其后续诊疗。冠状动脉CT血管造影(coronary CT angiography,CCTA)可用于冠状动脉狭窄及动脉粥样硬化斑块的检测和评估[4],目前常用于可疑CAD中、低风险患者的评估[5]。然而,冠状动脉狭窄并不一定与心肌血流改变有关。因此,单独使用CCTA评估CAD患者血流动力学的意义是不确定的[6-7],而这种限制在CAD高风险患者中尤其明显[8]。虽然双源CT心肌灌注成像能直接可视化心肌碘含量来识别心肌缺血[9-10],但该技术易出现的X线束硬化伪影与心肌缺血的灌注缺损表现类似,两者难以区分,可能增加诊断的假阳性率[11]。常规CCTA的对比度有限,通过视觉评估心肌密度变化来评估心肌缺血的准确性明显不足[12],常需要结合其他功能学检查。影像组学是新兴的大数据挖掘技术,利用该技术可提取常规医学影像中肉眼无法识别的深层定量特征进行疾病分析,具有低成本和无创性的特点[13-14]。同时,影像组学可以与临床数据进行关联,建立疾病预测模型[15-16]。目前,影像组学技术在心脏领域有了初步的研究成果[17],包括心肌梗死[18-19]、心肌病[20-21]、心肌炎[22]、心律失常[23],但是基于 CCTA图像的心肌影像组学特征与心肌缺血的关系尚不清楚。本研究假设基于CCTA图像的心肌影像组学特征可以检测缺血心肌与正常心肌之间的异质性,构建并验证1个基于CCTA的影像组学列线图,以用于慢性心肌缺血的预测,现将结果报道如下。
1 对象和方法
1.1 对象 选取2017年9月至2020年1月在浙江省人民医院行CCTA和单光子发射计算机化断层显象心肌灌注成像(single-photon emission computed tomography myocardial perfusion imaging,SPECT-MPI)检查的202例患者为研究对象,两项检查时间间隔≤7 d。根据美国心脏协会指南以SPECT-MPI作为评估慢性心肌缺血的金标准[24],确诊慢性心肌缺血99例。根据诊断时间不同进行7∶3比例的分组:2017年9月至2019年3月的141例患者为训练组,测试图像特征的稳健性并构建列线图;2019年4月至2020年1月的61例患者为验证组,验证所构建的列线图。纳入标准:(1)CCTA检查结果阳性,即至少有1根血管存在斑块;(2)典型或不典型心绞痛,症状持续>2个月;(3)心电图平板运动试验阳性;(4)CCTA 图像质量佳;(5)无其他心脏疾病;(6)最近3个月未发生过心肌梗死。排除标准:(1)有冠状动脉搭桥或冠状动脉支架植入史;(2)心率过快(>85次/min)或心律失常;(3)严重的肝、肾功能不全。本研究经医院伦理委员会审查通过(批准文号:2020QT275),所有患者知情同意。
1.2 方法
1.2.1 CCTA特征获取 使用东芝公司Toshiba Aquilion one 640层容积CT机行心电门控容积扫描,然后将图像传至三维工作站,对冠状动脉进行容积再现、曲面重组及多平面重组重建。2位放射科医生采用美国心脏协会推荐的冠状动脉15段分段法共同评估图像,获取CCTA特征(血管狭窄度、钙化程度、斑块总体积),若意见存在分歧,商议后得出最终意见。(1)血管狭窄度的评估:采用改良的Gensini评分系统对每个血管段的重度狭窄病变进行评分[25]。无异常为0分,1%~<50%狭窄为1分,50%~<75%狭窄为2分,75%~<100%狭窄为3分,闭塞(100%)为4分;总评分为每个血管段的重度狭窄病变得分之和。根据总评分进一步分级:<18分为轻度狭窄,18~41分为中度狭窄,>41分为重度狭窄。(2)钙化程度的评估:采用Agatston评分法。1~100分为轻度钙化,>100~400分为中度钙化,>400分为严重钙化。
1.2.2 心肌图像特征提取 将所有患者的动脉期CCTA图像以DICOM格式导入CQK人工智能软件进行全自动心肌切割,再在自动切割的二维心肌图像上进一步作手工修正(包括移除非心肌组织和心肌纤维丝),最后得到一个3D的心肌图像。然后对图像进行预处理,将图像重采样到(1×1×1)mm3体素尺寸,灰度级标准化至1~32标度。使用CQK分析平台自带的影像组学软件包进行影像组学特征提取,内容包括直方图特征、形态学特征、灰度共生矩阵特征、灰度游程矩阵特征。由于人工修正的差异可能导致提取特征存在差异,为了保证图像特征的稳健性和可重复性,本研究仅使用不同放射科医生手工修正最有效的特征[26]。分别提取2位放射科医生独立进行手工修正后获得的特征集,采用Spearman等级相关性分析2个特征集之间每个特征的rs值,rs>0.8的特征被认为是鲁棒特征。
1.2.3 影像组学标签模型建立与评估 使用最大相关最小冗余(maximum relevance minimum redundan cy,mRMR)算法对训练组提取的鲁棒特征进行筛选,以选择与实际慢性心肌缺血状态具有最大相关性的要素。确保所选特征彼此之间具有最小冗余,通过mRMR算法获得高相关性和低冗余的最优特征集,之后使用经典的最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)算法进行降维,使用支持向量机(support vector machi-ne,SVM)建立影像组学标签模型。为了演示所建立的影像组学标签模型与实际慢性心肌缺血状态之间的关联,本研究使用所建立的标签模型公式计算训练组每例患者的评分(即影像组学标签分数),以反映慢性心肌缺血发生概率;同时计算验证组患者的影像组学标签分数。绘制受试者操作特征曲线(ROC曲线)来评估影像组学标签模型在训练组和验证组患者中的诊断准确性。
1.2.4 列线图构建与验证 对训练组患者每个潜在预测变量包括临床风险因素(性别、年龄、高血压、糖尿病、高脂血症、吸烟等)、CCTA特征及影像组学标签分数进行单因素及多因素logistic回归分析,筛选出慢性心肌缺血的独立预测因子,再利用多因素logistic回归模型构建包含独立预测因子的影像组学列线图。在多因素logistic回归分析中,使用方差膨胀因子(variance inflation factor,VIF)对各个变量实施共线性诊断,VIF>10的变量表示存在严重多重共线性[27]。列线图的预测效能通过训练组和验证组数据进行分别验证,使用Hosmer-Lemeshow检验分析拟合度,列线图的诊断准确性采用ROC曲线分析,校正性能采用校准曲线评价。根据列线图计算每例患者发生慢性心肌缺血的风险值,绘制ROC曲线获得最佳诊断临界值,根据该临界值将所有患者分为高风险组和低风险组,比较两组患者发生慢性心肌缺血的比例。使用决策曲线评估列线图在训练组和验证组中的净效益。
1.3 统计学处理 采用SPSS 17.0和R 3.0.1统计软件,LASSO算法使用R软件glmmet软件包,列线图构建和校准曲线验证使用rms软件包。采用Kolmogorov-Smirnov检验对计量资料进行正态性检验,符合正态分布的计量资料用表示,组间比较采用两独立样本t检验。计数资料用百分率表示,组间比较采用χ2检验。采用单因素及多因素logistic回归分析慢性心肌缺血的独立预测因子并构建影像组学列线图。采用Hosmer-Lemeshow进行拟合优度检验,P>0.05提示模型拟合较好。绘制ROC曲线分析影像组学标签模型和影像组学列线图的诊断准确性,校准曲线分析校正性能,决策曲线分析净效益。P<0.05为差异有统计学意义。
2 结果
2.1 训练组与验证组临床特征比较 训练组与验证组患者在性别、年龄、高脂血症、糖尿病、高血压、吸烟、血管狭窄度、钙化程度、斑块总体积等方面比较,差异均无统计学意义(均P>0.05),见表1。在训练组或验证组内,有、无慢性心肌缺血患者在高脂血症、高血压、钙化程度、斑块总体积、影像组学标签分数等方面比较,差异均有统计学意义(均P<0.05);在性别、年龄、糖尿病、吸烟、血管狭窄度等方面比较,差异均无统计学意义(均P>0.05),见表2。

表1 训练组与验证组临床特征比较
2.2 影像组学标签模型的建立与评估 从每例患者CCTA图像上提取了328个纹理特征,在这些特征中,通过鲁棒性和再现性共保留174个特征。采用基于mRMR算法的特征选择法降低特征集的冗余度,选取20个mRMR排名最高的特征建立预测最优子集,见图1。最后采用LASSO算法对最优子集进一步降维并得到5个最佳特征,包括灰度共生矩阵的3个特征、灰度游程矩阵的1个特征和形态学的1个特征。训练组与验证组有、无慢性心肌缺血患者基于SVM构建的影像组学标签模型公式计算的心肌缺血预测评分比较,差异均有统计学意义(均P<0.05);该影像组学标签模型对两组患者的预测效能均较好,曲线下面积(AUC)、灵敏度、特异度分别为 0.852、0.743、0.873 和 0.832、0.818、0.785,见图2和插页图3。
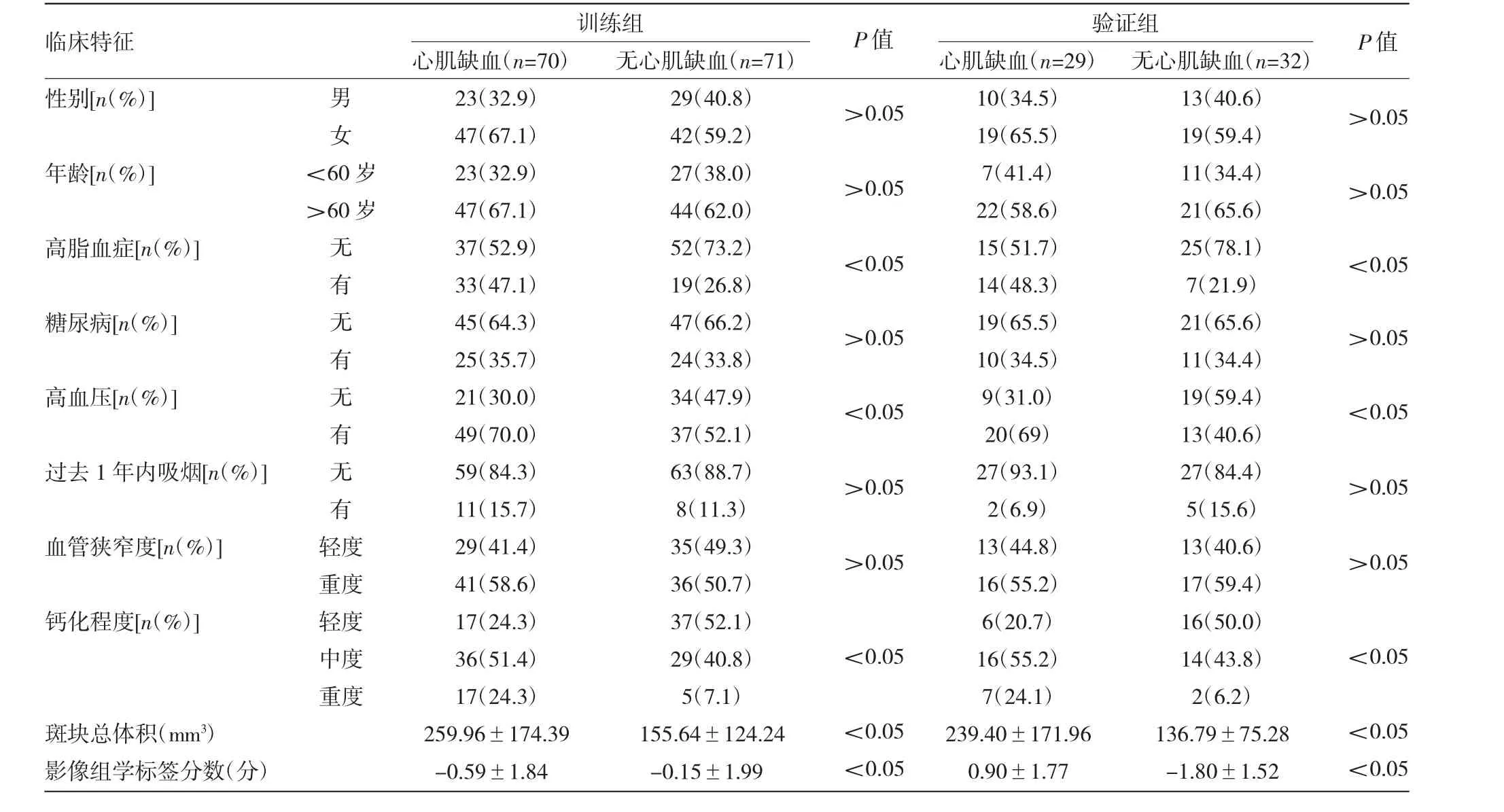
表2 训练组与验证组有无慢性心肌缺血患者的临床特征比较
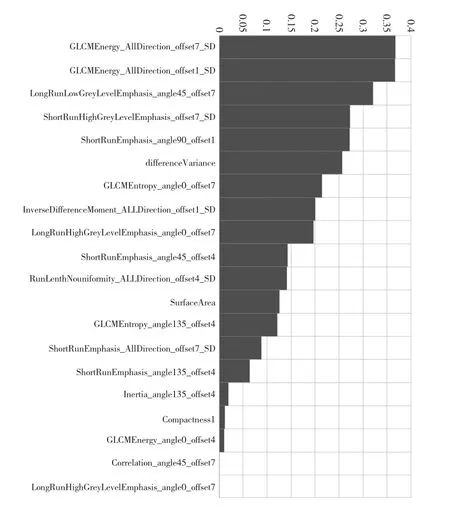
图1 基于最大相关最小冗余(mRMR)算法筛选出的影像组学特征与慢性心肌缺血的相关性排名
2.3 影像组学列线图的构建 经logistic回归分析显示,高血压、钙化程度、影像组学标签分数是训练组患者发生慢性心肌缺血的独立预测因子(均P<0.05),见表3;同时利用多因素logistic回归模型构建影像组学列线图,见图4。
2.4 影像组学列线图的验证 通过共线性诊断,高血压、钙化程度、影像组学标签分数的VIF分别为1.041、1.017和1.023,提示没有严重的共线性存在于这些因素中。Hosmer-Lemeshow检验显示在训练组和验证组中差异均无统计学意义(均P>0.05),表明拟合无偏差。ROC曲线分析显示,所构建的影像组学列线图预测训练组和验证组患者发生慢性心肌缺血的准确度、灵敏度、特异度分别为0.894、0.829、0.859 和 0.879、0.828、0.844;校准曲线显示,使用所构建的影像组学列线图预测训练组和验证组患者发生慢性心肌缺血的概率与实际慢性心肌缺血概率之间有良好的一致性,见图5。利用ROC曲线评估影像组学列线图、影像组学标签分数、钙化程度、高血压预测所有患者发生慢性心肌缺血的效能,其准确度分别为 0.856、0.816、0.722、0.596,提示列线图在诊断准确性方面优势明显,见插页图6。依据影像组学列线图计算所有患者发生慢性心肌缺血的风险值,绘制ROC曲线获得最佳诊断临界值0.473 9,根据临界值将所有患者分为高风险组92例和低风险组110例,高风险组患者发生慢性心肌缺血的比例(72例,78.2%)明显高于低风险组(27例,24.5%),差异有统计学意义(P<0.01)。决策曲线显示,影像组学列线图在训练组和验证组中均有很好的净效益,见插页图7。
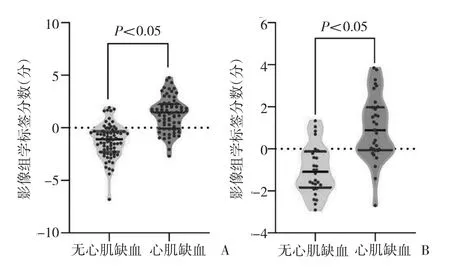
图2 训练组与验证组有、无慢性心肌缺血患者基于支持向量机(SVM)构建的影像组学标签模型公式计算的心肌缺血预测评分比较(A:训练组;B:验证组)
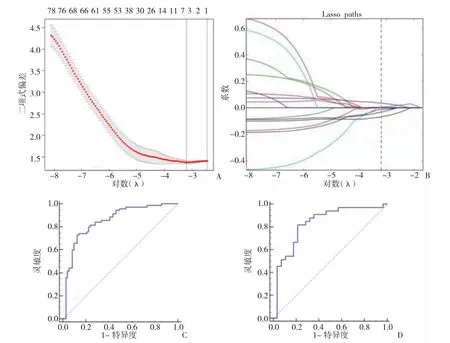
图3 基于最小绝对收缩与选择算子(LASSO)算法的纹理特征选择[A:部分似然偏差与对数(λ)的关系图。LASSO算法中的对数(λ)选择10倍交叉验证的最小准则,使用最小准则和1-SE准则在最佳值处绘制虚线垂直线;B:20个纹理特征的套索降维图。在对数(λ)序列中,用10倍交叉验证所选值绘制垂直线,并指出5个系数非零的特征;C:基于支持向量机(SVM)构建的影像组学标签模型公式计算的心肌缺血预测评分在训练组中预测的受试者操作特征曲线(ROC曲线);D:基于SVM构建的影像组学标签模型公式计算的心肌缺血预测评分在验证组中预测的ROC曲线]
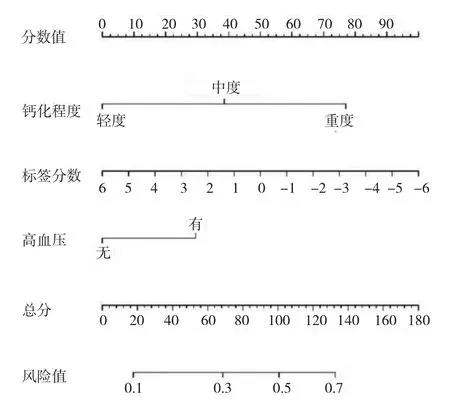
图4 基于训练组构建的影像组学列线图
表3 慢性心肌缺血预测因子的logistic回归分析
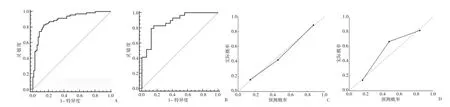
图5 影像组学列线图预测训练组和验证组患者发生慢性心肌缺血的受试者操作特征曲线(ROC曲线)及校准曲线(A:训练组ROC曲线;B:验证组ROC曲线;C:训练组校准曲线,虚线表示理想列线图所在的参考线,实线表示列线图预测性能偏差的修正;D:验证组校准曲线,虚线表示理想列线图所在的参考线,实线表示列线图预测性能偏差的修正)
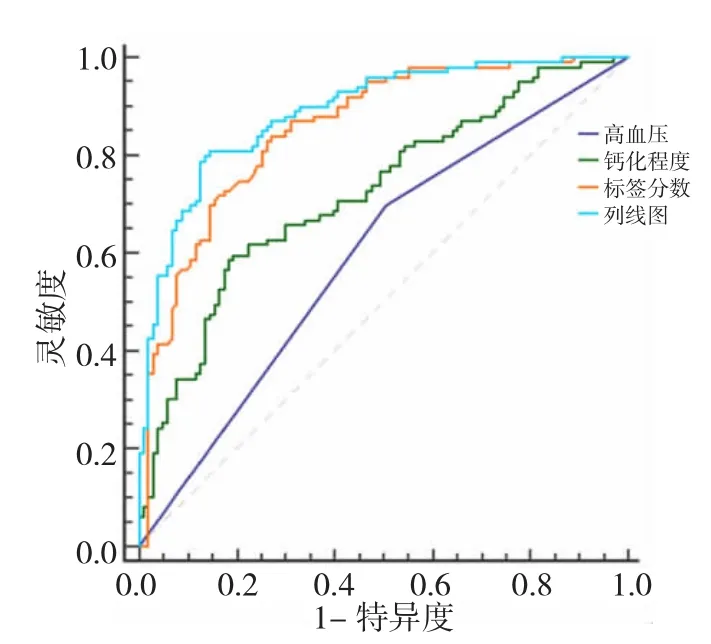
图6 影像组学列线图、影像组学标签分数、钙化程度、高血压预测所有患者发生慢性心肌缺血的受试者操作特征曲线(ROC曲线)
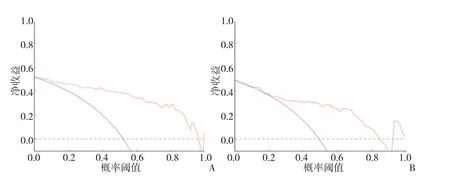
图7 影像组学列线图在训练组和验证组中的决策曲线(A:训练组;B:验证组;红线表示列线图的决策曲线,虚线表示所有患者发生慢性心肌缺血的假设决策曲线,黑色实线表示没有患者发生慢性心肌缺血的假设决策曲线)
3 讨论
心脏MRI、CT灌注成像、CCTA检查是评估心肌缺血的无创检查方法。其中心脏MRI检查诊断心肌缺血的灵敏度为0.860[27],但是存在检查时间过长、图像质量易受呼吸运动伪影影响等问题,其临床应用推广受到限制。CT灌注成像检查也可以对心肌缺血进行无创评估,当发生冠状动脉微循环障碍时,即可发生肉眼可见或不可见的心肌灌注减低或缺损区,但是受CT图像对比度的限制,在视觉上难以辨别这些改变,经常需要更大剂量对比剂及提高辐射剂量来克服这一问题[28],无疑会增加患者接受的辐射剂量以及发生肾损伤的风险[29]。CCTA可以从解剖学的角度估测冠状动脉狭窄度,适用于疑似冠心病的常规复查以及高危易发群体发生CAD的预测。然而,CCTA虽然能估测冠状动脉狭窄度,但不能识别和定位“罪犯血管”,即不能观察整体及局部心肌缺血情况,因此CCTA不能作为评估冠心病患者预后的首选影像学检查方法[26]。影像组学是基于包含像素强度和灰度的客观图像信息进行分析,可以从像素点上进行图像差异识别,其中像素点的强度由CT值体现。本研究采用常规的CCTA检查,首次应用心肌影像组学分析来评估慢性心肌缺血,结果利用影像组学特征很好地区分了正常心肌与缺血心肌。此外,还发现影像组学特征主要包括灰度共生矩阵中的能量,与相关研究结果(能量是区分正常心肌和瘢痕心肌组织最稳定的特征)相似[30]。
SPECT-MPI是评估心肌缺血的金标准,但存在空间分辨率较低而无法准确显示冠状动脉解剖结构、不利于早期心内膜下缺血的临床评估等缺点;此外,负荷药物的不良反应和连续扫描辐射剂量过大也限制了其广泛应用。本研究所构建的基于CCTA的影像组学列线图诊断准确性与SPECT-MPI检查结果接近。可见,基于CCTA的影像组学列线图既能评估血管狭窄度,又能评估心肌缺血,可能使部分不能耐受SPECT-MPI检查的患者受益。相关研究表明,CCTA斑块特征有助于提高对引起局部心肌缺血的冠状动脉的识别[31-32],但是不同观察者间易出现评估结果差异,因此目前对CCTA图像的评估主要依据冠状动脉钙化程度和血管狭窄度的视觉评估。本研究首次联合血管狭窄度、钙化程度、影像组学标签分数构建了影像组学列线图,其诊断准确性高于单一的影像组学标签模型,同时也验证了钙化程度是冠心病风险分层的潜在指标[33]。同时也应关注到,单一的影像组学标签模型的诊断效能还是高于钙化程度的,这提示了影像组学标签模型作为预测心肌缺血影像学标志物的潜能。列线图是一种广泛用于医学(特别是肿瘤学)的图形工具,它具有通过整合各种预后和决定因素来产生个体临床事件的预测可能性的能力,可以满足我们对生物学和临床整合模型的需求,并满足对个性化医学的需求。与传统的分期相比,列线图可以快速便捷地计算,且有更高的准确性,能帮助临床决策[34]。本研究基于CCTA构建的影像组学列线图是一种无创性诊断慢性心肌缺血的有效工具,有助于识别慢性心肌缺血高风险人群。
本研究有以下3个方面的优势:(1)使用自动切割全心肌来进行特征分析,相比于手工切割,具有操作简单、不耗时、稳定性较好的优势。(2)使用多个纹理特征构建影像组学标签模型来对慢性心肌缺血进行分析,诊断准确性较单一的临床诊断生物标志物明显提高。(3)结合CCTA特征与高血压这个临床风险因素构建影像组学列线图,具有良好的校正和区分能力。使用CCTA就可以识别慢性心肌缺血高风险人群,通过影像组学列线图可以加快和简化CAD诊断过程。但本研究也有一定的局限性:(1)回顾性分析了具有不同临床特征和CCTA适应证的患者,可能引起选择偏差的问题;(2)仅为单中心研究,可能不适用于其他中心相似人群。
综上所述,影像组学标签分数、钙化程度和高血压是慢性心肌缺血的独立预测因子;基于CCTA的影像组学列线图预测慢性心肌缺血是可行的,有助于识别慢性心肌缺血高风险人群,可能成为临床上无创性诊断慢性心肌缺血的一种有效工具。

