纳米金刚石对癫痫模型P65表达的影响*
都 昇, 宋君浩, 刘丹琼, 张 欣, 王泳怡, 易 杭, 谢晓桐, 何 嫣, 朱晓琴
广州医科大学基础医学院生理学教研室,广州 511436
纳米金刚石(Nanodiamond,ND)是新型的碳族纳米材料,ND有较强的生物相容性[1]和较好的细胞吸收率[2-3],无细胞毒性[3-4],具有抗氧化作用[5],且低浓度(50 μg/mL)的ND能降低炎性因子表达[6]。最新研究表明,每天定量使用ND的阿尔茨海默病(Alzheimer disease,AD)大鼠在水迷宫第3或第4天寻找平台时间就已经接近对照组的水平,其机制可能与ND降低AD大鼠脑内NF-κB以及炎性因子的水平有关,提示ND在神经系统疾病治疗中具有应用前景[7]。本课题组的ND采用激光液相烧蚀法一步合成,具有生物酶活性、催化活性、粒径小、分散性好、稳定性高等特点[8]。
NF-κB是具有多向转录调节作用的蛋白质,作为转录因子参与多种炎症基因的调控[9]。它由包括P65在内的5个成员组成[10]。NF-κB的激活与癫痫的神经病理过程密切相关[11-12]。研究表明,NF-κB亚单位P65的表达和磷酸化在癫痫时显著增加[13-14],而抑制NF-κB,则可以减少惊厥发作[12],提示NF-κB P65可能与癫痫有关。
本课题组前期研究表明,癫痫时P65及下游IL-1β、IL-6[15-16]等炎性因子表达水平上升,硫化氢可以下调P65的水平从而减少IL-1β、IL-6、TNF-α炎症因子的生成,抑制癫痫发作[17]。ND在神经系统取得了广泛的应用,但能否对癫痫起抑制作用尚未见报道。因此本研究选择ND进行干预,观察并记录其对癫痫动物模型的影响,对癫痫神经元活性的影响以及对癫痫发作后NF-κB P65表达水平的影响,以探讨ND抗癫痫的可能机制,为癫痫治疗提供依据。
1 材料与方法
1.1 实验材料
1.1.1 纳米金刚石的准备 纳米金刚石由广州医科大学生物医学材料研究室田秀梅副研究员提供,采用激光液相烧蚀法制备,在溶液中分布均匀,平均粒径3.63 nm。
1.1.2 实验动物 新生(24 h内)的Sprague-Dawley(SD)乳鼠,SPF级,雌雄不限;成年健康SD大鼠48只,雄性,体重(250±30)g,由广州中医药大学实验动物中心提供,实验室常规条件下饲养。
1.1.3 主要试剂 DMEM/F12培养液购自Hyclone公司;胎牛血清、Neurobasal Medium培养液、B-27添加剂购自Gibco公司;细胞增殖/毒性检测试剂盒(CCK-8)购自DOJINDO公司;戊四氮(pentylenetetrazole,PTZ)购自Macklin公司;Biozol试剂购自博日科技有限公司;逆转录试剂盒、qRT-PCR试剂盒购自ToYoBo公司;引物合成由上海Invitrogen生物工程公司完成;兔抗大鼠GAPDH、P65单克隆抗体购自CST公司;兔抗大鼠β-actin单克隆抗体购自北京博奥森生物技术有限公司;辣根过氧化物酶标记山羊抗兔IgG购自武汉博士德生物技术有限公司;BeyoECL Plus购自碧云天生物技术有限公司。主要仪器设备:荧光定量PCR仪(ABI7500 Fast);荧光显微镜(Olympus公司);二氧化碳(CO2)培养箱(Thermo公司);垂直电泳仪(Bio-Rad公司)等。
1.1.4 材料配制 种植培养液配制:体积分数90% DMEM/F12培养液,10%胎牛血清,1×105U/L青霉素和链霉素。维持培养液配制:98% Neuralbasal培养液,2%B-27添加剂,0.2 mol/LL-谷氨酰胺,1×105U/L青霉素和链霉素。无镁细胞外液配制:NaCl 145 mmol/L,KCl 2.5 mmol/L,HEPES缓冲液10 mmol/L,CaCl22 mmol/L,葡萄糖10 mmol/L,甘氨酸0.002 mmol/L,溶于1000 mL去离子水,NaOH调pH值7.0~7.2,过滤除菌。正常细胞外液配制:上述配方补充MgCl21 mmol/L,NaOH调节pH值至7.0~7.2,过滤除菌。
1.2 原代海马神经元分离培养
新生SD乳鼠,消毒,断头,取海马于D-hank’s溶液中,剪碎,0.25%胰蛋白酶37℃恒温水浴箱消化20 min,血清终止消化,200目细胞筛过滤,滤液1000 r/min离心5 min后弃上清,加入种植培养液重悬。种板后放入37.5℃、5%CO2细胞培养箱中培养4 h,换用维持培养液,继续培养48 h相同培养液全量换液,随后每隔2 d维持培养液全量换液,倒置显微镜定期观察细胞生长情况。
1.3 CCK-8法检测细胞活性
使用96孔板。每孔中加入10 μL CCK-8溶液并在37℃下孵育1 h,得到橙色的formazan,其吸光度(A)与海马神经元的活细胞数呈正比。酶标仪中450 nm波长测定每孔的A值。
1.4 CCK-8法进行纳米金刚石最佳浓度的测定
用PBS稀释ND至500 μg/mL。将海马神经元随机分为5组,用ND和维持培养液制备下列浓度ND:①正常对照组(ND 0 μg/mL);②ND 10 μg/mL组;③ND 20 μg/mL组;④ND 50 μg/mL组;⑤ND 100 μg/mL组。培养9 d的96孔板神经元以上述溶液处理24 h,CCK-8法测定A值,读数代表不同浓度下细胞活性。
1.5 细胞分组与造模
按照Sombati等[18]的方法建立海马神经元癫痫状态细胞模型。在6/96孔板中培养9 d的海马神经元用于以下评估。将细胞随机分成4组:①对照组(Control):正常细胞外液处理3 h,维持培养液处理24 h;②致痫组(EPI):无镁细胞外液预处理3 h,维持培养液处理24 h;③ND干预组(ND + EPI):含20 μg/mL ND的维持培养液中预培养4 h,无镁细胞外液处理3 h,恢复ND维持培养液培养24 h;④ND对照组(ND):处理方法同上,无镁细胞外液改为正常细胞外液。
1.6 侧脑室注射
大鼠称重,腹腔注射2%戊巴比妥钠(30 mg/kg)后麻醉,固定在脑立体定位仪上,2枚钢针尖端分别对准耳蜗固定头颅,牙齿固定针固定牙齿。剪开皮肤,剥离筋膜暴露前囟,根据Paxinos等[19]的方法坐标定位:前囟后0.9 mm,矢状缝旁开1.6 mm,硬脑膜下4.0 mm,为侧脑室注药点,钻孔,微量注射器以2 μL/min的速度注射。ND对照组与ND干预组侧脑室注射100 μg/mL ND[3]10 μL,对照组与致痫组注射等剂量生理盐水。留针10 min,缓慢退出,缝合伤口并消毒。
1.7 动物分组与戊四氮诱导癫痫
将大鼠随机分为与细胞分组相同的4组,每组12只大鼠。PTZ溶于生理盐水中配成1%溶液。癫痫模型制备:于侧脑室注射完成2 h后,致痫组(EPI),ND干预组(ND+ EPI)采用首剂PTZ(40 mg/kg)腹腔注射,观察大鼠行为学变化,若10 min后未观察到典型发作,则再以原始剂量的半量(20 mg/kg)注射,之后每隔10 min补加小剂量PTZ(10 mg/kg),直至大鼠癫痫发作,记录每组癫痫发作级别、潜伏期、持续发作时间。对照组,ND对照组大鼠给予等剂量生理盐水腹腔注射。根据Racine癫痫发作标准[20]评估癫痫发作强度。0级:无发作;Ⅰ级:口周及头面部肌肉抽搐;Ⅱ级:头面部痉挛伴点头样发作;Ⅲ级:前肢阵挛发作;Ⅳ级:前肢强直阵挛发作伴随直立;Ⅴ级:全身强直发作伴摔倒。其中Ⅰ~Ⅱ级为轻型发作,Ⅲ~Ⅴ级为重型发作。
1.8 脑电图(EEG)记录
各组大鼠麻醉后称重。固定,定位海马区(大脑左侧后3.8 mm,矢状缝旁边2.5 mm),钻孔并通过硬脑膜将电极植入硬膜下3.0 mm。缝合部分皮肤,活性碘消毒,将大鼠置于屏蔽笼中。待大鼠清醒后引导电极信号通过BL-420S生物功能实验系统,一边腹腔注射PTZ一边记录大鼠癫痫发作时海马脑电图的变化。记录时间为1 h。
1.9 Western blot检测海马组织或神经元P65蛋白的表达
各组造模成功4 h后SD大鼠麻醉处死,取海马组织或培养至第9天造模完成的海马神经元,RIPA裂解提取蛋白,4℃ 12000 r/min离心5 min,取上清。BCA法定量,10%SDS-PAGE垂直电泳,转移至PVDF膜,5%脱脂奶粉室温下封闭1.5 h,TBST漂洗,兔抗大鼠P65单克隆抗体(1∶1000)和兔抗大鼠β-actin(1∶3000)或兔抗大鼠GAPDH(1∶3000)4℃下孵育过夜,再用辣根过氧化物酶标记山羊抗兔IgG(1∶5000)室温下孵育1 h后进行ECL显色,蛋白条带采用Bio-Rad成像分析系统进行检测。使用Image J软件测定所得条带灰度值,P65蛋白表达水平的标准化以GAPDH/β-actin作为内参处理。
1.10 qRT-PCR检测海马组织或神经元P65 mRNA的表达
每50 mg大鼠海马组织溶于500 μL Biozol,神经元细胞6孔板每孔加入Biozol 200 μL提取RNA,逆转录合成cDNA。β-actin的引物序列:上游5′-GGAGATTACTGCCCGGCTCCTA-3′,下游5′-GACTCATCGTACTCCTGCTTGCTG-3′,扩增片段长度为150 bp。NF-κB P65的引物序列:上游5′-CGATCTGTTTCCCCTCATCT-3′,下游5′-ATTGGGTGCGTCTTAGTGGT-3′,扩增片段长度为275 bp。qRT-PCR反应条件为95℃ 5 s;55℃ 10 s,72℃ 15 s,共40个循环;95℃ 15 s,60℃ 15 mins,95℃ 15 s。分析P65和β-actin RNA循环阈值(Ct)之差(ΔCt)计算得到相关基因的表达情况。计算对比的样本间基因表达的差异(ΔΔCt),表达差异的倍数(relative quantity,RQ)为2-ΔΔCt,以对照组的相对表达量RQ值为1,实验组相对表达量是相对于对照组的变化倍数[21]。
1.11 统计学分析

2 结果
2.1 CCK-8检测不同浓度纳米金刚石对海马神经元细胞活性的影响
使用CCK-8法检测不同浓度ND对海马神经元活性的影响。不同浓度ND作用于神经元细胞24 h,各浓度ND组吸光度分别为:10 μg/mL组(1.042±0.079),20 μg/mL组(1.205±0.028),50 μg/mL组(1.153±0.016),100 μg/mL组(1.143±0.015);正常对照组吸光度(1.096±0.002)。各浓度ND组与正常对照组相比,细胞活性未见下降,表明10、20、50、100 μg/mL浓度的ND在共孵育24 h不引起细胞毒性,与细胞相容良好,并在20 μg/mL时,细胞活性达到最高值,相比其他浓度增高更明显,与对照组比较差异具有统计学意义(P<0.05)。
2.2 CCK-8检测ND对癫痫细胞模型的影响
结果显示,无镁细胞外液处理后,各组的A值分别为:对照组(0.553±0.007),EPI组(0.281±0.009),ND+EPI组(0.463±0.032),ND组(0.525±0.014)。EPI组、ND+EPI组与对照组比较A值明显降低,表明EPI组、ND+ EPI组细胞活性下降(均P<0.05),说明无镁细胞外液处理造成的病理性癫痫状态会造成神经元损伤和细胞凋亡;但与EPI组相比,ND+EPI组A值提高,即细胞活性相对增高(P<0.05),说明ND对癫痫海马神经元有一定保护作用。ND对照组与对照组比较,差异无统计学意义。
2.3 大鼠行为学表现
模型组24只大鼠中有4只死亡,其余20只均有癫痫发作,造模成功率为83.3%。EPI组大鼠在注射PTZ后,依次出现Ⅰ~Ⅴ级发作的表现,其潜伏期短(20.40±4.61)min,持续时间较长(101.60±11.24)s,发作等级为Ⅳ~Ⅴ级(M=4.5);ND(100 μg/mL)+EPI组在多次腹腔注射PTZ后造模成功,较EPI组其癫痫发作潜伏期[(28.40±7.56)min]明显延长(P<0.05),持续时间[(66.40±10.14)s]缩短(P<0.05),发作等级为Ⅲ~Ⅳ级(M=3.5),较EPI组下降(P<0.05)。对照组、ND组的大鼠注射生理盐水后发作等级为0级,见图1。
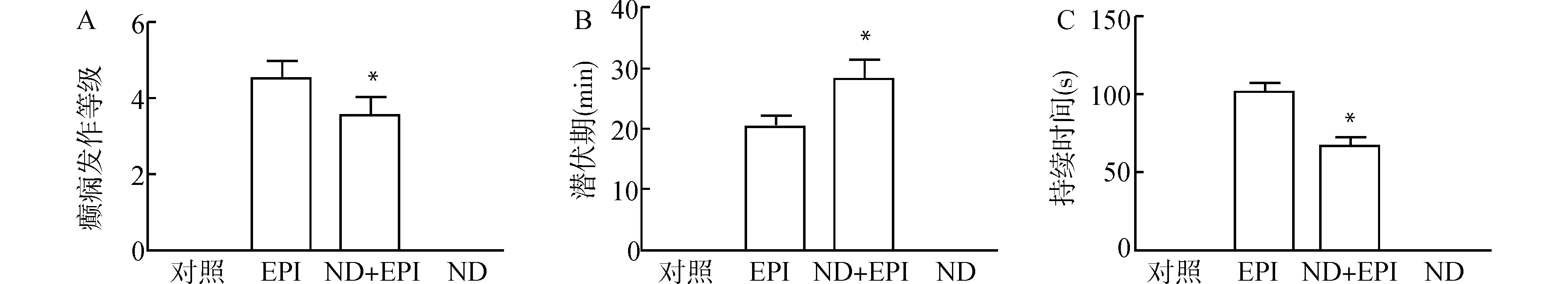
A:癫痫发作等级中位数;B:潜伏期;C:持续时间;与致痫组(EPI)比较,*P<0.05图1 各组癫痫大鼠行为学数据Fig.1 The behavioral data of epileptic rats
2.4 脑电图检测结果
脑电图检测结果显示,对照组(57.465±4.502)μV、ND组(67.211±3.131)μV,未出现痫样波,为正常脑电图波形,波形规律,波幅小;EPI组(192.465±5.548)μV,记录到明显的尖波、棘波等痫样波,脑电波幅明显增大,ND+EPI组(132.915±3.448)μV,痫样波减弱或消失,波幅较EPI组减小(P<0.05),见图2。
2.5 qRT-PCR检测癫痫细胞模型/大鼠海马P65 mRNA表达
海马细胞体外培养的qRT-PCR检测结果分析显示,与对照组相比,EPI组、ND+EPI组P65 mRNA表达增高,其中EPI组表达最高,与对照组相比差异有统计学意义(均P<0.05)。与EPI组相比,ND+EPI组P65 mRNA的表达显著降低(P<0.05)。海马组织的qRT-PCR检测结果分析显示,与对照组相比,EPI组、ND+EPI组P65 mRNA表达增高(均P<0.05)。与EPI组相比,ND+EPI组P65 mRNA的表达降低,差异有统计学意义(P<0.05)。见图3。
2.6 Western blot检测癫痫细胞模型/大鼠海马P65蛋白表达
海马细胞体外培养的Western blot结果分析显示,与对照组相比,EPI组、ND+EPI组P65蛋白表达增高,其中EPI组表达最高,与对照组相比差异有统计学意义(均P<0.05)。与EPI组相比,ND+EPI组P65蛋白的表达降低(P<0.05)。海马组织的Western blot结果分析显示,与对照组相比,EPI组、ND+EPI组P65蛋白表达量增高,其中EPI组表达最高,与对照组相比差异有统计学意义(均P<0.05)。与EPI组相比,ND+EPI组P65蛋白的表达相对降低(P<0.05)。见图3。

A:对照组脑电图波形;B:EPI组脑电图波形;C:ND+EPI组脑电图波形;D:ND组脑电图波形;E:各组波幅比较;与对照组比较,*P<0.05;与致痫组(EPI)比较,#P<0.05图2 各组大鼠海马脑电记录Fig.2 Electroencephalogram(EEG)of rat hippocampus in each group

A:细胞P65 mRNA表达情况;B、C:细胞P65蛋白表达情况;D:海马组织P65 mRNA表达情况;E、F:海马组织P65蛋白表达情况;与对照组比较,*P<0.05;与致痫组(EPI)比较,#P<0.05图3 各组细胞及海马组织P65 mRNA及蛋白表达情况Fig.3 The expression levels of P65 mRNA and protein in hippocampal neurons and hippocampal tissue
3 讨论
ND是一种新型的纳米材料,近年来在生物医学领域有较大的研究进展。在本实验中,我们通过不同浓度的ND对海马神经元进行孵育,发现ND不会降低细胞活性,且在20 μg/mL时明显提高神经元的活性,进一步动物实验发现,侧脑室注射ND不会引起动物脑电图的改变。研究表明,在使用ND对不同系统的细胞进行细胞毒性和遗传毒性的测试中,低浓度的ND(<250 μg/mL)无细胞毒性,且可以被吸收[4]。此外,ND可以减少γ射线对红细胞带来的损伤[5]。在神经系统的研究表明,ND可以被神经细胞吸收,且不产生细胞毒性,通过颅内注射也不会引起大鼠行为改变[3]。
正常情况下,NF-κB与抑制性蛋白结合,以非活性形式存在于细胞核外,当受到刺激活化后,进入核中与靶基因驱动子κB上的结合位点结合,调节编码趋化因子、细胞因子、粘附分子、炎症反应相关酶和抑制凋亡因子等炎性反应基因的转录[22]。PTZ和无镁细胞外液广泛用于动物和神经细胞癫痫造模[18]。近年研究发现,在不同的癫痫模型中,NF-κB激活增加且表达升高[23-24]。N-甲基-d-天冬氨酸(NMDA)受体是一种由不同亚基构成的异聚体复合物,其表达增多会导致神经元兴奋毒性,是导致癫痫的重要原因之一[25]。研究表明,NF-κB亚单位P65在NMDA导致的兴奋毒性的细胞核中积聚;通过沉默P65的表达,可以延缓NMDA诱导的海马神经元的损伤[26]。因此,NMDA受体过度激活诱导的兴奋毒性与P65水平的提高关系密切。我们的细胞和动物实验发现,致痫组的P65在mRNA和蛋白质水平相比对照组明显提高,与上述研究结果相符,其表达水平上升可能与NMDA在癫痫状态下表达增高有关。
为了探究ND能否对癫痫起抑制作用,我们使用CCK-8法检测不同组别的乳鼠海马神经元细胞活性,发现致痫组、ND干预组相比对照组细胞活性下降,但ND干预组的细胞活性较致痫组提高。动物实验结果显示,致痫组癫痫发作迅速,痫样波明显;ND干预组较致痫组癫痫发作潜伏期明显延长,而痫样波减弱。以上结果说明ND可以抑制大鼠的癫痫发作。
为进一步探究ND抑制癫痫的机制,我们对乳鼠海马神经元和大鼠海马组织进行了Western blot和qRT-PCR分析。结果表明,致痫组的P65蛋白/mRNA水平升高,而ND干预组的P65蛋白/mRNA水平相比致痫组明显下降,与Alawdi等[7]在老年痴呆大鼠的研究中的结论相符,其进一步实验表明,NF-κB水平下调使信号传导及转录激活蛋白3(STAT3)的磷酸化水平增加以及B淋巴细胞瘤-2基因(bcl-2)表达水平下降,减少AD神经元的凋亡,提示ND下调NF-κB水平从而缓解AD可能与减少细胞凋亡有关。同时,ND可以显著降低巨噬细胞中炎性因子(TNF-α、CCL2以及IL-1β)的基因表达[6]。因此,我们推测ND抑制癫痫的可能机制为:通过下调NF-κB的水平,减少炎性因子,以此抑制癫痫发作。
研究表明,ND具有与金刚烷类似的金刚烷核结构,后者可通过优先阻断NMDA受体的过度激活来延缓AD的发展,且不会破坏正常的神经元活动[7]。本研究表明,ND可以通过下调NF-κB的水平从而抑制癫痫发作;沉默NF-κB亚单位P65又可以延缓NMDA诱导的海马神经元损伤。ND是否也能通过类似金刚烷的机制来阻断痫性发作时NMDA受体的过度激活,从而抑制癫痫,还有待进一步研究。

