敲除NLRP3通过增加Treg细胞减轻右旋糖酐硫酸钠盐诱导的肠道炎症*
吴琼丽, 冯玉琨, 李 舸, 吴长有, 杨 扬, 彭延文
1中山大学中山医学院免疫学研究所,广州 510080 2海南省人民医院神经内科,海口 570311 3广东省实验动物监测研究所,广州 510663 中山大学附属第三医院 4肝脏外科 5生物治疗中心,广州 510080
炎症性肠病(inflammatory bowel disease,IBD)是胃肠道的慢性炎症性疾病,临床主要包括:克罗恩病和溃疡性结肠炎。多种病因被认为与IBD有关,如环境变化、一系列易感基因变异、肠道微生物菌群异常以及异常的免疫应答[1]。炎性小体是一组可被多种内源性应激信号激活的胞质蛋白复合物,在机体免疫反应和疾病发生发展过程中具有重要作用。迄今为止,已经鉴定出至少8种炎性小体亚型,其中研究最多的是核苷酸结合寡聚结构域和富亮氨酸重复的pyrin 3结构域(nucleotide-binding oligomerization domain,leucine-rich repeat and pyrin domain-containing 3,NLRP3)。已有的研究结果显示,NLRP3的活化激活Caspase-1,将促炎细胞因子IL-1β和IL-18从其前体转化为生物活性形式,上调促炎因子水平,导致炎症[2-3]。
越来越多的研究表明,NLRP3炎症小体的不可控激活在肠道炎症的发病机制中起着至关重要的作用[4]。Bauer等[5]报道,NLRP3缺陷型(NLRP3-/-)小鼠的IBD严重程度比野生型(WT)小鼠明显降低。而NLRP3炎性小体的特异性抑制剂MCC950,也通过抑制典型和非典型NLRP3炎性小体缓解结肠炎症状[6]。
目前,NLRP3的研究多集中在髓系细胞上,但最近的研究表明,小鼠和人的CD4+T淋巴细胞以及上皮细胞中均有NLRP3表达[7-9]。CD4+T细胞亚群的失衡与肠道黏膜炎症密切相关[10]。此外,Bruchard等[11]报道NLRP3可通过炎症小体调节Th2分化。但NLRP3对CD4+T细胞分化的影响与IBD发病机制的关系尚不十分清楚。因此,我们利用右旋糖酐硫酸钠盐(dextransulfatesodium,DSS)建立小鼠IBD模型,并比较WT IBD和NLRP3-/-IBD小鼠病理状态、CD4+T细胞亚群的差异。结果表明,NLRP3的缺失减轻了DSS诱导的小鼠IBD症状,这与派伊尔结(PPs)和脾脏中Foxp3+Treg细胞的增加有关。体外分化实验也证实了NLRP3缺失可促进Foxp3+Treg细胞分化。提示缺失NLRP3炎性小体在DSS诱导的IBD中可以促进Foxp3+Treg细胞生成,减轻肠道黏膜炎症。
1 材料与方法
1.1 实验动物
雄性C57BL/6小鼠24只,8~12周龄,购自南京模型实验动物中心,于中山大学无菌饲养。NLRP3-/-小鼠(B6.129S6-Nlrp3tm1Bhk/J)24只购自美国杰克逊实验室,由广东省实验动物监测研究所饲养繁殖。收集尾巴活检进行基因分型验证。所有与小鼠相关的实验都采用年龄和体重匹配的小鼠,所有实验用鼠共48只。
1.2 试剂
纯化的anti-CD3和anti-CD28购自BD Biosciences(美国)。佛波酯(PMA)和Ionomycin购自Sigma-Aldrich公司(美国)。ELISA Kit IFN-γ、IL-10、IL-17A、IL-1β和IL-6,均购自BD Biosciences公司(美国)。使用下列抗体进行细胞表面和细胞内染色:CD3-PE-CF594、CD4-FITC、CD4-APC-Cy7、CD19-PE-Cy7、CD25-APC、CD11b-Percp、Ly6G-APC-Cy7、NK1.1-AF700、IL-4-PE-Cy7、IFN-γ-APC、Foxp3-PE、IL-17-APC-Cy7、Zombie GreenTMFixable living Kit均来自BD Biosciences公司。重组小鼠IL-2、重组小鼠TGF-β购自R&D公司(美国)。
1.3 结肠炎的诱导和评估
DSS购自MP Biomedicals公司(美国),用于诱发小鼠急性结肠炎。将2.5%(W/V)DSS溶于无菌水中,供小鼠饮水7 d。每天测量并记录动物体重。7 d后处死动物,测量盲肠交界处到肛门边缘距离即为结肠的长度。疾病的严重程度通过体重减轻、结肠长度和结肠的组织病理学评分来评估。苏木精-伊红染色对结肠组织进行组织学分析。组织病理学评价:炎症(I)(0,无;1,轻微;2,温和;3,严重);范围(E)(0,无;1,黏膜;2,黏膜及黏膜下层;3,透壁的);再生(R)(4,无组织修复;3,表面上皮不完整;2,损伤腺窝再生;1,几乎完全再生;0,完全再生或组织正常);腺窝损伤(C)(0,无;1,基底1/3受损;2,基底2/3受损;3,仅表面上皮完整;4,全隐窝和上皮丢失);参与率(P)(1,1.1%~;2,26%~;3,51%~;4,76%~100%),均根据先前的报道。
1.4 酶联免疫吸附法检测细胞因子
收集小鼠血清标本,采用酶联免疫吸附法(ELISA)检测血清中IFN-γ、IL-10、IL-17A、IL-1β和IL-6,均按照说明书进行。96孔平底板包被捕获抗体,4℃孵育过夜,板用0.05%吐温20/PBS洗涤,1%牛血清白蛋白(BSA)/PBS室温封闭1 h。血清样本和倍比稀释的标准品加入板中,37℃孵育2 h。加入检测抗体孵育。0.05%吐温20/PBS洗涤,TMB底物显色后用10% H2SO4终止反应,酶标仪在450 nm波长下测定吸光度(A)值。实际细胞因子浓度由标准品拟合的公式计算。
1.5 Western blot检测蛋白含量
在距肛门边缘0.5 cm处收集结肠样本,将其切碎、匀浆并溶解在RIPA缓冲液(Thermo Scientific,美国)中,加入蛋白酶抑制剂和苯甲基磺酰氟(PMSF)(Solarbio,中国)匀浆并在冰上孵育30 min,在4℃下12000 r/min离心25 min。上清液中的总蛋白浓度由Pierce BCA蛋白检测试剂盒(Thermo Scientific,美国)测定。等量的蛋白用10% SDS-PAGE凝胶电泳(EpiZyme,中国)分离,电转移到PVDF膜上。室温下用5%脱脂奶粉在TBST中封膜1 h,于4℃与一抗孵育过夜。本研究的抗体包括:单克隆大鼠抗小鼠IL-10(1∶1000,Abcam,英国)、单克隆兔抗小鼠Foxp3(1∶1000,Abcam,英国)、多克隆兔抗小鼠IL-17A(1∶1000,Abclonal,中国)、多克隆兔抗小鼠IL-6(1∶1000,Affinity,美国)、单克隆兔抗小鼠GAPDH(1∶1000,Cell Signal Technology,美国)。以GAPDH作为内参对照。以0.1%的TBST洗涤后,膜分别与辣根过氧化物酶标记的二抗孵育(1∶1000,Cell Signaling Technology,美国)。在机器上用化学发光检测试剂盒(ECL)(Amersham Biosciences,中国)对标记的蛋白进行曝光处理。
1.6 流式细胞术对表面标记物和细胞内细胞因子的检测
用含0.1% BSA和0.05%叠氮化钠的PBS缓冲液洗涤细胞后进行细胞表面标记物染色。细胞内细胞因子染色:在Brefeldin A存在的情况下,用PMA+ Ionomycin(Sigma,美国)刺激细胞(2×106/mL)6 h。用PBS洗涤细胞2次,于4℃避光用表面标记物和活/死抗体标记30 min。用含0.1% BSA和0.05%叠氮化钠的PBS缓冲液洗涤2次,4%多聚甲醛固定,然后在含0.1%牛血清白蛋白、0.1%皂苷和0.05%叠氮化钠的PBS缓冲液中破膜过夜。以上染色细胞均用FACS Aria Ⅱ(Becton Dickinson,San Jose,美国)检测,用FlowJo软件(TreeStar,San Carlos,美国)分析。
1.7 Treg的体外分化
使用Naive CD4+T细胞纯化试剂盒(Miltenyi Biotec,德国)从小鼠脾细胞中纯化初始CD4+T细胞。将纯化的初始CD4+T细胞(2×106/mL)悬浮在RPMI 1640培养液中,在重组IL-2(20 ng/mL)和TGF-β(5 ng/mL)存在下,抗CD3抗体联合抗CD28抗体分别刺激3 d和5 d。
1.8 苏木精-伊红和免疫组化染色
取出结肠组织,浸泡在4%多聚甲醛中。经梯度脱水,石蜡包埋,苏木精-伊红(HE)染色。为了评估细胞凋亡,使用原位细胞死亡检测试剂盒(Roche Applied Science)按照制造商的方案进行TUNEL染色。
1.9 统计学分析
2 结果
2.1 NLRP3缺失可以抑制DSS诱导的结肠炎
为了探讨NLRP3在DSS诱导的急性结肠炎中的作用,我们将WT小鼠和NLRP3-/-小鼠连续7 d饲喂含2.5% DSS的饮用水。前4 d,两组小鼠的体重没有差异。第5 d到第7 d,WT小鼠体重下降幅度大于NLRP3-/-小鼠,两组间的差异随着时间逐渐扩大(图1A)。在本研究中,结肠长度也被记录作为小鼠结肠炎进展的指标,在第8天收集并测量所有结肠组织(图1B),DSS处理的WT IBD小鼠和NLRP3-/-IBD小鼠的结肠组织长度均短于其对照组。有趣的是,尽管两组未经DSS处理的小鼠结肠长度没有差异,但经DSS处理后,WT IBD组小鼠的结肠长度明显短于NLRP3-/-IBD组(图1B和1C)。这提示NLRP3促进了DSS诱导结肠炎。结肠组织病理学检查证实,经DSS处理后,与NLRP3-/-IBD组小鼠相比,WT IBD组小鼠有更多的炎症细胞浸润黏膜结构和黏膜下水肿(图1D),这些单核细胞浸润程度与局部组织损伤的严重程度相当,WT IBD组小鼠的病理评分高于NLRP3-/-IBD组小鼠(图1E)。
已有文献报道DSS诱导的IBD与结肠上皮细胞的凋亡有关。为了验证NLRP3在结肠上皮细胞凋亡中的作用,而不仅是DSS诱导的细胞凋亡。我们对WT和NLRP3-/-小鼠的正常结肠组织中进行TUNEL染色,WT对照组和NLRP3-/-对照组小鼠的凋亡细胞数量相当,说明仅NLRP3缺乏不能导致上皮细胞凋亡。然而,饲喂DSS后,WT IBD组小鼠结肠上皮细胞出现了明显的凋亡细胞,而NLRP3-/-IBD组小鼠结肠上皮细胞的凋亡情况较WT IBD小鼠明显减轻(图2)。这表明NLRP3参与了DSS诱导的上皮细胞凋亡。

1:WT Control;2:WT IBD;3:NLRP3-/-Control;4:NLRP3-/-IBD;A:体重变化,数值以减重后的百分比表示;B、C:4组小鼠结肠长度;D;远端结肠HE染色,标尺=100 μm,放大倍数为40倍和100倍;E:小鼠结肠组织病理学评分,单因素方差分析;n=6,*P< 0.05,**P< 0.01图1 在DSS诱导的结肠炎中NLRP3-/-小鼠的结肠炎症进展减缓Fig.1 Alleviation of colon inflammation in NLRP3-/- mice with DSS-induced colitis
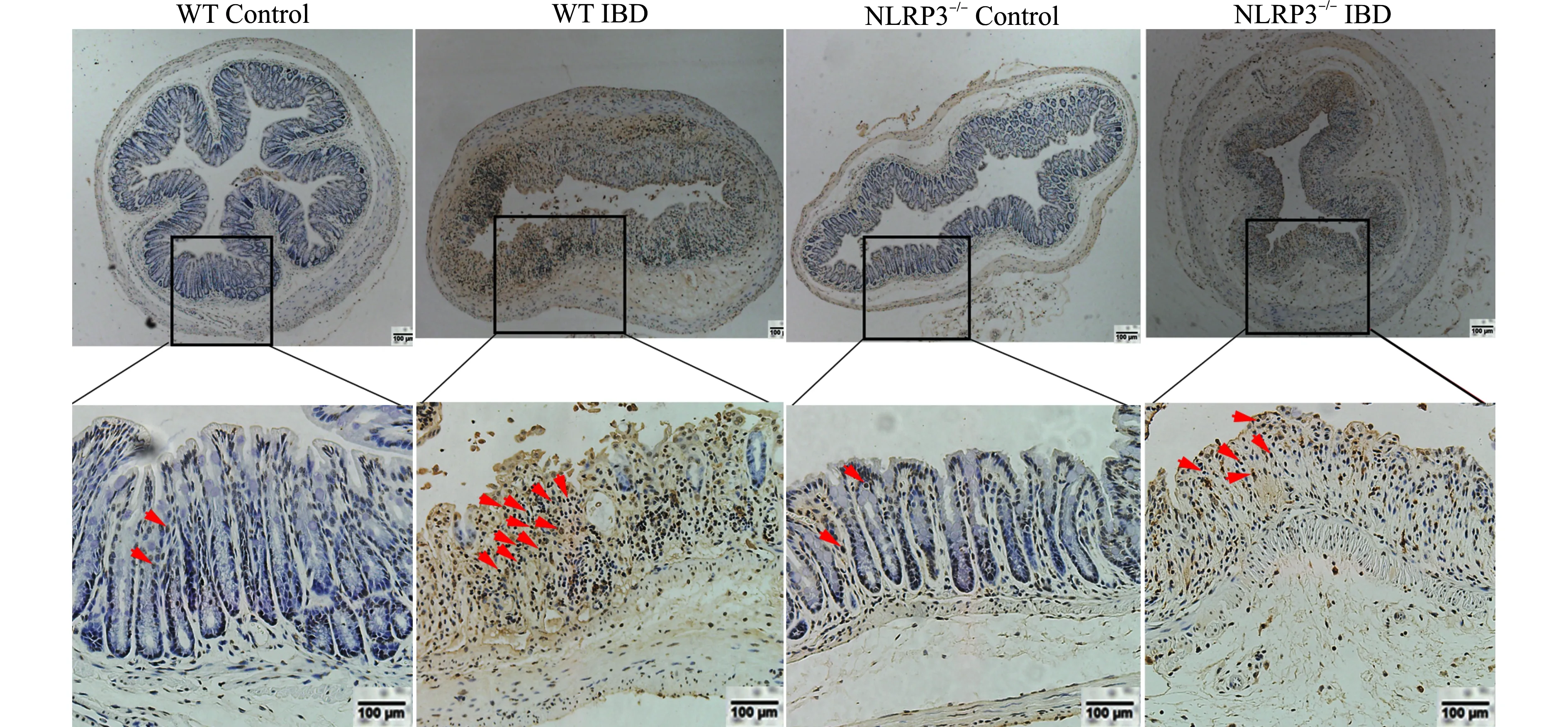
箭头所示为TUNEL染色阳性的凋亡上皮细胞,标尺=100 μm,放大40倍和100倍图2 在DSS诱导的结肠炎中NLRP3-/-小鼠细胞凋亡较少Fig.2 Fewer apoptotic cells in NLRP3-/- mice with DSS-induced colitis
2.2 在DSS诱导的结肠炎中NLRP3的缺失会增加Treg细胞的比例
为了探讨NLRP3在DSS所致结肠炎中的潜在免疫机制,我们采用流式细胞术分析了WT和NLRP3-/-小鼠的肠系膜淋巴结(mesenteric lymph node,mLN)、派伊尔结(Peyer’s patches,PPs)以及脾脏中B淋巴细胞和T淋巴细胞的比例。结果显示,mLN、PPs以及脾脏中的B细胞和T细胞比例在WT和NLRP3-/-小鼠中差异均无统计学意义,说明NLRP3在T细胞和B细胞的发育和分布中并不起关键作用。然而,经DSS饲喂后,NLRP3-/-IBD组小鼠PPs中B细胞的比例从(82.07±4.82)%降低到(68.9±4.05)%(图3A)。WT IBD组和NLRP3-/-IBD组小鼠mLN中T细胞也发生了类似的变化,经DSS处理后,WT IBD组和NLRP3-/-IBD组小鼠mLN中T细胞减少(图3B)。与B细胞相比,经DSS处理后NLRP3-/-IBD组小鼠PPs中T细胞比例略有增加,而NLRP3-/-IBD组小鼠mLN和WT IBD组小鼠脾脏的CD4+T细胞百分比显著升高(图3C)。

1:WT Control;2:WT IBD;3:NLRP3-/-Control;4:NLRP3-/-IBD;A:mLN、PPs和脾脏中CD19+ B细胞的百分比;B:mLN、PPs和脾脏中CD3+ T细胞的百分比;C:mLN、PPs和脾脏T细胞中CD4+ T淋巴细胞的百分比;n=6,*P< 0.05,**P< 0.01图3 WT对照组、WT IBD、NLRP3-/-对照组和NLRP3-/- IBD小鼠中mLN、PPs及脾脏T细胞和B细胞亚群比例Fig.3 The proportion of T- and B-cell subsets from mLN,PPs and spleen among WT control,WT IBD,NLRP3-/- control and NLRP3-/- IBD mice
既往报道提示CD4+T辅助细胞参与了DSS诱导IBD的发生。为比较WT小鼠和NLRP3-/-小鼠结肠炎中CD4+T细胞的状态,我们分别检测小鼠CD4+T细胞各亚群比例,结果发现mLN、PPs和脾脏中DSS处理与否,不影响WT和NLRP3-/-小鼠产生的CD4+T细胞比例。但NLRP3-/-IBD组小鼠mLN中Th2细胞的比例(0.89±0.23)%高于NLRP3-/-对照组小鼠(0.36±0.11%)%。mLN、PPs和脾脏中IL-17+CD4+T细胞比例在WT IBD小鼠和NLRP3-/-IBD小鼠中无显著差异;然而,WT对照组小鼠PPs和脾脏中IL-17+CD4+T细胞比例显著高于NLRP3-/-对照组小鼠(图4A~4C)。流式细胞术分析显示,NLRP3-/-IBD组小鼠PPs和脾脏中Foxp3+Treg细胞的比例较WT IBD组显著增加,而DSS处理前后,WT小鼠和NLRP3-/-小鼠的Foxp3+Treg细胞比例没有明显变化(图4D~4F)。这些结果表明,NLRP3-/-小鼠的炎症水平降低,可能与Treg细胞的增加有关。
2.3 NLRP3缺失会增加IL-10和Foxp3的表达
以往的研究表明细胞因子网络在炎症性肠病病理生理学中的重要作用,这些细胞因子包括IL-1β、IL-6、IL-10、IL-17等[12]。因此,本研究评估了4组小鼠血清中IFN-γ、IL-10、IL-17A、IL-1β、IL-6的含量。如图5所示,4组小鼠的IFN-γ水平无显著差异。DSS处理后,WT IBD组小鼠血清中IL-1β、IL-6和IL-10水平显著升高,NLRP3-/-IBD组小鼠血清中IL-6水平显著升高。尽管WT对照组小鼠和NLRP3-/-IBD组小鼠IL-17A没有显著差异,但NLRP3-/-IBD组小鼠的IL-17A表达明显低于WT IBD组小鼠。而IL-1β仅在WT IBD组小鼠中增加,其浓度远高于WT对照组小鼠和NLRP3-/-IBD组小鼠。WT IBD组小鼠和NLRP3-/-IBD组小鼠血清中IL-6水平显著升高,且WT IBD组小鼠中IL-6浓度几乎是NLRP3-/-IBD组小鼠的4倍(图5)。
综上所述,DSS能促进2种基因型小鼠中促炎细胞因子的分泌,而NLRP3缺失减少了大多数促炎细胞因子的分泌水平。这些结果与前面的流式细胞术检测结果一致。
为了进一步验证NLRP3分子对局部组织细胞因子和Foxp3蛋白表达的影响,我们采用Western blot方法检测结肠中IL-6、IL-17A、IL-10和Foxp3的表达。结果与血清数据一致,在WT IBD小鼠和NLRP3-/-IBD小鼠中,促炎细胞因子IL-17A和IL-6较对照组显著增加,且水平接近(图6A和6B),提示NLRP3在这些细胞因子的局部分泌中不占主导地位。NLRP3-/-IBD组小鼠结肠局部IL-10和Foxp3表达明显高于WT IBD组小鼠,而DSS处理后WT IBD组小鼠局部IL-10和Foxp3表达增加不明显(图6C、6D)。这些观察结果进一步说明了在结肠炎情况下NLRP3在调节IL-10和Foxp3中的关键作用。

1:WT Control;2:WT IBD;3:NLRP3-/-Control;4:NLRP3-/-IBD;A;mLN中Th17细胞的百分比;B:PPs中Th17细胞的百分比;C:脾脏中Th17细胞百分比;D:mLN中Treg细胞百分比;E:PPs中Treg细胞百分比;F:脾脏中Treg细胞的百分比;n=6,*P< 0.05图4 NLRP3-/- IBD小鼠PPs和脾脏中Treg细胞的比例增加Fig.4 An increasing proportion of Treg in PPs and spleen in the NLRP3-/- IBD mice

1:WT Control;2:WT IBD;3:NLRP3-/-Control;4:NLRP3-/-IBD;A:血清中IFN-γ水平;B:血清中IL-1β水平;C:血清中IL-6水平;D:血清中IL-10水平;E:血清中IL-17A水平;n=6,*P< 0.05,**P< 0.01图5 WT对照组、WT IBD组、NLRP3-/-对照组和NLRP3-/- IBD组小鼠血清中细胞因子水平Fig.5 Cytokines levels in serum of WT control,WT IBD,NLRP3-/- control and NLRP3-/- IBD mice
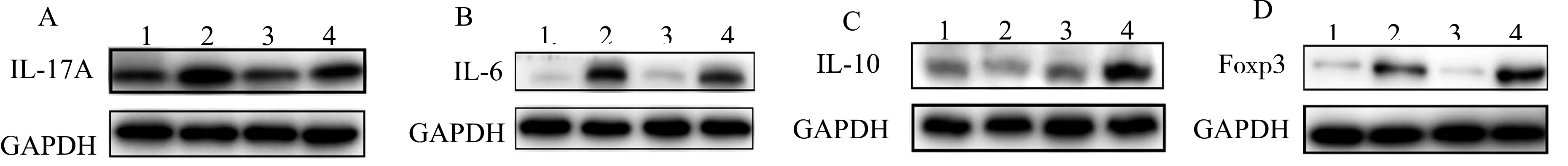
1:WT Control;2:WT IBD;3:NLRP3-/-Control;4:NLRP3-/-IBD图6 NLRP3-/-IBD组小鼠结肠中IL-10和Foxp3表达增加Fig.6 The increased IL-10 and Foxp3 expression in the colon of the colitic NLRP3-/- mice
2.4 NLRP3的缺失在体外调节Treg细胞的分化
为了证明NLRP3分子对Foxp3+Treg细胞分化的直接作用,我们进行了体外分化实验。从WT和NLRP3-/-小鼠脾脏中纯化小鼠初始CD4+T细胞,在IL-2、TGF-β存在的情况下,被已包被的抗CD3抗体和抗CD28抗体激活。第3天,WT小鼠的Foxp3+CD25+Treg细胞百分比(42.13±3.35)%明显低于NLRP3缺陷小鼠(61.7±3.12)%,第5天与第3天情况相似,见图7。这一结果与我们上面结果一致,表明NLRP3分子抑制了Foxp3+CD25+Treg细胞的发育。

分别从WT和NLRP3-/-小鼠中分离出初始CD4+ T细胞,在重组IL-2(20 ng/mL)和TGF-β(5 ng/mL)的作用下,通过抗CD3抗体联合抗CD28抗体激活细胞,流式细胞术检测Foxp3+CD25+ Treg细胞百分率;**P<0.01图7 NLRP3的缺失促进体外Treg的分化Fig.7 Deletion of NLRP3 induced Treg differentiation in vitro
3 讨论
本研究利用DSS诱导小鼠IBD模型,探讨NLRP3炎症小体在肠道炎症中的作用。我们的结果显示,NLRP3缺失通过促进Foxp3+Treg细胞的扩增减轻了DSS诱导的结肠炎。
NLRP3炎症小体是肠道内稳态的重要调节因子,但其在IBD中的作用仍存在争议。早期研究报道,NLRP3缺陷小鼠的病理情况明显比野生型小鼠轻,这与IL-1β和IL-18的低表达水平相关[5,13-14]。然而,最近有报道称NLRP3分子具有维持结肠稳态和抑制肠道炎症的功能[15-17]。以往NLRP3的研究主要集中在骨髓细胞,如巨噬细胞、树突状细胞。最近,Bruchard团队[11]提出NLRP3在小鼠Th2细胞中不仅是一个关键的炎性小体成分,还是一个转录因子,NLRP3的缺失不利于Th2细胞的分化。这项工作鼓励我们进一步探索NLRP3在T细胞中的作用。
在DSS诱导IBD小鼠模型中,NLRP3-/-小鼠症状较轻伴随着PPs和脾脏中Treg细胞比例增加。此外,NLRP3缺失的初始CD4+T细胞在体外更易分化为Treg细胞。Treg细胞是一种抑制性CD4+T细胞,其特征是表达转录因子Foxp3,它们在维持结肠稳态和预防自身免疫性疾病中发挥重要作用[18-20]。以往的研究表明,与非活跃期的IBD患者和对照组相比,活跃期IBD患者外周血中的Treg细胞比例降低[21-22],Foxp3+Treg可能在抑制炎症性肠病免疫相关的黏膜损伤中发挥重要作用[23]。我们的结果显示,NLRP3的激活参与促进肠道炎症的进程,初始CD4+T细胞NLRP3的缺失促进Treg细胞的分化,参与了缓解结肠炎的过程。
肠道通过组织特异性的细胞网络实现多种生理功能,细胞因子是这些细胞相互作用的关键介质[22],在生理和病理生理学中均有体现。IL-10是一种重要的免疫调节细胞因子,在维持肠道内稳态中发挥重要作用。IL-10、IL-10RA和IL-10RB基因突变导致MD-IBD,表现为严重的肠道炎症,发病早[24]。IL-10和IL-10R缺陷小鼠都会出现自发性结肠炎[25-26]。我们的研究发现在DSS诱导的结肠炎中,与WT小鼠相比,NLRP3-/-小鼠血清和肠道中表达更多的IL-10,且NLRP3缺陷小鼠的炎症进展要比WT小鼠慢。因此,我们的研究提示,通过NLRP3炎症小体途径促进Treg细胞分化,从而减缓结肠炎可能是炎症性肠病新的治疗靶点。

