右美托咪定通过Trx1/AMPK通路减轻心肌缺血再灌注损伤中的氧化应激*
吴志林, 朱 轶
华中科技大学同济医学院附属协和医院麻醉科,武汉 430022
右美托咪定是一种高选择性肾上腺素能α2受体激动剂,能够减少交感张力,减慢心率,降低心肌氧耗,产生心肌保护作用,同时还可以减少中枢神经系统炎症反应,减少术后谵妄的发生。在临床上该药物广泛用于ICU患者的镇静以及手术患者的辅助麻醉[1]。研究发现右美托咪定对缺血再灌注损伤具有较强的保护作用。行经皮冠状动脉介入(PCI)手术或者冠脉搭桥术的冠心病患者使用右美托咪定能够减轻炎症反应,促进心脏功能的恢复,从而改善患者预后[2]。我们前期研究也发现,在大鼠心肌缺血再灌注模型中使用右美托咪定预处理能够减轻氧化应激反应,降低炎症因子的表达[3],提示右美托咪定可能通过调节机体氧化应激反应而产生保护作用。然而,右美托咪定如何参与氧化应激的分子机制仍然不清楚。硫氧还蛋白-1(Thioredoxin-1,Trx1)是心肌内重要的抗氧化应激分子,并且与AMP激活的蛋白激酶(AMPK)通路关系密切,本研究拟对右美托咪定在心肌缺血再灌注Trx1/AMPK通路中的作用进行研究,探索其在减轻心肌缺血再灌注损伤中氧化应激的分子机制。
1 材料与方法
1.1 实验动物与试剂
雄性SD大鼠30只,体重250~300 g,由华中科技大学同济医学院实验动物学部提供。兔抗AMPK一抗,兔抗p-AMPK一抗,购自美国CST公司;兔抗Trx1一抗,购自美国Abclonal公司;TUNEL试剂盒购自瑞士Roche公司;ROS试剂盒购自江苏碧云天公司。
1.2 动物模型制备及各组实验方法
实验大鼠按照随机数字表法分为假手术组(Sham组),心肌缺血再灌注组(Ischemia/Reperfusion,I/R组),右美托咪定预处理+心肌缺血再灌注组(Dex组)。每组10只。经腹腔注射50 mg/kg戊巴比妥钠麻醉,将大鼠固定于操作台,连接心电图并监测。手术部位消毒后分离右侧股动静脉并分别置管。右美托咪定组给予右美托咪定5 μg/kg负荷剂量后,以5 μg/(kg·h)持续输注1 h,其他组给予等量生理盐水输注,同时股动脉置管连接powerlab采集系统记录血压。输注结束后分离气管,插入气管导管,连接小动物呼吸机,潮气量10 mL/kg,呼吸频率80~100次/min,剪开左侧胸壁,暴露胸腔,剪开心脏包膜,显露心脏,左心耳下缘结扎冠脉左前降支30 min,以心电图出现ST段抬高或者与高耸T波融合为结扎成功的标志,然后再灌注120 min。假手术组按照相同的方法进行麻醉、开胸及左心耳下缘穿线操作,但不进行结扎。
1.3 标本采集和测定
各组在行缺血再灌注结束后麻醉状态下迅速放血处死大鼠取出心脏,摘除结扎线以下的左心室心肌组织,取出后用生理盐水反复冲洗。取适量心肌组织制成10%匀浆,1000×g,4℃离心10 min,弃沉淀,取上清,依据说明书测定心肌组织活性氧(ROS)含量,另取适量组织裂解后Western blot检测Trx1和AMPK、p-AMPK蛋白表达。其余组织石蜡包埋,按照TUNEL试剂盒说明书进行染色,4′,6-二脒基-2-苯基吲哚(DAPI)对心肌细胞进行染色,细胞核染成蓝色;TUNEL染色,凋亡细胞细胞核染成棕色。细胞凋亡率(%)=凋亡细胞数/心肌细胞总数×100%。
1.4 统计学方法

2 结果
2.1 血流动力学比较
采用股动脉置管方法动态监测血压,利用Powerlab软件计算平均动脉压(MAP)。结果显示3组在持续输液期间血流动力学指标并无显著差异,持续输注右美托咪定并未引起显著的血流动力学改变。缺血再灌注期间,Dex组的心率(HR)和血压较I/R组得到明显改善(均P<0.05)。见图1。
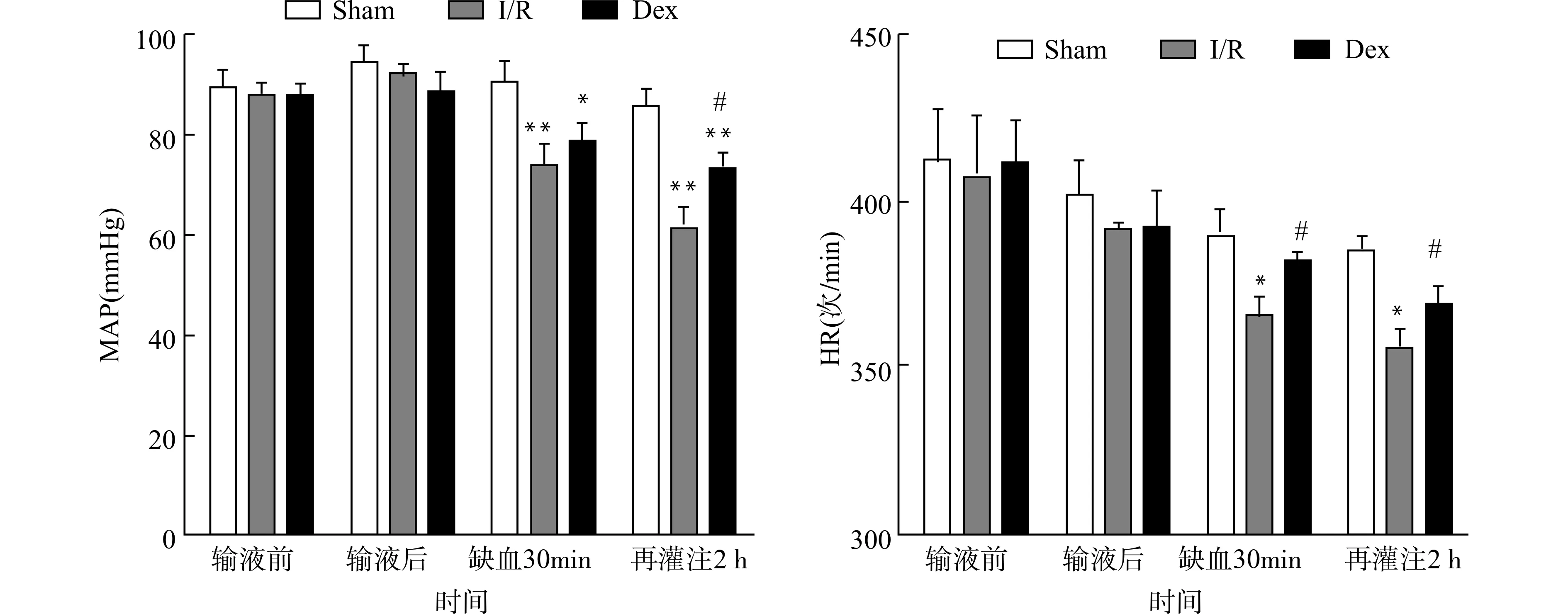
与Sham组比较,*P<0.05 **P<0.01;与I/R组比较,#P<0.05;n=10图1 心肌缺血再灌注各组血流动力学比较Fig.1 Comparison of hemodynamics in ischemia/reperfused hearts
2.2 心肌细胞凋亡率的比较
采用TUNEL染色后,I/R组心肌细胞凋亡率为(27.93±2.41)%,较Sham组(3.33±0.83)%显著增加(P<0.01),Dex组为(18.54±1.94)%,与I/R组相比显著降低,差异具有统计学意义(P<0.05),见图2。
2.3 心肌组织ROS的变化
与Sham组比较,I/R组和Dex组心肌组织ROS水平显著升高(分别P<0.01,P<0.05),而Dex组与I/R组相比,ROS水平显著降低,差异具有统计学意义(P<0.05),见图3。

与Sham组比较,**P<0.01;与I/R组比较,#P<0.05;n=10图2 缺血再灌注心肌细胞凋亡率的比较Fig.2 Comparison of myocardial cell apoptosis rates in ischemia/reperfused myocardial tissue

与Sham组比较,*P<0.05,**P<0.01;与I/R组比较,#P<0.05;n=10图3 缺血再灌注心肌组织ROS水平的比较Fig.3 Comparison of ROS levels in ischemia/reperfused myocardial tissues
2.4 心肌组织Trx1和AMPK磷酸化水平表达变化
Western blot检测提示,I/R组和Dex组与假手术组相比磷酸化AMPK水平显著增高,Trx1蛋白含量显著降低,而Dex组Trx1表达较I/R组显著升高,同时AMPK磷酸化水平进一步升高,差异具有统计学意义(均P<0.05),见图4。
3 讨论
心肌缺血再灌注损伤是发生于缺血性心脏病血管再通手术后一种常见的病理生理现象,表现为缺血心肌恢复了血供,但是梗塞的面积不见缩小,反而进一步扩大,导致患者的死亡率增加。近年来,缺血再灌注对心肌所带来的危害受到越来越多的关注,对心肌缺血再灌注损伤的研究在国内外已经成为热点,怎样能够降低心肌缺血再灌注损伤,如何增加临床治疗的安全性,从而提高患者的满意度,成为麻醉医师需要关注的一个问题。

与Sham组比较,*P<0.05,**P<0.01;与I/R组比较,#P<0.05;n=10图4 缺血再灌注心肌组织中Trx1、AMPK磷酸化水平的比较Fig.4 Comparison of Trx1,AMPK phosphorylation levels in ischemia/reperfused myocardial tissues
研究表明缺血再灌注后由线粒体产生的大量ROS导致的氧化应激是心肌缺血再灌注损伤的主要机制之一。ROS通过细胞膜和细胞器脂质过氧化、氧化DNA、激活基质金属蛋白酶和钙蛋白酶等多种途径直接损伤细胞[4]。另外,细胞内氧化还原应激促进蛋白质翻译后的氧化修饰,导致蛋白质结构和功能的改变,心肌细胞出现大量凋亡,心功能严重受损,甚至导致严重的不可逆的心脏器质性损伤。
正常生理情况下,ROS造成的氧化应激通常被硫氧还蛋白(Trx)和谷胱甘肽等所清除[5]。Trx1是Trx家族调节心脏氧化应激水平的主要亚型,在心脏中大量表达。Trx1通过硫醇-二硫键交换反应还原被ROS氧化的蛋白,从而还原被氧化的关键蛋白分子,维持细胞氧化还原水平的稳态[6]。另外,Trx1是激活AMPK活化过程中必不可少的关键因子。在心肌缺血再灌注过程中,AMPK活化(磷酸化)可以调节葡萄糖和脂肪酸代谢、线粒体功能、内质网应激、自噬和凋亡等等,在心肌缺血等应激条件下发挥着保护作用[7]。Trx1通过与AMPK之间的氧化还原反应,维持AMPK的活性,同时AMPK活性的增强也可以促进Trx1的活性,增强其调节氧化还原的能力[8]。然而,过量的ROS会引发Trx1的降解,造成细胞清除ROS能力下降,导致细胞内氧化应激水平的增加,从而加重细胞损伤[9]。我们的研究也证实了心肌缺血再灌注后细胞氧化应激增加,同时Trx1蛋白水平显著降低,提示心肌缺血再灌注过程产生的氧化应激导致Trx1水平下降。因此,提高缺血心肌中的Trx1水平对减轻心肌缺血再灌注产生的氧化应激尤为重要。
近年来,一系列研究证实右美托咪定在多个动物模型,包括急性肾损伤、脑缺血损伤及肝缺血损伤模型中显著减轻了氧化应激水平[10-12]。我们前期研究也同样显示,右美托咪定可以减轻大鼠心肌缺血再灌注中的氧化应激和炎症反应,然而右美托咪定减轻氧化应激的机制尚不明确。在本研究中,我们采用右美托咪定预处理后,缺血再灌注损伤导致的血流动力学紊乱能够显著改善。为探索其可能的分子机制,我们对氧化应激和Trx1信号通路进行了测定,发现缺血心肌中Trx1水平得到显著恢复,从而有效降低了缺血再灌注心肌组织的ROS水平,减轻了心肌缺血再灌注损伤中产生的氧化应激,同时右美托咪定增加的Trx1进一步提高了缺血心肌中AMPK磷酸化水平,增强了AMPK通路对缺血心肌的保护作用。通过上述机制,右美托咪定减少了缺血再灌注后心肌细胞的凋亡,达到了显著的心肌保护作用。
综上所述,我们认为右美托咪定降低了心肌缺血再灌注过程中的氧化应激,减少了细胞凋亡,对缺血再灌注心肌有着显著的保护作用。该保护作用可能是通过Trx1/AMPK通路实现。然而心肌缺血再灌注损伤的作用机制复杂,涉及多个信号通路,本研究只对Trx1/AMPK通路进行了初步探讨,深入研究右美托咪定对其他通路蛋白或分子的影响,对明确右美托咪定保护心肌缺血再灌注损伤的作用机制有重要意义。

