急性缺血脑卒中患者血清miR-9的表达及其与炎症的相关性①
张玉敏 韩素桂 刘启为 周 琪 卢军利
(唐山市人民医院临床检验科,唐山 063000)
急性缺血性脑卒中(acute ischemic stroke,AIS)是指由各种原因导致的脑组织血液供应障碍,并由此产生缺血缺氧性坏死,进而引起神经功能障碍的一系列临床综合征,也称为急性脑梗死,是最为常见的卒中类型,约占全部卒中的60%~80%[1]。在全球范围内,脑血管病占据致死疾病第二位,而在中国脑血管疾病致死中居于首位,我国脑卒中年发病率约为120~180/10万人,年死亡率高达60~120/10万人,未死亡的脑卒中患者约75%以上出现不同程度的残疾[2,3]。因此,研究脑卒中的病理过程对脑卒中患者意义重大。
microRNA (miRNA)是一段长度约为20 bp的非编码RNA,通过与下游编码或非编码基因的3′UTR区域结合调控其表达,进而调控相应蛋白表达水平,参与调控细胞的增殖、分化、凋亡及迁移等生物学进程[4,5]。目前研究已经证实,miRNA在人体各个组织器官广泛表达,结构稳定,其不仅是疾病诊断的优质分子标志物,还参与多种疾病的病理过程[4,5]。近年来,随着生物芯片技术不断发展,多种miRNA在脑组织中被发现,并被证实参与多个中枢神经系统疾病进展。Wang等[6]研究发现,miR-223在AIS患者血液和脑脊液中表达升高,并且其表达水平与脑卒中患者脑梗死体积和NIHSS评分有关,提示miR-223与AIS发病相关;Chen等[7]研究发现,中风后小鼠miR-126表达水平与心脏炎症、心肌细胞肥大、心脏功能等有关。
miR-9是一种新发现的miRNA,在老年痴呆患者血液中低表达,并参与调控神经干细胞分化[8,9]。多个研究发现,miR-9参与脑血管疾病发生,Qiu等[10]发现miR-9表达具有脑特异性,且在AIS患者血清外泌体高表达。然而,miR-9在AIS患者血清中的表达目前未见报道。研究miR-9在AIS患者血清中表达水平及其临床意义对提高AIS患者确诊率、明确疾病进展阶段及揭示AIS发病机制具有重要意义。因此,本文收集51例AIS患者血清和23例健康志愿者血清研究miR-9在AIS患者血清表达水平,探讨miR-9表达与AIS患者血清炎症的关系。
1 材料与方法
1.1材料
1.1.1一般资料 随机选取2017年6月~2019年6月在唐山市人民医院接受治疗的AIS患者51例(AIS组)和同期于我院体检的健康志愿者23例(HC组)为研究对象。51例AIS患者经核磁共振或者计算机断层扫描确诊,并在脑缺血24 h内经两位副主任以上医师对其进行NIHSS评分。两组患者年龄、性别、合并症及体质指数等临床资料比较差异不显著。纳入标准:①年龄18~65周岁;②AIS患者根据《中国急性缺血性脑卒中诊治指南2018》[1]确诊;③AIS患者在出现缺血症状12 h内且未治疗前取血;④健康志愿者经体检确认身体健康。排除标准:①AIS患者发病时间不详,或者未能在脑缺血24 h内进行NIHSS评分;②AIS患者经治疗后死亡;③合并恶性肿瘤、脑血管疾病、肝肾功能障碍或凝血功能障碍的患者;④有HIV、HBV、HCV及结核等病毒或真菌感染史的患者。本次研究经我院伦理委员会批准,所有参与患者或其家属知情同意。
1.1.2试剂 miRNeasy RNA isolation试剂盒(Qiagen,美国);RNAiso Plus、PrimeScri RT reagent kit with gDNA Eraser (TAKARA,宝日医生物技术有限公司);GoTaq Green Master Mix(Promega,美国);IL-6 、IL-8 (H-EL-IL-8,ZYscience,美国);TNF-α (50R-E.1693H,BIOVALUE,美国);IL-1β (50R-E.1095H,BIOVALUE,美国) ;THP-1 (美国模式培养物集存库,美国);胎牛血清、1640培养基(Hyclone,美国);miR-9-NC(5′-UCTTTTCAAGCGTTCAGTCCC-3′),miR-9-mimic(5′-UCUUUGGUUAUCUAGCUG-UAUGA-3′)和miR-9-inhibitor(5′-AGAAACCAAUG-CGACAUACU-3′)由生工生物工程技术服务有限公司合成,并直接转染;LipofectamineTM2000转染试剂(Thermo Fisher Scientific,美国);TransDetect双荧光素酶报告分析试剂盒(全式金,中国)。S1000 PCR仪 (伯乐,中国);ABI7500荧光定量PCR仪(ABI,美国);5810R离心机(eppendof,美国);DNM-9602酶标仪(北京普朗新技术有限公司,中国)。
1.2方法
1.2.1实时荧光定量PCR RNA试剂盒提取血清和细胞中总RNA。反转录反转录cDNA,反转录温度设定:37℃ 1 min,85℃ 5 s,4℃保存备用。将获得的cDNA稀释50倍,根据GoTaq Green Master Mix说明书配制20 μl荧光定量PCR反应体系:95℃ 2 min;95℃ 5 s,60℃ 30 s,循环40次。2-ΔΔCt法计算miR-9的相对表达水平。miR-9-F:5′-ACACTCCAGCTGGGTCTTTGGTTATCTAGCT-3′;miR-9-R:5′-TGGTGTCGTGGAGTCG-3′;U6-F:5′-CTCGCTTCGGCAG-CACA-3′;U6-R:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.2ELISA法检测血清炎症因子 分别用试剂盒检测血清IL-8、TNF-α、IL-6和IL-1β含量,具体步骤参照说明书。
1.2.3外周血单个核细胞分离 离心弃外周血血清,按血液:培养基体积=1∶2向血细胞中加入1640培养基,缓慢加入体积为培养基和血细胞体积一半的人外周血淋巴细胞分离液,室温2 200 r/min离心30 min后,取中间白色悬浮层,加入3倍体积的PBS缓冲液洗涤3遍,离心收集沉淀,即为人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。
1.2.4细胞培养、转染与双荧光素酶检测 THP-1和分离的PBMC均培养于含10%胎牛血清的1640培养基中,培养条件为5%CO2、37℃。10 nmol/L的miR-9-NC、miR-9-mimic和miR-9-inhibitor经LipofectamineTM2000转染试剂转入细胞,并在转染后48 h 开始对SIRT1的野生型(WT)或突变型(MUT)mRNA 3′-UTR进行实验。将基因插入 pisCHECK2载体,经LipofectamineTM2000直接转入细胞。 并使用TransDetect双荧光素酶报告分析试剂盒进行双荧光素酶基因报告实验,具体步骤参照试剂盒说明书。Westren blot检测THP-1和健康志愿者PMBC中SIRT1表达水平。
1.3统计学分析 采用SPSS20.0软件分析本次研究数据。Pearson法分析两组数据间的相关性,两组间数据差异行t检验,单因素方差分析用于比较3组数据间差异(Ducan法事后检验)。P<0.05表示差异有统计学意义。
2 结果
2.1miR-9在AIS患者血清中表达 如图1A所示,miR-9在51例AIS患者血清中表达水平是健康志愿者的(3.25 ± 1.02)倍。且51例AIS患者血清miR-9的相对表达水平与其NIHSS评分及患者脑梗死体积呈正相关(r=0.674,P<0.001)和(r=0.544,P<0.001) (图1B、C)。
2.2miR-9在AIS患者血清中表达与血清炎症因子相关性 51例AIS患者血清miR-9的相对表达水平与血清IL-6 (r=0.558,P<0.001)、IL-8 (r=0.581,P<0.001)、TNF-α (r=0.626,P<0.001) 及IL-1β (r=0.668,P<0.001) 水平均呈正相关(图2)。
2.3miR-9抑制PBMC中SIRT1表达 THP-1细胞是从人外周血分离的单核细胞系,常用于研究外周血炎症与免疫。通过Targetscan(http://www.targetscan.org)等生物信息学网站分析显示, SIRT1与miR-9具有互补序列(图3A)。如图3B所示,转入miR-9-mimic后,THP-1细胞miR-9表达水平显著升高(P<0.001);在转入miR-9-inhibitor后,miR-9表达水平显著降低(P<0.001)。双荧光素酶基因报告系统显示,miR-9-mimic可显著降低野生型SIRT1荧光素酶活性(P<0.001),而不能改变突变型SIRT1荧光素酶活性(图3C)。Western blot结果显示,miR-9-mimic可显著降低THP-1细胞和健康志愿者PBMC中SIRT1蛋白表达水平(P<0.001);miR-9-inhibitor可显著升高THP-1细胞和健康志愿者PBMC中SIRT1蛋白表达水平(P<0.001)。

图1 miR-9在血清中表达及其与AIS患者NIHSS评分、脑梗死体积的关系Fig.1 Expression of miR-9 in serum and its relationship with NIHSS score and cerebral infarction volume in patients with AIS

图2 AIS患者血清miR-9与IL-6、IL-8、TNF-α及IL-1β的相关性Fig.2 Correlation between serum miR-9 with IL-6,IL-8,TNF-α and IL-1β in patients with AIS
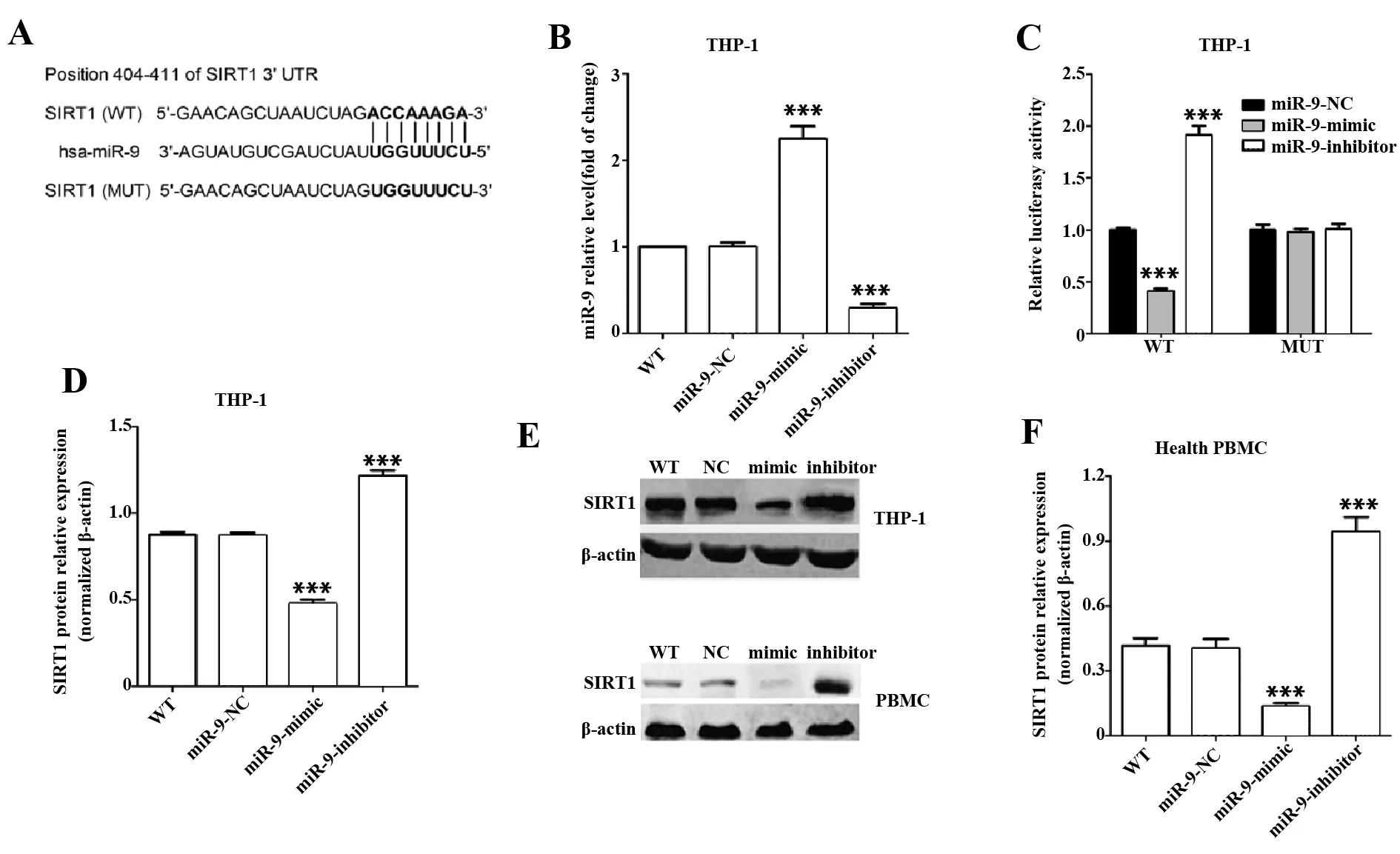
图3 miR-9靶向抑制PBMC中SIRT1的表达Fig.3 miR-9 targeting inhibits expression of SIRT1 in PBMCNote:A.WT SIRT1 and MUT SIRT1 fluorescein gene reporter vector sequences;B.Expression level of miR-9 was detected by RT-qPCR;C.Comparison of luciferase activity after treating THP-1 cells in different ways;D,F.Expression of SIRT1 detected by Western blot.Compared with miR-9-NC group,***.P<0.001.
3 讨论
AIS是由于脑动脉闭塞导致的脑组织梗死,伴随神经元、星形胶质细胞、少突胶质细胞损伤,是致死和致残最重要的中枢神经系统血管事件。本研究发现,miR-9在AIS患者血清中表达水平显著高于健康志愿者,且miR-9在血清中表达水平与AIS患者NIHSS评分和脑梗死体积有关。既往研究指出,miR-9在中枢神经系统疾病中发挥重要作用。Delavar等[11]在MTPP诱导的PC12细胞的帕金森细胞模型中发现,miR-9的表达显著改变,且其参与PC12细胞的分化调控;Gu等[12]发现,miR-9通过靶向抑制HDAC5表达而过激活MEF2C-GPM6A途径,促进神经突发育。结合本研究结果,提示miR-9可能参与AIS的发生发展。
大脑虽然只占人体重量的2%,但其耗氧量却占人体全部耗氧量的20%,且大脑存储能量能力极差,造成大脑对缺氧性损伤的耐受差,因缺血而导致氧气供应不足会造成严重的脑组织损伤[13]。中枢神经系统因缺血而失控的炎症反应是引起脑缺血继发性损伤的主要原因之一。脑缺血会导致各种炎症细胞因子表达升高从而导致神经元损伤或者凋亡,破坏血脑屏障,血脑屏障的破坏会进一步加重炎症,导致更多的神经元和脑细胞损伤或死亡,形成恶性循环[14]。炎症介质可刺激细胞黏附因子升高,造成中性粒细胞和单核细胞渗出,引发缺血性组织炎症[14]。总之,炎症在AIS脑组织损伤中发挥重要作用,抑制炎症是治疗AIS患者的重要方案之一[15-17]。本研究发现,miR-9在51例AIS患者血清表达水平及血清IL-8、TNF-α、IL-6和IL-1β含量呈正相关。既往研究证实,细胞因子是介导脑缺血后神经毒性的主要参与者,主要的神经毒性作用包括IL-1β,TNF-α介导的神经水肿,促进神经胶质增生,神经元中Ca2+增加,释放白细胞[18]。总而言之,脑缺血后异常增加的炎症是神经元损伤的主要原因之一。本研究提示,miR-9可能通过介导炎症反应参与AIS疾病发展。
miR-9作为一种miRNA并不编码蛋白质,只能通过调控其靶基因间接参与细胞调控。为进一步研究miR-9对AIS患者炎症的调控作用,本研究通过生物学信息手段查询到SIRT1是miR-9的靶基因,并通过双荧光素酶报告基因系统验证miR-9靶向抑制THP-1细胞的SIRT1表达;同时miR-9-mimic可显著抑制健康志愿者PBMC中SIRT1蛋白表达,而miR-9-inhibitor可增加健康志愿者PBMC中SIRT1蛋白表达。提示在AIS患者血清中高表达的miR-9可能靶向抑制PBMC中SIRT1蛋白表达。
SIRT1是sirtuin蛋白家族成员,是一种烟酰胺腺嘌呤二核苷酸依赖性组蛋白去乙酰化酶,其不仅可以通过去乙酰化组蛋白维持染色质和基因组稳定,还可通过其去乙酰化非组蛋白功能参与细胞生物学功能调控[19]。既往研究指出,上调SIRT1不仅可以降低脓毒血症小鼠体内炎症性损伤,还可通过其去乙酰化功能而抑制p65蛋白进入细胞核而抑制NF-κB信号通路激活进而减轻炎症,表明SIRT1在细胞中发挥炎症抑制基因的功能,而miR-9可能通过抑制SIRT1表达而上调炎症[20-22]。
综上所述,miR-9在AIS患者血清高表达,且高表达的miR-9与AIS患者病情及血清炎症呈正相关,这可能与miR-9抑制PBMC中SIRT1表达有关。

