TGF-β1和BMP2在骨关节炎患者的关节软骨细胞中诱导的代谢特征
罗安玉 刘瀚霖 谢小飞 黄 琛
(武汉科技大学附属汉阳医院骨二科,武汉 430050)
骨关节炎(osteoarthritis,OA)是临床常见的关节软骨退行性疾病,表现为软骨下骨硬化,滑膜炎,骨赘形成和疼痛[1]。在中国OA的患病率高达18%,且女性患者患病率高于男性,同时骨关节炎已经成为世界范围内的第四大致残性疾病[2]。OA的发病机制尚不清楚,目前的研究普遍认为年龄、性别、肥胖、关节生物力学改变以及个体的遗传特点是OA发病的潜在危险因素[2]。在OA的发病过程中,关节软骨退行性变是其主要表现和关键环节[3]。越来越多的研究证据表明:OA是一种代谢紊乱性疾病,关节软骨细胞的代谢差异可以在一定程度上反映软骨细胞的健康或疾病状态,在健康的关节软骨中,细胞外基质的代谢率相对较低,关节软骨细胞能够维持自身稳态[4]。在OA的病情进展过程中,肥大增生的相关基因表达上调,伴随着分解代谢的增强和细胞外基质的降解,关节软骨细胞呈现肥大样表型[5]。既往研究认为TGF-β信号是维持关节软骨细胞稳态的关键因子,抑制TGF-β及相关分子会导致软骨细胞肥大引起小鼠自发性OA[6]。而BMP信号通路的激活可以诱导关节软骨细胞发生肥大增生,形成骨赘,并出现骨关节炎性病变[7]。目前已有大量研究表明TGF-β和BMP信号通路对关节软骨细胞分化具有重要调控作用,然而TGF-β和BMP在关节炎背景下的异常表达对细胞代谢发挥差异性调节机制并不清楚。因此本项研究从OA患者的软骨组织中分离出人源性原代关节软骨细胞,分别在体外给予TGF-β1和BMP2处理后观察细胞代谢状态的差异,深入分析TGF-β1和BMP2信号通路对关节软骨细胞代谢的调控作用和骨关节炎的致病分子机制,现将研究结果报道如下。
1 材料与方法
1.1材料
1.1.1材料及试剂 DMEM培养基 (美国Thermo公司,货号31053028);Ⅱ型胶原酶 (美国Roche公司,货号11213865001);胎牛血清(美国Gibco公司,货号10082147);二甲基亚砜(美国Sigma公司,货号D2650);BCA蛋白定量试剂盒(中国联科生物公司,货号A81911125);PVDF膜(美国Millipore公司,0.45 μm,货号R8HA7852);Glut1单克隆抗体(美国CST公司,货号1239S),己糖激酶Ⅰ(HKⅠ)单克隆抗体(美国CST公司,货号2024T),己糖激酶Ⅱ(HKⅡ)(美国CST公司,货号2867T),LDHA(美国CST公司,货号2012),β-actin单克隆抗体(美国Abcam公司,货号ab8245);BMP2 (美国R&D 公司,货号355-BM-010);TGF-β1(美国R&D 公司,货号240-B-002/CF);葡萄糖检测试剂盒(美国Sigma-Aldrich公司,货号Gahk-20);L-乳酸检测试剂盒(美国Biosciences公司,货号120001100A);CellTiter-Glo 2.0试剂盒(美国Promega公司,货号G9242)。
1.1.2实验仪器 倒置相差显微镜(日本Olympus公司);5%CO2孵育箱(美国Thermo Fisher公司);微量孔板分光光度计(美国BioTek公司);低温离心机(德国R&D公司)。
1.2方法
1.2.1人体软骨组织的获取 收集2017年1月至2019年1月在我院骨科进行全膝关节置换的40例OA患者的废弃关节软骨组织标本,取材位置为股骨髁内侧关节软骨。原发性骨关节炎的诊断标准参照美国风湿病学会膝骨关节炎诊断标准[8,9]。本研究获得我院医学伦理委员会批准(批准号:S2017-21-1),操作前征得所有患者知情同意,并签署知情同意书。
1.2.2人关节软骨细胞的分离培养 获取OA患者股骨髁内侧的关节软骨用于软骨细胞的分离培养。使用一次性手术刀将关节软骨附近的残留结缔组织以及骨组织从底层软骨刮除,并放置在1×PBS中反复冲洗。无菌眼科剪将软骨组织剪碎成2 mm碎片,1×PBS洗涤3遍,随后放置在无菌培养瓶中,加入10倍体积含0.2%Ⅱ型胶原酶的DMEM培养基与2倍体积的HBSS缓冲液,37℃下振荡消化16 h。充分消化后,以70 mm滤器过滤软骨细胞,1 200 r/min 离心5 min弃上清,并用1×PBS洗涤2次。加入含有15%胎牛血清的DMEM培养液终止消化,最后以培养基吹打混匀细胞沉淀后接种入培养瓶中,置于37℃恒温、5%CO2、饱和湿度培养箱内培养,每48 h更换培养液1次。实验过程中以1×104个/cm2细胞接种在不同的孔板中,生长24~28 h 后,更换培养基再分别采用BMP2(100 ng/ml)或TGF-β1(5 ng/ml)处理软骨细胞48~72 h进行后续检测。
1.2.3代谢特征的测定和分析 BMP2和TGF-β1处理关节软骨细胞后对细胞培养上清中的葡萄糖摄取量、乳酸和ATP产量进行定量分析。采用葡萄糖检测试剂盒测定细胞外葡萄糖浓度。采用L-乳酸检测试剂盒测定细胞培养上清中的乳酸含量。采用CellTiter-Glo 2.0试剂盒检测细胞内ATP水平。
1.2.4Seahors XF细胞线粒体压力试验评估线粒体耗氧情况 将关节软骨细胞以每孔40 000个细胞的密度接种至Seahors XF96细胞培养板上,给予BMP2和TGF-β1处理后,将细胞培养基更换为添加了5.5 mmol/L葡萄糖和2 mmol/L Glutamax的检测液,并在无CO2的培养箱中孵育1 h。开始运行实验程序,将加过刺激的测试板和装有标准液的校准板放置于仪器托板上,连续测量Seahors XF96细胞培养板中的OCR值,完成测量后在显微镜下观察细胞状态。
1.2.5Western blot检测目的蛋白表达水平 使用添加磷酸酶和蛋白酶抑制剂的RIPA裂解缓冲液提取关节软骨细胞中的总蛋白,Western blot法检测细胞中Glut1、HKⅠ、HKⅡ、LDHA及Actin的蛋白表达量。具体步骤如下:获得细胞蛋白上清后以BCA法测定总蛋白浓度,95℃变性5 min,使用SDS-PAGE凝胶进行电泳分离,每组蛋白上样15 μg/孔,随后将目的蛋白以湿转法转移至PVDF膜上;5%BSA-TBS溶液封闭1 h;5%BSA-TBST稀释一抗,置于4℃水平摇床孵育过夜;次日,使用TBST洗膜3次,每次10 min;5%BSA-TBST稀释二抗,室温孵育40 min;TBST洗膜3次,每次10 min;ECL滴加到膜的蛋白面,反应1~5 min后曝光显影。Image-Pro Plus 6.0软件扫描测定目的条带的灰度值。

2 结果
2.1TGF-β1与BMP2对骨关节炎患者的原代关节软骨细胞糖酵解代谢呈现相反作用效果 相比于对照组,TGF-β1的刺激会显著增加细胞的葡萄糖摄取(葡萄糖摄取量增加48.1%,P<0.001)和乳酸的产生(乳酸产量增加19.3%,P<0.001)。相反,BMP2的刺激会轻度抑制细胞的葡萄糖摄取(细胞葡萄糖摄取减少5.2%,P=0.48)和乳酸的产生(乳酸产量减少2.8%,P=0.34)。此外,在TGF-β1处理后的软骨细胞中可以观察到ATP明显减少(ATP产量减少了12.4%,P<0.001);而BMP2处理后的细胞ATP显著增加(ATP的产量增加了14.0%,P<0.001)。见图1。
2.2TGF-β1诱导骨关节炎患者的关节软骨细胞发生有氧糖酵解代谢 在TGF-β1刺激后,细胞中的Glut1和HKⅡ蛋白表达增加了约1倍。与此同时,另一种己糖激酶亚型HKⅠ在TGF-β1诱导的细胞中的表达量也有所增加。相反,BMP2的刺激对HKⅡ的表达几乎没有影响,但导致Glut1水平上调约20%,并促进HKⅠ的表达上调约50%。TGF-β1和BMP2的刺激均不会对LDHA产生影响,见图2。
2.3BMP2促进骨关节炎患者的关节软骨细胞发生氧化磷酸化代谢 如图3所示,对照组、TGF-β1
和BMP2处理组的平均线粒体基础耗氧量分别为47.3 pmoles/min、53.2 pmoles/min和87.8 pmoles/min,最大耗氧量为73.6 pmoles/min、77.9 pmoles/min和160.2 pmoles/min。与对照组相比,BMP2处理后的线粒体耗氧量明显升高,线粒体的基础耗氧量和最大耗氧量均增加约1倍。相比之下,TGF-β1处理后的细胞基础耗氧率和最大耗氧率与对照组相比差异无统计学意义。
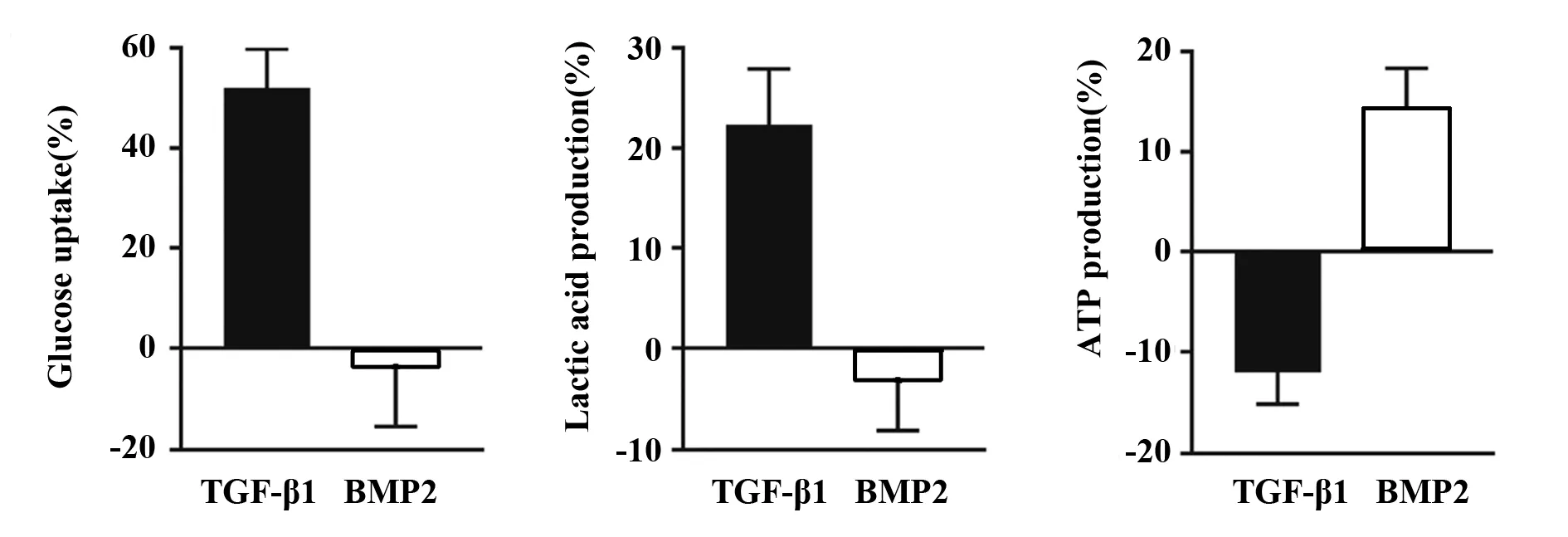
图1 OA患者关节软骨细胞的葡萄糖摄取量、乳酸和ATP产量Fig.1 Glucose uptake, lactic acid and ATP production in articular chondrocytes from OA patients

图3 OA患者来源的关节软骨细胞的线粒体耗氧量分析Fig.3 Mitochondrial oxygen consumption of chondrocytes from OA patientsNote: Compared with control,*.P<0.05.

图2 关节软骨细胞中Glut1,HKⅠ,HKⅡ,LDHA的蛋白表达水平及相对半定量分析Fig.2 Protein expression level and relative semi-quantitative analysis of Glut1,HKⅠ,HKⅡ,LDHA in articular chondrocytesNote: Compared with control,*.P<0.05.
3 讨论
本文通过对OA患者来源的关节软骨细胞进行TGF-β和BMP2的体外刺激实验,深入挖掘了TGF-β和BMP两条信号通路对关节软骨细胞糖代谢过程的调控作用及分子机制,发现TGF-β和BMP2可以诱导OA患者关节软骨细胞进行不同的能量代谢途径。具体而言,TGF-β1通过上调糖酵解的关键蛋白Glut1和HKⅡ,刺激关节软骨细胞进行糖酵解代谢,导致乳酸的分泌和葡萄糖的摄取均增加,同时不会影响细胞的氧化磷酸化过程。而BMP2可以明显促进线粒体氧化磷酸化代谢,对葡萄糖的摄取和糖酵解关键蛋白的表达无明显影响。
TGF-β信号通过抑制软骨细胞的肥大分化维持软骨细胞的稳态和关节软骨的完整性,一旦TGF-β信号通路被抑制,关节软骨就会出现骨关节炎的病理改变[12]。而异常升高的BMP信号也会破坏关节软骨的稳态,促进OA病情进展[13]。在正常状态下TGF-β/BMP信号通路处于动态平衡状态,一旦这种平衡向分解代谢和BMP的方向倾斜,就会导致关节软骨细胞外基质的丢失和骨关节炎的发生,这已经被证实是小鼠和人类OA发生发展的重要原因[14]。然而,TGF-β/BMP信号调节细胞分化和代谢的具体机制仍有待进一步探索。细胞能量代谢对于维持软骨的分化稳态至关重要,并且会在OA的致病过程中发生改变。正常状态下,软骨中含有高浓度乳酸和糖酵解代谢的各种酶,含氧低,软骨细胞倾向于进行糖酵解提供能量保证细胞内外环境的稳定。一旦软骨细胞氧化磷酸化代谢增加就提示分解代谢途径的失衡和骨关节炎的发展[15]。本研究发现:常氧条件下,外源性给予TGF-β1刺激可显著增加关节软骨细胞中的葡萄糖摄取和乳酸产生,这种现象有氧糖酵解或被称为“Warburg效应”[16,17]。这是由于软骨细胞的代谢在低氧条件下以糖酵解为主,但即使在高氧环境中,这种代谢模式仍能维持。由于健康软骨中的细胞几乎不会发生增殖,所以课题组推测增加的葡萄糖摄取和糖酵解代谢可能被用以TGF-β1相关的合成代谢提供能量;另一方面,软骨细胞中氧化磷酸化过程受到限制后可以明显减少活性氧自由基的产生,进而减少氧化应激对组织和细胞的损伤。我们在BMP2刺激后的细胞中观察到氧化磷酸化代谢的明显增强,这与关节软骨发生肥大增生时的细胞代谢特点相似,提示在OA病情发展的过程中可能发生了能量代谢的重编程,软骨细胞向有氧代谢倾斜,代谢模式的改变导致细胞损伤的加重和炎症反应。
有研究发现TGF-β1在正常的年轻小鼠关节软骨细胞中诱导的代谢与老年OA模型小鼠截然不同,这是由于TGF-β蛋白可以激活细胞内的多种不同的级联信号,具体发挥何种生物功能依赖于其所处的细胞环境有关,生理情况下,TGF-β能促进软骨细胞合成细胞外基质,维持软骨细胞的正常表型,使关节软骨具有最大限度地吸收、缓冲应力的生物力学特性;病理状态下,TGF-β对软骨具有破坏作用,关节软骨出现血管化和局灶性钙化的表现,同时促进滑膜细胞增殖、炎症细胞浸润和纤维化引起关节滑膜炎。但是是否可以将TGF-β应用于骨关节炎相关疾病的治疗目前尚有争议。在之后的研究中,课题组将着重阐明TGF-β信号促进糖酵解代谢和维持代谢稳态的内在分子机制,这将为阐释OA的具体发病机制提供重要线索。
总之,本研究成功发现激活TGF-β和BMP信号会在OA患者的关节软骨细胞中启动不同的糖代谢途径,证实代谢途径的重编程可能是调控关节软骨细胞在骨关节炎背景下损伤的重要机制之一。同时,对于关节软骨细胞能量代谢平衡的靶向调控有望成为临床骨关节炎的全新治疗方法。

