LncRNA和RBP在免疫调节中的研究进展①
雷艳婷 李兆瀛 孙 博 汪嘉麒 李呼伦
(哈尔滨医科大学,哈尔滨 150081)
固有免疫系统和适应性免疫系统由多种免疫细胞组成,共同保护宿主免受病原微生物侵害。免疫细胞的激活受基因表达的动态变化影响,基因产物在对抗病原微生物、修复启动、终止炎症反应等过程中发挥作用。长链非编码RNA(long non-coding RNA,LncRNA)分子与多种免疫细胞的功能相关,大多数LncRNA分子需要与1个或多个RNA结合蛋白(RNA-binding protein,RBP)形成复合物发挥调节作用。本文对LncRNA分子和RBP在免疫过程中的调节功能进行综述。
1 LncRNA和RBP概述
1.1LncRNA简介 LncRNA是长度大于200个核苷酸、缺少开放阅读框架且无蛋白编码能力的内源性RNA分子。GENCODE数据库(version 29)显示,人类基因组中有蛋白编码基因19 940个,LncRNA基因16 066个,LncRNA转录本29 566个,且LncRNA基因数量仍在增加[1]。
LncRNA分子可在不同的细胞发育过程及多个水平执行调控功能,其失调可引发多种疾病[2]。LncRNA分子定位不同,发挥作用的机制亦不相同,目前仅有小部分LncRNA分子功能被明确阐述。LncRNA不同亚细胞定位具有不同的调控机制,核定位的LncRNA以多种模式调节基因表达,可作为信号分子调节转录因子活性,也可作为诱饵竞争性与转录因子或RBP结合,间接调控目标基因转录,还可作为支架分子,通过分子自身的多个结构域结合不同蛋白分子或作为复合体装配的中心平台,在同一位置同时结合多个效应组件而发挥调节作用。LncRNA也可作为引导分子,将转录因子或RBP引导至特定的靶点以激活或阻遏转录,并诱导染色体弯曲以加强增强子与启动子区域的关联。细胞质中存在的LncRNA分子可发挥稳定核糖核蛋白复合物、调节mRNA稳定性的作用,或作为竞争性内源RNA竞争性结合miRNA,调节翻译过程[3]。
1.2RBP简介 RBP是指直接与RNA结合的蛋白质的总称。直接与RNA结合的区域称为RNA结合区域(RNA-binding domain,RBD),RBP通常包括1个或多个RBD,根据RBD的结构和功能可分为RNA识别基序(RNA recognition motif,RRM)、DEAD 基序(DEAD motif)、K同源结合域(K-homology domain)、Sm结合域、富含精氨酸和甘氨酸的区域(arginine-glycine-rich domain,RGG)、锌指蛋白结合域及双链RNA结合基序(double-stranded RNA-binding motif,DSRM)等[4]。类型丰富的RBD组成了数以千计的RBP,通过与不同类型的转录本结合,丰富细胞内RNA的调节方式。
细胞中的RNA与RBP相互作用形成核糖核蛋白(RNP)复合物,在RNA的合成、转运、稳定性、翻译和细胞定位等方面发挥重要作用[5]。因此研究LncRNA分子和RBP的互相作用机制是揭开其神秘面纱的关键。
2 LncRNA和RBP与免疫调节
免疫系统精密而复杂,多种免疫细胞共同应对病原体感染,促进免疫激活。近10年研究表明LncRNA分子通过与DNA、RNA和蛋白质相互作用参与免疫调节,大部分LncRNA分子通过与RBP结合发挥免疫调节作用。本文从LncRNA分子与RBP的发展趋势、RBP的属性和两者发挥的免疫调节功能3方面梳理LncRNA分子与RBP在免疫调节过程中的研究进展,有助于了解LncRNA分子和RBP在免疫细胞中的研究现状,为探索LncRNA分子的作用机制和生物学功能提供参考。
2.1LncRNA与RBP的发展趋势 LncRNA分子一度被认为是“垃圾RNA”和转录“噪音”,但研究发现LncRNA分子也像蛋白编码基因一样,参与免疫系统多种生物学过程,包括细胞增殖、分化、凋亡、发育和免疫应答[6,7]。
近10年研究已阐明LncRNA分子和RBP参与免疫调节的作用机制。2015年前发现的RBP种类较为单一,对其参与免疫调节功能的认识也较为局限,2016年后被发现的RBP种类逐渐丰富,参与免疫调节的功能更加多样化,同时发现两者参与的信号通路逐渐增多,为阐明LncRNA分子和RBP参与免疫系统的调节机制做出重要贡献(图1)。

图1 免疫系统中不同属性来源的LncRNA结合蛋白数量统计图Fig.1 Statistics of LncRNA binding proteins numbers from different attributes in immune system
2.2RBP的属性分类 多种已知蛋白质分子可与LncRNA结合。根据RBP不同的属性来源,可将其分为转录因子、核不均一核糖核蛋白、组蛋白修饰酶、染色质重塑复合物、受体和其他酶类,RBP属性不同,LncRNA分子结合后发挥的免疫调节作用机制也不同。
转录因子可与LncRNA相结合参与免疫应答,异质核糖核蛋白、组蛋白修饰酶和染色质重塑复合物亦可与LncRNA分子结合参与免疫调节。多种酶和受体也可作为RBP参与免疫调节,与LncRNA协同发挥免疫调节作用(表1)。目前免疫相关的LncRNA分子数量仍在增加,与其结合的RBP属性分类也逐渐细化,因此本文对于RBP属性来源进行梳理和归纳,为未来LncRNA-RBP复合体研究提供方向。
2.3LncRNA和RBP的免疫调节功能 为响应不同的外界刺激(微生物、细胞因子或内源性危险信号等),LncRNA分子与RBP形成调节性复合体,促进或抑制编码基因表达并调节免疫细胞系发育过程,实现对免疫系统的精确调控。本文梳理了近10年免疫系统中LncRNA-RBP复合体的研究成果,发现基因变化的产物参与免疫调节的多个过程,包括免疫细胞增殖、分化、凋亡、发育和免疫应答,证明LncRNA分子和RBP在免疫调节中的重要性(表2)。
2.3.1LncRNA分子和RBP调节免疫细胞分化 LncRNA分子和RBP在免疫细胞分化过程中具有重要作用。CD4+T细胞可分化为效应性T细胞,在适应性免疫应答中起关键作用。NeST是Th1特异性lincRNA,位于IFN-γ编码基因附近,可通过结合组蛋白修饰酶WDR5顺式调节IFN-γ基因表达诱导Th1细胞分化[11]。Ranzani等[17]研究表明Linc-MAF-4可招募组蛋白修饰酶EZH2和LSD1至Th2特异性转录因子MAF的启动子处并抑制其转录,从而影响naive CD4+T细胞极化至Th2细胞的过程。此外,Xia等[26]研究发现lnc-Smad3与组蛋白去乙酰化酶HDAC1结合,抑制Smad3转录并影响Foxp3表达,干扰Treg细胞分化。上述研究表明LncRNA分子可与组蛋白修饰酶来源的RBPs协同调节细胞因子和转录因子的表达影响T细胞分化。LncRNA分子可通过调节免疫耐受影响肿瘤发生发展,lnc-EGFR与EGFR特异性结合阻断EGFR与c-CBL相互作用和EGFR泛素化,促进Treg细胞分化,为肝癌治疗提供潜在靶点[31]。LncRNA和RBP还可作用于DC和单核/巨噬细胞等参与固有免疫应答调节。Wang等[13]发现DC中特异性高表达的lnc-DC可通过结合转录因子STAT3阻止SHP-1对STAT3的去磷酸化,促进STAT3-酪氨酸705磷酸化调节单核细胞向DC分化。LncRNA- NTT在THP-1细胞中受单核细胞的关键转录因子C/EBPβ调控,通过hnRNPU与临近基因PBOV1的启动子结合,影响巨噬细胞分化[33]。
2.3.2LncRNA和RBP调节免疫细胞炎症基因表达 为响应不同的外界刺激,LncRNA与RBP形成调节性复合体影响编码基因表达以实现对免疫系统的精确调控。PACER作为巨噬细胞受LPS刺激后产生的LncRNA,可与NF-κB亚基p50结合,促进PTGS2转录和炎症反应激活[12]。TNF-α和IL-1β刺激可促进LncRNA-Lethe表达,而LncRNA-Lethe结合NF-κB亚基RelA抑制NF-κB DNA结合活性和靶基因活化,从而抑制过度炎症反应[9]。Li等[14]研究发现THRIL与hnRNPL结合形成功能性复合物并通过反式作用结合TNF-α启动子,调节TNF-α表达。NEAT1是调控核小体形成过程中起关键作用的LncRNA分子,可诱导剪切因子SFPQ核转位使其离开CXCL8启动子结合区域而进入核旁小体,导致IL-8转录激活[15]。研究发现在病毒感染早期Lnczc3h7a可与泛素连接酶TRIM25和活化的视黄酸诱导基因蛋白-Ⅰ(RIG-Ⅰ)结合,促进TRIM25介导的RIG-Ⅰ参与的K63连锁泛素化,使Ⅰ型干扰素产生增加并调节抗病毒先天免疫反应[36]。而宿主来源、Ⅰ型干扰素诱导产生的Lnc-Lsm3b可作为诱饵分子与病毒RNA竞争性结合RIG-Ⅰ单体,限制RIG-Ⅰ蛋白构象转移,阻止下游信号传递,终止IFNs过度产生,在免疫应答晚期发挥负反馈调节作用[24]。
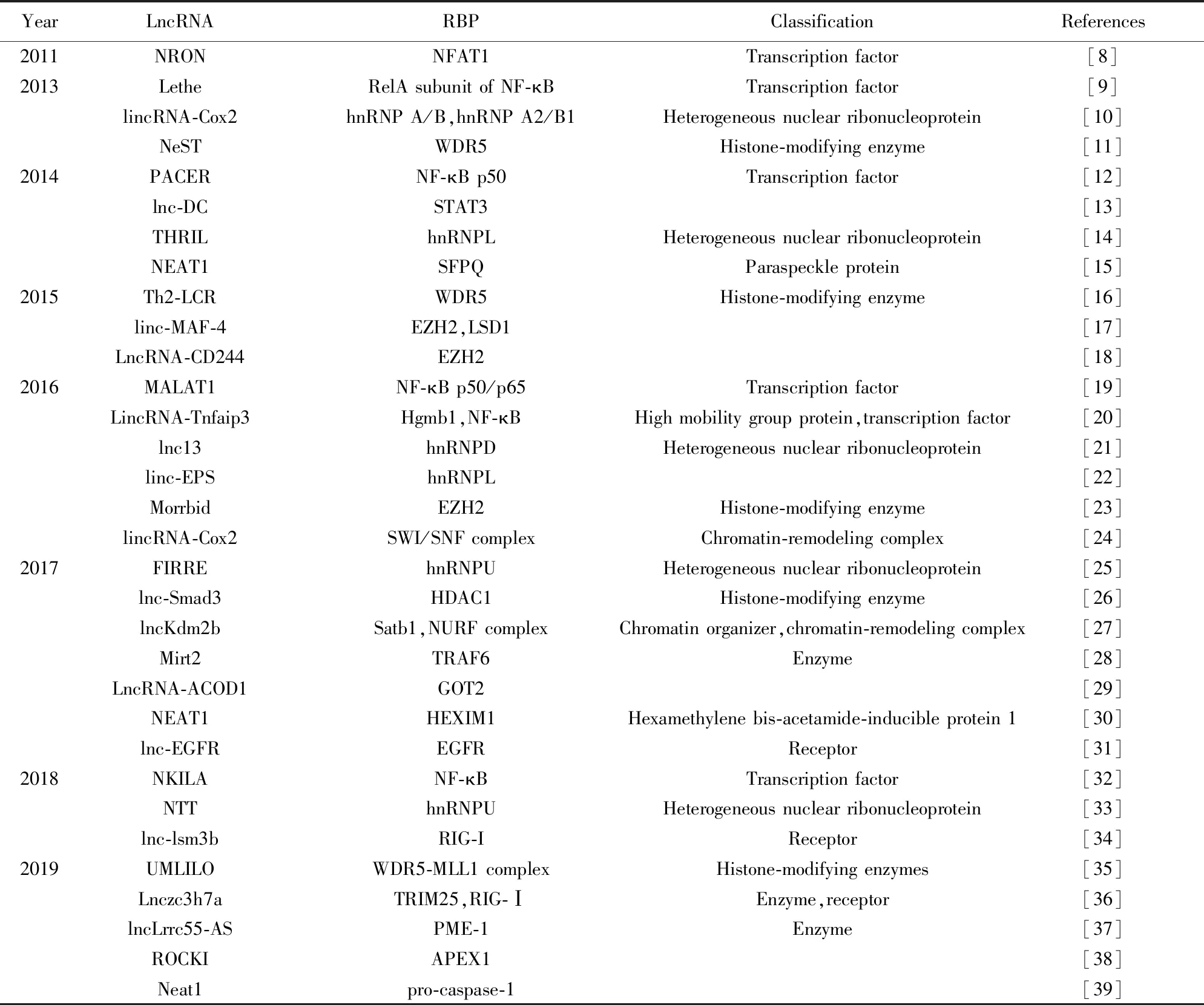
表1 免疫系统中LncRNA结合蛋白的属性分类

表2 LncRNA和RBP在免疫细胞中的免疫调节功能
3 总结与展望
LncRNA分子和RBP在多种细胞的免疫应答中具有重要调控功能。近年研究虽取得较大进展,但两者作用机制复杂,尚有多种作用机制未被明确阐明,且目前研究具有局限性,LncRNA物种间的差异亦导致目前研究缺陷。因此,将功能性LncRNA分子和RBP整合于自身免疫系统,深入研究两者的作用机制,探讨不同物种间LncRNA-RBP复合物的作用机制差异,可加深对疾病发生发展的认识,为自身免疫性疾病的预防、诊断和治疗提供新的思路和方案。

