中药大黄对重症急性胰腺炎肺损伤大鼠肺泡巨噬细胞凋亡的影响
李孝全 莫静欣
(湖北医药学院附属人民医院急危重症中心,十堰 442000)
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种易并发多器官衰竭综合征的炎性疾病,是由胰酶对胰腺自我消化引起的氧化应激反应及全身各器官炎症损伤反应[1]。SAP引起的肾衰竭和肺损伤在临床上非常常见,严重时引起急性心肌炎,死亡率极高[2]。中药在中国有几千年的应用历史,其中最早与胰腺炎治疗相关的中药是大黄[3]。《神农本草经》记载,大黄为寥科植物,以干燥的根或根茎入药,其味苦寒,具下淤血、推陈致新、调中化食等功效[4]。现代医学发现,大黄具抗菌、抗炎、保肝利胆、改善肾功能等作用[5]。大量研究报道大黄具有治疗SAP作用,但作用机制尚未明确[6]。本研究通过观察大黄对SAP大鼠肺泡巨噬细胞凋亡、炎症因子分泌及JAK2/STAT3信号通路的影响,揭示大黄治疗SAP的机制与JAK2/STAT3信号通路的关系。
1 材料与方法
1.1材料 清洁级SD大鼠60只,体质量180~220 g,购自上海凯学生物公司;大黄免煎颗粒购自河北第二医院中药房;TNF-α检测试剂盒、人NO ELISA检测试剂盒购自碧云天;Annexin V-FITC/PI凋亡检测试剂盒购自北京索莱宝公司;胰蛋白酶购自美国Sellect公司;SDS-PAGE 试剂盒、ECL发光液、RIPA蛋白裂解液、BCA蛋白定量试剂盒和逆转录试剂盒购自大连TaKaRa公司;PVDF膜购自Roche公司;大鼠肺泡巨噬细胞分离培养试剂盒购自无锡欣润生物;兔抗鼠p-JAK2多克隆抗体、兔抗鼠p-STAT2多克隆抗体、HRP标记的羊抗鼠抗体购自上海信裕生物科技有限公司。
1.2方法
1.2.1SAP大鼠模型的建立及分组大黄溶液的制备 大黄免煎颗粒用无菌生理盐水配制成1 g/L的大黄溶液。将60只清洁级SD大鼠随机分成3组:假手术组(Sham组)、SAP组、大黄组(Rhubarb组),每组20只。参照吕冠华等[7]的方法对大鼠行开腹手术,5%牛磺胆酸钠 (1 ml/kg)经十二指肠缓慢注入胆管,建立大鼠SAP模型,标记为SAP组。Sham组:将20只大鼠开腹后翻动十二指肠,然后关闭腹部。Sham组和SAP组大鼠术后3 h给予生理盐水灌胃(1 ml/200 g),2次/d,间隔12 h。Rhubarb组大鼠术后3 h给予等剂量1 g/L大黄溶液灌胃,2次/d,间隔12 h。72 h后处死大鼠,摘取左肺,分离肺泡巨噬细胞。按照大鼠肺泡巨噬细胞分离培养试剂盒说明书分离巨噬细胞,用组织处理缓冲液、组织解离缓冲液、组织解离液、大鼠巨噬细胞培养缓冲液、大鼠巨噬细胞完全培养液分离、培养并纯化大鼠巨噬细胞。
1.2.2ELISA实验 收集各组大鼠肺泡巨噬细胞,按照TNF-α检测试剂盒说明书和人NO ELISA检测试剂盒说明书检测大鼠肺泡巨噬细胞上清中TNF-α及NO含量。
1.2.3大鼠肺病理性形态观察 按照文秀华等[8]的实验方法进行大鼠肺组织病理切片的制作和评分。
1.2.4大鼠肺湿/干重比率测定 称量各组大鼠左肺重量,记为肺湿重,置于80℃烘箱烘烤约20 h至恒重,取出称重,记为肺干重。肺湿/干重比率=肺湿重/肺干重 × 100%。
1.2.5SAP大鼠肺泡巨噬细胞凋亡测定 收集各组大鼠肺泡巨噬细胞,按照Annexin V FITC/PI凋亡检测试剂盒说明书要求操作,加入Annexin V-FITC和PI,流式细胞仪测定结果。细胞凋亡率(%)=早期凋亡率+晚期凋亡率。每个样品重复3次。
1.2.6SAP大鼠肺泡巨噬细胞TNF-α、iNOS mRNA检测 收集各组大鼠肺泡巨噬细胞,试剂盒提取RNA,定量后逆转录成cDNA。qRT-PCR检测TNF-α、iNOS mRNA,2-ΔΔCt计算TNF-α、iNOS表达。TNF-α引物,F:5′-ATGAGCACTGAAAGCATGATCCG-3′,R:5′-TCACAGGGCAATGATCCCAAA-3′;iNOS引物,F:5′-TGCCTGTATGCTGATGCG-3′,R:5′-GGATGTCGGACTTTGTAGATT-3′;GAPDH引物,F:5′-TCCCTC-AAGATTGCTAGCAA-3′,R:5′-AGATCCACAACGG-ATACATT-3′。PCR条件为:94℃变性2 min;94℃ 30 min,58℃ 30 s,72℃ 30 s,循环45次;72℃延伸2 min。
1.2.7SAP大鼠肺泡巨噬细胞p-JAK2、p-STAT3蛋白表达测定 收集各组大鼠肺泡巨噬细胞,冰上裂解30 min。12 000 r/min离心10 min。取上清置于EP管,加入5×SDS上样缓冲液,沸水煮沸10 min。电泳后用转膜仪将蛋白转移至PVDF膜;5 %脱脂奶粉封闭2 h,洗膜,加入一抗(兔抗鼠p-JAK2多克隆抗体、兔抗鼠p-STAT3多克隆抗体),4℃过夜孵育,洗膜,加二抗(HRP标记的羊抗鼠抗体),4℃孵育 2 h。加发光液曝光。

2 结果
2.1胰腺组织病理性形态学观察 与Sham组相比,SAP组大鼠胰腺组织病例评分显著升高(P<0.05,图1)。
2.2SAP组大鼠血清淀粉酶水平变化 与Sham组相比,SAP组大鼠血清中血清淀粉酶含量显著升高,与SAP组相比,Rhubarb组大鼠血清中血清淀粉酶含量显著降低(P<0.05,图2)。
2.3SAP组大鼠肺湿/干重比率变化 与Sham组相比,SAP组大鼠肺湿/干重比率显著升高,与SAP组相比,Rhubarb组大鼠肺湿/干重比率显著降低(P<0.05,图3)。
2.4大黄对SAP大鼠肺泡巨噬细胞凋亡影响 与Sham组相比,SAP组大鼠巨噬细胞凋亡率显著降低,与SAP组相比,Rhubarb组大鼠巨噬细胞凋亡率显著升高(P<0.05,图4)。

图1 胰腺组织病理性形态学观察(×200)Fig.1 Pathological morphological observation of pancreas(×200)Note:A.Histopathological examination of pancreas;B.Histopathological score of pancreas.Compared with Sham group,*.P<0.05.

图2 SAP组大鼠血清淀粉酶水平变化Fig.2 Changes in serum amylase levels in rats of SAP groupNote:Compared with Sham group,*.P<0.05;compared with SAP group,#.P<0.05.

图3 SAP组大鼠肺湿/干重比率变化Fig.3 Changes in lung wet/dry weight ratio in rats of SAP groupNote:Compared with Sham group,*.P<0.05;compared with SAP group,#.P<0.05.
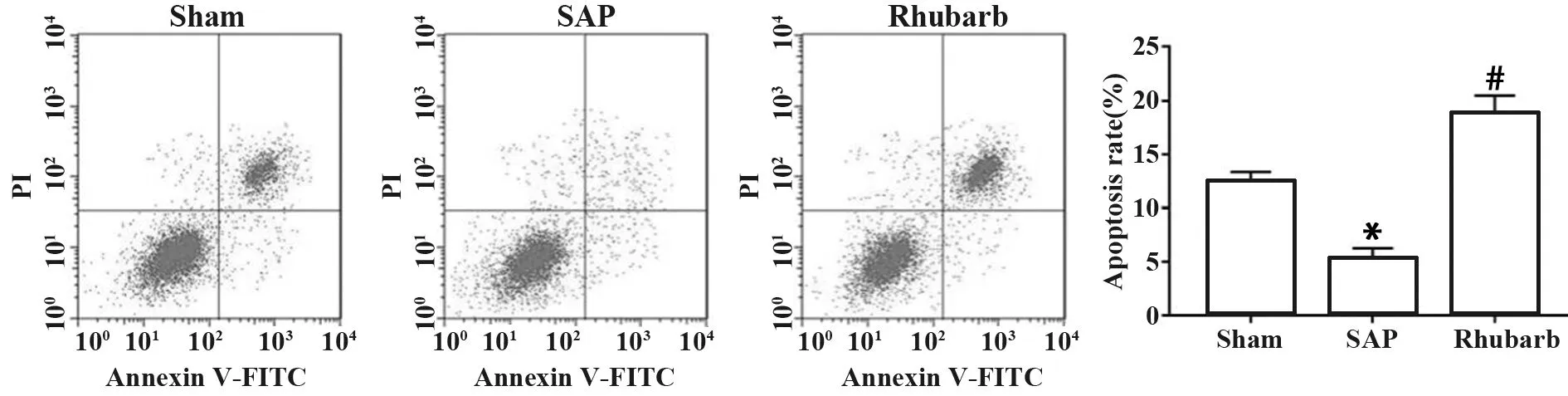
图4 大黄对SAP大鼠肺泡巨噬细胞凋亡的影响Fig.4 Effect of rhubarb on apoptosis of alveolar macrophages in SAP ratsNote:Compared with Sham group,*.P<0.05;compared with SAP group,#.P<0.05.
2.5大黄对SAP大鼠肺泡巨噬细胞TNF-α、NO水平影响 与Sham组相比,SAP组大鼠巨噬细胞TNF-α、NO含量均显著升高,与SAP组相比,Rhubarb组大鼠巨噬细胞TNF-α、NO含量均显著降低(P<0.05,图5)。

图5 大黄对SAP大鼠肺泡巨噬细胞TNF-α、NO水平的影响Fig.5 Effect of rhubarb on levels of TNF-α and NO in alveolar macrophages of SAP ratsNote:Compared with Sham group,*.P<0.05;compared with SAP group,#.P<0.05.

图6 大黄对SAP大鼠肺泡巨噬细胞TNF-α、iNOS mRNA表达的影响Fig.6 Effect of rhubarb on expression of TNF-α and iNOS mRNA in alveolar macrophages of SAP ratsNote:Compared with Sham group,*.P<0.05;compared with SAP group,#.P<0.05.

图7 大黄对SAP大鼠肺泡巨噬细胞JAK2/STAT3信号通路的影响Fig.7 Effect of rhubarb on JAK2/STAT3 signaling pathway in alveolar macrophages of SAP ratsNote:Compared with Sham group,*.P<0.05;compared with SAP group,#.P<0.05.
2.6大黄对SAP大鼠肺泡巨噬细胞TNF-α、iNOS mRNA表达影响 与Sham组相比,SAP组大鼠巨噬细胞TNF-α、iNOS mRNA相对表达量均显著升高,与SAP组相比,Rhubarb组大鼠巨噬细胞TNF-α、iNOS mRNA相对表达量均显著降低(P<0.05,图6)。
2.7大黄对SAP大鼠肺泡巨噬细胞JAK2/STAT3信号通路影响 与Sham组相比,SAP组大鼠巨噬细胞中p-JAK2、p-STAT3蛋白表达均显著升高,与SAP组相比,Rhubarb组大鼠巨噬细胞中p-JAK2、p-STAT3蛋白表达均显著降低(P<0.05,图7)。
3 讨论
大量研究报道,大黄具有治疗胰腺炎功能,但其作用机制尚未明确[9,10]。Zhao等[6]在大鼠SAP肺损伤的研究中报道,大黄可抑制大鼠SAP淀粉酶水平和炎症因子分泌,揭示大黄在SAP中的保护功能。杨宝晶等[11]报道,大黄素通过下调SAP大鼠肺损伤中TNF-α、IL-6水平,上调IL-10、Treg、Foxp3水平减轻SAP肺损伤。Zhou等[12]在SAP患者的研究中发现,粗大黄可作为生长抑制素显著抑制并发症的产生,减轻胰腺炎患者痛苦。本研究建立牛黄胆酸钠诱导的SAP大鼠模型,通过病理组织学观察、肺干湿重比和淀粉酶含量测定验证模型的成功构建,为研究大黄对SAP大鼠模型的药物治疗奠定基础。
凋亡是细胞为维持内环境稳定进行的自主有序死亡的过程,与人类机体许多疾病密切相关。He等[13]报道,胰腺炎细胞的凋亡周期延长,提示细胞凋亡异常降低与SAP病理进程有关。本研究检测了大黄治疗的SAP大鼠肺泡巨噬细胞凋亡,发现大黄治疗后细胞凋亡率显著升高,与He等的研究结果一致,表明大黄可逆转胰腺炎大鼠肺泡巨噬细胞的凋亡抑制功能。
炎症细胞因子是内源性多肽类细胞调节免疫系统细胞生成的总称,包括白细胞介素、干扰素、生长因子、细胞刺激因子、肿瘤坏死因子等。细胞因子主要由外周免疫细胞合成(如巨噬细胞、淋巴细胞、纤维母细胞),但许多其他类型的细胞(如神经细胞、神经胶质细胞)也可产生细胞因子[14]。炎症因子为细胞因子的一部分,促炎因子包括瘤坏死因子、IL-6和IL-1家族细胞因子等[15]。Zhang等[16]研究发现,SAP大鼠模型中血清淀粉酶AMY和TNF-α水平均明显升高,大黄治疗可显著降低AMY和TNF-α水平,并减缓胰腺和其他组织的病理变化。本研究通过ELISA检测了大黄治疗的SAP大鼠肺泡巨噬细胞中TNF-α、NO含量,发现TNF-α、NO含量均显著降低;qRT-PCR结果表明,大鼠巨噬细胞中TNF-α、iNOS mRNA表达明显降低,提示大黄具有抑制SAP大鼠炎症水平作用,为大黄在胰腺炎治疗的应用提供理论依据。
Janus家族酪氨酸激酶Jaks和信号转导转录激活因子STAT蛋白是多种信号转导途径的关键,积极参与细胞的存活、增殖、分化和凋亡[17]。Jaks与许多细胞因子和生长因子受体有组成性相关,活化的Jaks最终诱导STAT磷酸化,调节靶基因表达[18]。吴丽等[19]研究发现,大黄附子能抑制SAP小鼠腹腔巨噬细胞中JAK2和STAT3表达水平和炎症因子TNF-α及IL-6含量。本研究通过Western blot检测大黄治疗的SAP大鼠肺泡巨噬细胞p-JAK2、p-STAT3蛋白表达发现,大黄可下调p-JAK2、p-STAT3蛋白表达,提示大黄可使JAK2/STAT3信号通路失活,说明大黄在SAP中发挥治疗作用的机制与抑制炎症因子分泌和JAK2/STAT3信号通路失活密切相关。
综上所述,中药大黄可促进SAP大鼠肺泡巨噬细胞凋亡,其机制可能与抑制炎症因子分泌及失活JAK2/STAT3信号通路有关。

