基质刚性影响声孔效应介导的单细胞基因转染∗
荣 宁 汪 曣 范真真
(天津大学精密仪器与光电子工程学院 天津 300072)
0 引言
作为一种非病毒式、非侵入性的方法,超声和靶向微泡结合在药物导入及基因治疗方面展现出巨大的应用潜能[1−4]。然而体外细胞培养环境与体内环境差异巨大,导致体外研究成果难以直接应用到临床治疗。近年来,越来越多的证据表明细胞生长环境的物理特性对细胞形貌以及功能具有显著影响[5−6]。研究表明,单独调节细胞外基质刚性可以实现对细胞迁移、增殖甚至分化等复杂过程的调控[7−8]。研究表明,微泡对不同模式的超声激励产生了不同程度的放大聚焦作用[9−10],在超声激励下微泡空化[11]会引发细胞膜周围的流体作用[12],进而影响细胞膜表面有小孔打开,使得药物和外源基因得以进入细胞实现药物和基因的导入和治疗。质粒DNA 的转染过程是一个复杂的生物物理过程,该过程与微泡的空化以及细胞功能等密切相关[13−14]。体外细胞培养实验常用的培养皿材质通常为玻璃(弹性模量值为5.1∼11.9 GPa[15]) 或塑料(弹性模量值为0.1 GPa[16]),而在体组织的基质刚性范围则在100 kPa 以内,脑组织的基质刚性甚至在1 kPa 以下[7]。体外细胞培养用的培养皿基质刚性比体内组织的刚性高出几个数量级,这就影响了体外细胞研究成果向临床治疗的转化。基质刚性如何影响质粒DNA 的转染效果尚不清楚。本文旨在探究细胞外基质刚性对质粒DNA 转染效果的影响及规律。制作不同刚性的凝胶基质进行基因转染实验,获取到基质刚性对质粒转染效果的影响。并对不同基质刚性上的转染实验进行质粒DNA示踪,以期获取质粒在不同刚性基质上进入细胞方式的差异。进一步的细胞骨架蛋白分布从实验角度揭示产生转染效果差异的原因。
1 实验材料及方法
1.1 实验材料
为了制作不同硬度的凝胶基质,采用3-氨基丙基三乙氧基硅烷(3-Aminopropyltriethoxysilane,APES)、二氯二甲基硅烷(Dichlorodimethylsilane,DCDMS)、25%(体积比)戊二醛溶液、40%(质量体积比)丙烯酰胺原液、2%(质量体积比)双丙烯酰胺溶液、四甲基乙二胺(Tetramethylethylenediamine,TEMED)、过硫酸铵(Ammonium persulfate,APS)以及交联剂sulfo-SANPAH 等试剂,均购自sigma公司。力学信号敏感的小鼠成纤维细胞NIH 3T3采用10%胎牛血清+90%高糖DMEM 以及1%双抗培养。选用SIM4-5 超声微泡,购自Advanced Microbubbles laboratories LLC 公司。RGD 多肽用于将微泡造影剂靶向连接在细胞膜表面。超声实验示意图如图1所示。
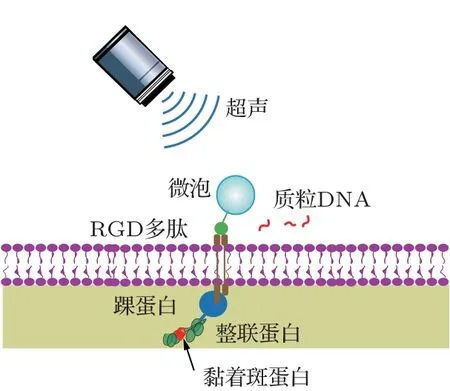
图1 质粒转染实验示意图Fig.1 Schematic illustration of plasmid transfection
1.2 实验方法
凝胶基质制作参考文献[17]中的方法,通过调节丙烯酰胺单体和双体比例实现对凝胶基质刚性的调节。制作硬度不同的凝胶基质,采用原子力显微镜赫兹模型对凝胶基质的杨氏模量进行检测。最终用于实验的软的凝胶基质测得的杨氏模量值为(0.2±0.05) kPa,硬的凝胶基质杨氏模量为(40±1.2) kPa。I型胶原蛋白溶液稀释到50 µg/mL,滴加到用Sulfo-SANPAH 活化过的凝胶基质上,室温静置过夜,使胶原蛋白溶液充分吸附到凝胶基质表面。传代前向凝胶基质表面加入完全培养基室温孵育30 min。将携带凝胶的玻璃底培养皿置于生物安全柜内紫外灭菌0.5 h。将NIH 3T3 传代到凝胶基质上,细胞密度为104细胞/cm2。37◦C、5% CO2培养箱内培养24 h,细胞融合度达到60%。
选用携带增强型绿色荧光蛋白(Green fluorescent protein,GFP)基因的质粒DNA进行基因转染实验。选择单脉冲串超声激励,声压在0.45 MPa,超声持续10 µs。质粒DNA 浓度为10 µg/ml。超声激励结束后将细胞更换新鲜的完全培养基,继续放回二氧化碳培养箱培养24 h。倒置荧光显微镜观察绿色荧光蛋白表达情况,并计算转染效率。为了研究凝胶基质的刚性对声致穿孔诱导的质粒DNA 导入效果的影响,对细胞内的质粒DNA 进行示踪,采用Cy3对质粒DNA进行荧光标记。用Cy3标记过的质粒DNA进行超声实验。超声激励前,采用Hoechst 33342 对细胞核染色。超声激励结束后5 min,采用4%多聚甲醛室温下对细胞固定10 min。磷酸盐缓冲液(Phosphate buffer saline,PBS)冲洗2次。共聚焦显微镜三维层扫细胞内的质粒DNA分布。层扫间距为1 µm。
采用FITC标记的鬼笔环肽对细胞骨架蛋白进行染色,对照组对分别培养在0.2 kPa 和40 kPa 硬度的凝胶基底上的细胞进行固定染色。实验组选用声压为0.45 MPa 的单脉冲串超声对分别培养在0.2 kPa和40 kPa硬度的凝胶基底上的细胞进行超声激励。超声脉冲串持续时间为10 µs。超声激励后40 s 吸走培养皿内的PBS 缓冲液,采用4%的多聚甲醛溶液立即对超声激励后的细胞固定10 min。PBS 缓冲液冲洗3 次,加入FITC 标记的鬼笔环肽,终浓度为10µg/mL。室温孵育40 min。PBS缓冲液冲洗3次。滴加10 µL Hoechst 33342溶液进行细胞核染色10 min。共聚焦显微镜(Olympus FV3000,60倍油镜)三维扫描荧光成像。
每组实验至少重复3 次。采用Origin 8.5 软件进行统计学分析,计量数据采用平均值± 均方根(x±m)表示。采用单因素方差分析比较各实验组结果存在的差异,以p <0.05 具有统计学意义。
2 结果与分析
2.1 基质刚性对质粒DNA转染效果的影响
将NIH 3T3 细胞分别培养在杨氏模量值为0.2 kPa、3 kPa、10 kPa、20 kPa、40 kPa的凝胶基质上,如图2所示,细胞培养在 10 kPa的凝胶基质上时细胞形貌差别不大,细胞呈现出成纤维细胞梭形形貌。而0.2 kPa 凝胶上的细胞形貌则呈现出圆形,与40 kPa 凝胶上的细胞形貌差异很大。因此最终选取了0.2 kPa和40 kPa两个参数研究基质刚性对质粒DNA 转染效果的影响。这两个弹性模量值也是参考文献中研究基质刚性对细胞功能影响实验中常见的具有代表性的数值[7,18−19]。
如图3(a)、图3(b)所示,不同刚性的凝胶基质上培养的细胞,在超声激励后24 h,细胞形貌仍然保持显著性差异。软的凝胶基质上的细胞保持圆形,细胞面积更小,硬的凝胶基质上培养的细胞延展性更好,细胞保持梭形状态,细胞表面积更大。由绿色荧光蛋白的表达情况来看,质粒DNA 均可以成功导入进细胞并实现表达。

图2 不同刚性凝胶基质上培养的细胞形貌Fig.2 Cell morphology cultured on hydrogel with different rigidities
质粒DNA 绿色荧光蛋白的表达效率e采用荧光显微成像的方法收集数据,超声实验时对超声作用区域用马克笔进行标记。超声激励前后靶向微泡的响应采用倒置荧光显微镜进行记录。统计该视野下微泡发生响应的细胞比例α。超声激励后24 h,对超声激励区域用倒置荧光显微镜拍摄绿色荧光,计数超声激励区域表达绿色荧光的细胞数量β,以及同一视野下的细胞总数N。

如图3(c)所示,在相同的超声条件激励下(0.45 MPa,10 µs),硬的凝胶基质上培养的成纤维细胞,绿色荧光蛋白的表达效率显著高于软的凝胶基质上培养的细胞。

图3 绿色荧光蛋白在细胞内表达Fig.3 GFP expression in NIH 3T3 cells

图4 质粒DNA 在细胞内的分布Fig.4 Plasmid DNA intracellular distribution
2.2 基质刚性对质粒DNA导入方式的影响
为了进一步研究造成不同刚性基质上质粒转染效率差异的原因,对质粒DNA 进行荧光标记示踪。由图4荧光图像可知,两种不同硬度的凝胶基质上培养的细胞,在靶向微泡位点附近均有质粒DNA嵌入到细胞膜,表明对于两种不同硬度凝胶基质上培养的细胞,质粒DNA 均可以通过声致穿孔产生的细胞膜小孔被导入进细胞内。当细胞被培养在软的凝胶基质(0.2 kPa)上,细胞内在远离微泡位点的空间内观察到更多尺度在微米级的质粒DNA团簇,表明质粒DNA同时可以通过其他方式进入细胞内。对质粒DNA 在细胞内的空间分布进行量化分析可知,软的凝胶基质上培养的细胞可以摄取更多的质粒DNA,如图5(a)所示。但硬的凝胶基质上培养的细胞,与靶向微泡位点吻合的质粒DNA 比例更高,推测当细胞被培养在硬的凝胶基质上时声致穿孔引发的细胞膜小孔是质粒DNA 实现转染并表达的更为有效的方式。将细胞内距离细胞膜5 µm 的范围划为细胞外周,距离细胞膜大于5 µm 则划为细胞内周,统计整个细胞内的质粒DNA 荧光强度以及细胞外周的质粒DNA 荧光强度。细胞边缘质粒DNA 的百分率b为细胞膜附近5 µm 范围内DNA荧光强度值除以整个细胞内的DNA 荧光强度值。细胞中心DNA 的荧光强度值则为1−b。由图5(c)可知,培养在硬的凝胶基质上有更多比例的质粒DNA快速向细胞内部转移。

图5 质粒DNA 在细胞内的分布统计Fig.5 Statistics of plasmid DNA intracellular distribution

图6 不同刚性基质上细胞骨架蛋白(F 肌动蛋白)分布Fig.6 Intracellular distribution of F-actin in cells cultured on different rigidities
2.3 基质刚性对细胞骨架蛋白的影响
培养在不同刚性凝胶基质上的细胞,细胞质内的F肌动蛋白分布规律显著不同。如图6(a)、图6(b)未打超声的对照组所示,培养在软的凝胶基质上的细胞,细胞内的肌动蛋白更多以分散或团簇形式分布,而培养在硬的凝胶基质上的细胞,细胞内的肌动蛋白则以肌动蛋白纤维丝的形态分布。两种不同刚性基质上培养的细胞在靶向微泡连接位点处均可观察到小的肌动蛋白“团聚”现象,表明在靶向微泡连接位点处均有黏着斑形成。超声激励组如图6(c)、图6(d)所示,软的凝胶基质上培养的细胞在超声激励后40 s 由于球形蛋白分布更有利于细胞膜流动,细胞膜表面小孔完成修复,微泡附近的肌动蛋白“团聚”现象消失。而硬的凝胶基质上培养的细胞,纤维状肌动蛋白主要起到支撑作用,小孔愈合更多需要借助肌球蛋白运动等过程完成,因此细胞膜上的小孔愈合过程尚未完成,在靶向微泡位点处可以观察到更大的蛋白“团聚”,推测这与质粒DNA 的摄取方式有关。软的凝胶基质上培养的细胞细胞膜流动性更强,更容易发生内吞作用将质粒DNA 摄入细胞内。硬的凝胶基质上培养的细胞肌动蛋白更多以纤维丝状结构存在,此时会预留更多的时间供质粒DNA通过小孔进入细胞。
3 结论
本文实验研究了基质刚性对质粒DNA 转染效果的影响,并对质粒DNA 导入细胞的方式进行进一步研究。获悉培养在不同刚性基质上的细胞,由于不同种类的质粒DNA 摄取方式所占比重有所差异,导致DNA 的表达效果显著不同,硬的凝胶基质上声致穿孔引发的细胞膜小孔可以作为质粒DNA转染更为有效的途径,质粒的表达效果也更好。进一步的细胞骨架蛋白分布结果揭示了不同硬度基质上的细胞摄取质粒DNA 方式差异的原因可能来自于细胞骨架蛋白的形态差异,该差异导致软的凝胶基质上培养的细胞更容易以非物理小孔的方式将质粒DNA 摄入细胞,而硬的凝胶基质上培养的细胞则可以更多的通过声致穿孔产生的小孔摄入质粒DNA。这对理解细胞培养环境的物理特性差异引起的基因类药物导入效果差异具有重要的指导意义。但受到实验条件的限制,未能实验检测出引起质粒DNA 导入的动力——微泡对超声的动力学响应。进一步工作将联合高速显微成像系统对引起质粒转染的动力学因素——微泡振动以及微流体剪切力进行检测分析,深入挖掘基质刚性引起质粒DNA 转染差异的原因。基质的物理刚性对细胞形貌以及力学特性影响显著,进一步工作将对基质刚性引起的细胞形貌差异对质粒DNA 转染差异的影响规律进行研究。

